1. Способы выражения концентрации раствора
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
Тема 2. Электронное строение. Введение: обязательно нужна таблица электронных эффектов, помещена в голубой методичке в третьей теме. Все заместители до бензола называем электронодонорными и пишем как ЭД, после бензола – электроноакцепторными и называем ЭА. Сам бензол, Типичные вопросы:
Пример:  Смиритесь, дорогие любители химии, это безнадежно… Как с этим бороться: Никак, смиритесь, это не дано большинству студентов РНИМУ. Строить какие-то глобальные зависимости - ЭД заместители понижают кислотность и усиливают основность, - ЭА заместители напротив, усиливают кислотность и понижают основность, - чем сильнее кислота, тем больше Ка, меньше рКа и меньше рН ее раствора, - более сильной кислоте соответствует более слабое сопряженное основание, - чем сильнее основание, тем больше Кв, меньше рКв, меньше Квн+, больше рКвн+, больше рН раствора, - более сильному основанию соответствует более слабая сопряженная кислота. -ЭД заместители повышают стабильность катионов и радикалов, понижают устойчивость анионов за счет делокализации отрицательного заряда. -ЭА заместители повышают стабильность анионов, но понижают стабильность катионов и радикалов. И не пытайтесь повторить это дома.
Пример:  Узнали sp2 и sp3? Как с этим бороться: Легкий вопрос. Если у углерода все связи одинарные, а он сам какой нибудь СН3, то это sp3-гибридизация, если у углерода есть двойная связь, типа «СН2=СН-…» или бензольное кольцо, то это sp2-гибридизация Еще гибридизированы таким образом катионы, радикалы и анионы. Надо иметь в виду, что если вещество СН3-СН=СН2, то в нем есть и sp2-, и sp3-гибридизации. Но вообще, вы же сдавали ЕГЭ и наверняка разбираетесь в гибридизации? Там это проходят.
Пример: 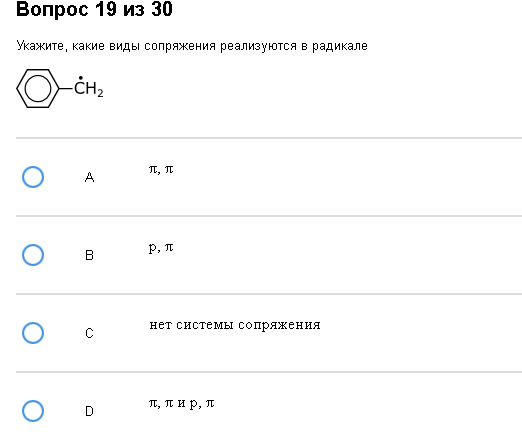 Таки да, оба вида сопряжений Как с этим бороться: успокоиться, расслабиться, осознать, что все не так сложно, как вы пытаетесь это себе представить. Итак, сопряжения бывают р–π (читается как «пэ-пи») и π–π (читается как «пи-пи», хе-хе). π-π сопряжения могут быть реализованы соседством двух двойных связей, разделенных одной одинарной, схематично х=х-х=х, х-любые атомы, возможно, даже и разные. Например, СН2=СН-СН=СН2 – классика π- π сопряжений, а СН2=СН-СН=О уже не классика, но тоже вариант. Частный случай π- π сопряжения – бензол. р- π сопряжения чуть сложнее, реализуются от соседства двойной связи и атома с неподеленной электронной парой (N, O, S, Cl, Br, I, С- внимание! да это С с минусом!), или атома с неспаренным электроном (С. это с с точкой наверху), или атома с пустой орбиталью (С+ атом С с плюсом). Схематично х=х-у, где х-это атомы углерода, а у-что нибудь из перечисленных атомов. Например СН2=СН-О-СН3. Внимание еще раз! Возможна реализация обоих видов сопряжения, например в анилине (привет, первая тема) – бензол сам по себе π- π сопряженная система, а бензол с атомом N – еще и р- π сопряжение образует.
Пример:  Классика-классика. +I. Вероятнее всего, очередной fail. По изначальному замыслу вопрос должен допускать несколько вариантов ответа, ведь у каждой (кроме алкила) группы есть оба эффекта (I и M) 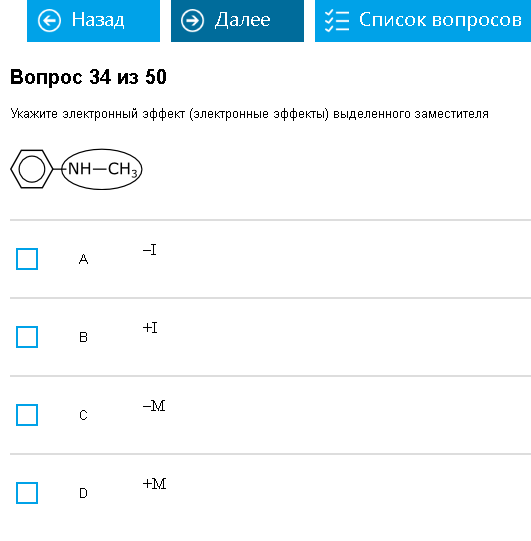 Классика-классика. Починили, наконец-то, теперь можно дать два варианта ответа, что и требуется тут, -I и +M. Как с этим бороться: Важнейшая тема. Для нее то как раз и нужна таблица заместителей. Итак, электронные эффекты бывают индуктивные (I) и мезомерные (М), и те, и другие бывают «+» и «-». Замес этого вопроса как раз и заключатся в том, чтобы узнать, когда какой знак. С индуктивными все просто, берем и смотри в таблице, у какого заместителя он какой. Нужно вам узнать индуктивный эффект у СН3 – берем и узнаем, что для СН3, как и для остальных алкильных радикалов (вы ведь в курсе, что СН3-алкильный радикал?) индуктивный эффект +I. Казалось бы, все просто?
Пример: 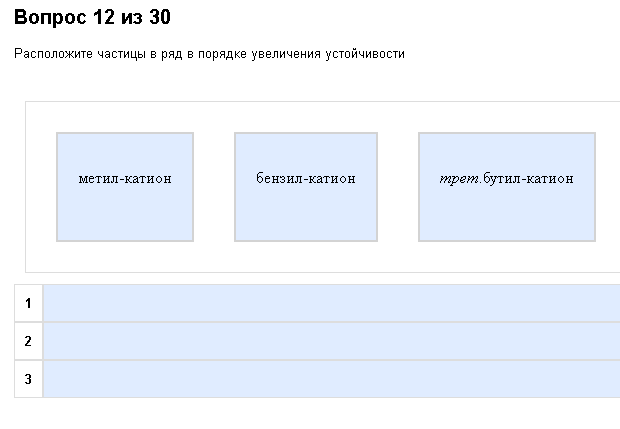 Номенклатура. Кто-нибудь знает, что такое трет.бутил-катион?  Опять fail. Не, ну правда, сколько можно косячить? И снова все дано названиями, а не формулами. Как с этим бороться: Как ни странно, но утверждения, данные в п. 1, имеют место применяться тут. Кратко – суть: есть катионы (+), радикалы (.), анионы (-). Устойчивость катионов и радикалов повышается ЭД-заместителями и понижается ЭА (смотрим таблицу, вспоминаем, что это). Катион или радикал без ничего – средне устойчив. Один СН3 - так себе, чуть лучше. Два СН3 - лучше. Три СН3 - совсем хорошо. Один СН=СН2 – намного лучше, чем даже три СН3. Один С6Н5 (то есть фенильный радикал, то есть гайка) – Зловещая суть фенила: в отношении катионов и радикалов он ЭД, в отношении анионов ЭА.
Пример: 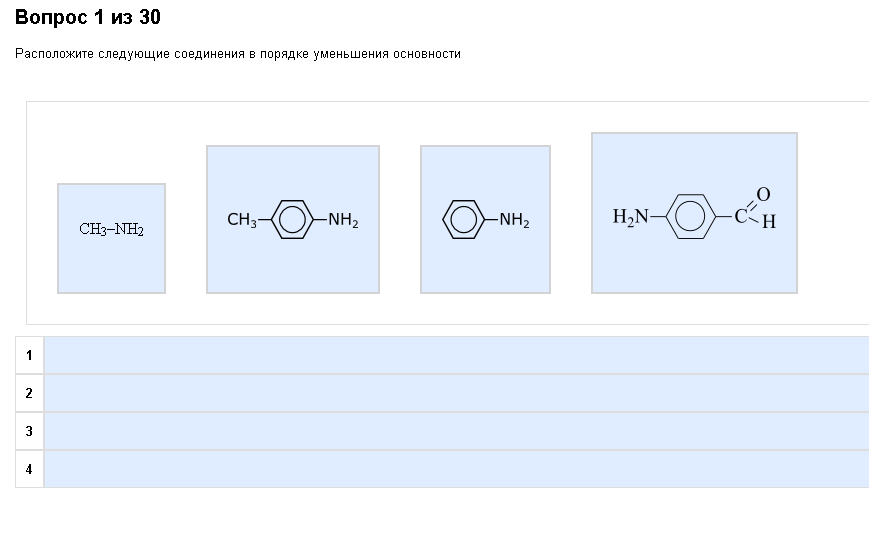 Хоть тут все правильно. Самое слабое основание – аминобензальдегид (гайка и альдегид – два ЭА заместителя, уменьшающие основность амина ниже плинтуса), сильнее – анилин (одна ЭА группа), еще сильнее – метиланилин (ЭА+ЭД заместители для амина) и самый сильный в ряду – метиламин (только ЭД). Как с этим бороться: То же, что и предыдущий вопрос, но со своей атмосферой. Итак. Кислоты – это ОН (спирт), SH (тиол) или СООН (карбоксильная группа), именно в таком порядке увеличивается их кислотность. Почти независимо от прочих факторов ОН Правильный ряд по силе оснований: O2N-C6H4-NH2 < C6H5-NH2 < NH3 < CH3-NH2 < (CH3)2NH Тема 3. Реакции SR, AE, SE. Введение. Внимание, товарищи. Чем дальше, тем сложнее. Дальше идут реакции, для работы с ними требуется какое никакое воображение и понимание простейшего принципа, в реакции одни связи обрываются, другие образуются, одни и те же атомы соединяются иначе – и это дает нам новое вещество. Надеюсь, в школе вас чему-нибудь научили, мои юные любители химии. Иначе дальше работать будет вообще нереально. Часть заданий дано в формулах, часть в названиях, но вы как то с горем пополам разобрались в номенклатуре, так что теперь придется применить полученные знания на практике. Не думаете же вы, что я смогу вам подробно объяснить, что такое диэтиловый эфир, или пропен-2-овая кислота, или 1-метилциклогексен-1, когда они вам встретятся? Их много, а я один. Типичные вопросы:
Пример:  Обратно к школьно-егэшным радостям…  К бутену, однако, у остальных молекул – ЭА заместители. Как с этим бороться: Гидратация – реакция присоединения воды к кратной (двойной) связи. Подробнейшим образом изучается в школе. Вместе с ней изучают и правило Марковникова. Водород при гидратации присоединяется к более гидрированному атому, а ОН (галоген в случае гидрогалогенирования) – к менее гидрированному. Правило Марковникова нарушается в случае, если у двойной связи есть ЭА (вот и вторая тема в ход пошла) заместитель. Например, СН2=СН-СООН (акриловая кислота) гидратируется против правило Марковникова. Это значит, что водород присоединяется к менее гидрированному атому (это будет средний С), а ОН к более гидрированному (то есть левому С). Итак, реакция: СН2=СН-СООН + Н2О → НО-СН2-СН2-СООН. Думать надо супербыстро, и реакции просчитывать в уме. Такие дела.
Пример:  Дебильные утверждения весьма Как с этим бороться: Утверждения реально дебильны. Берем голубую методичку, открываем ее на начале 3 (или 4) темы. Там найдете вы кучу определений, и про гидратацию, и про субстрат, и еще 100500 единиц всякой всячины. Подозреваю, что утверждения писались по этому списку.
Пример:  Узнали функциональные группы, алкан в пропане, бензол в бензойной кислоте, алкен в пропеновой кислоте?  Те же яйца, но в профиль. Алкен, конечно же, вступает в Как с этим бороться: Тут главное помнить, что вы еще до сих пор умеете различать классы органических веществ. Конкретно в этом месте вам надо отличать алканы и алкильные радикалы от алкенов и от ароматических углеводородов, т.е. бензола. Дальше все просто: алкилы вступают в SR радикальное замещение, алкены - AE электрофильное присоединение, бензол - SE электрофильное замещение.
Пример:  Опять школьная классика. Как с этим бороться: Вторая тема снова возвращается. ЭД заместители приводят к ускорению/облегчению реакции SE, да еще и являются орто и пара ориентантами. ЭА замесители приводят к замедлению реакции SE, и по совместительству – метаориентанты.
Пример: нету, не заскринил Как с этим бороться: Попалось 1 раз. Поэтому говорю, как есть: Тема 4. Реакции SN. Свойства соединений с σ – связью… Унылая, безрадостная тема. Много непонятных, бессмысленных вопросов. Типичные вопросы:
Пример:  Вот она – унылость в полный рост. Как с этим бороться: Определение, как всегда, есть в методичке. Алкилирующими могут быть или галогеналканы типа СН3-Cl, C2H5-Br или триметилсульфониевая хрень (не пугайтесь, вы почти наверняка знакомы) [(CH3)3S+]Cl- или Br-. Ну, очень изредка, алкилирующим может быть СН3-О-SO2-СН3, но что-то я ее не встречал пока. В биохимии, конечно, свои акилирующие реагенты, но это у вас будет уж точно в следующей серии.
Пример:  И кто же ты, уходящая группа? Куда же ты уходишь? Как с этим бороться: Уходящая группа, как правило, уходит от алкилирующего реагента, хотя и не всегда. В этом случае уходящая группа это галоген Cl, Br или диметилсульфид (CH3)2S для триметилсульфония. В более запущенных случаях уходящая группа может быть Н2О, в еще более запущенных N=N-O, но, надеюсь, до этого не дойдет.
Пример:  Тоже классика, но уже не школьная Как с этим бороться: Легко. Сила нуклеофилов увеличивается в ряду S
Пример: 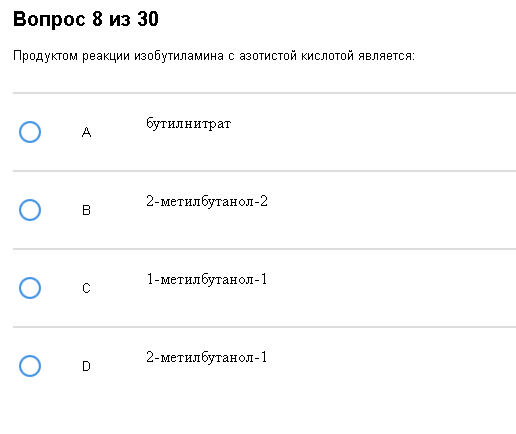 Опять номенклатура все портит. Кстати, очередной косяк. В реакции (СН3)2СН-СН2-NH2 + HNO2 → (СН3)2СН-СН2-ОН + N2 + Н2О, продукт называется 2-метилпропанол-1, а не бутанол. Прикиньте, исходное вещество изобутил = 4 атома С, а продукт метил бутан = 5 атомов С, возможно ли такое? Как с этим бороться: Для успешной борьбы с этим видом реакций надо осознать, что: амин + азотистая кислота = спирт. Все бы ничего, но иногда вопрос с названием может быть нерешаемым (как в примере).
Пример:  И опять номенклатура. Как с этим бороться: Аналогично предыдущему пункту, нужно осознать, что: спирт + галогеноводород (HCl, HBr) = галогеноалкан. Хотя опять же, номенклатуру никто не отменял. Вот если СН3-СН(ОН)-СН3 + НСl = СН3-СН(Сl)-СН3 + Н2О в виде реакции выглядит еще более менее приемлемо, хотя бы можно увидеть, что куда делось, то если сказать, что из изопропилового спирта получился 2-хлорпропан – то это уже просто можно мозг вывихнуть. Особенно в этом примере умиляет, что название исходного вещества дано по радикально-функциональной номенклатуре, а продукта – по заместительной (см. пример). Такие дела.
Пример:  И опять названия. Зато алкен в ответах единственный. Как с этим бороться: Шаблон реакции такой: галогеналкан + щелочи спиртовой раствор = алкен + хлорид натрия + вода. Целевой продукт – алкен, его и ищем в вариантах. Если повезет, он там даже один будет.
Пример: 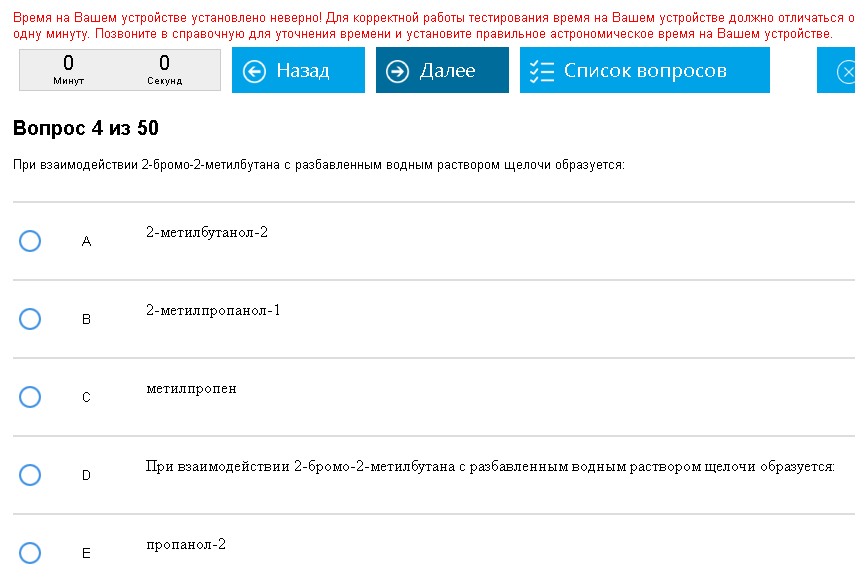 Опять глюки с номенклатурой, нужно понять, что такое 2-бромо, 2-метилбутан. Из него получится 2метил…ол-2, а не 1. Как с этим бороться: Опять шаблон: галогеналкан + щелочи водный (сравн. С п. 6!) раствор = спирт + натрия хлорид, целевой продукт – спирт, ищем его среди ответов.
Пример:  Да, получится тиол, но вот какой еще поди догадайся. (Спойлер – пропантиол-2) Как с этим бороться: На самом деле это то же самое принципиально, что и п. 7, та же самая реакция обмена (замещения), а отличия – косметические, с целью запутать. Вместо NaOH – NaOCH3 (продукт будет простой эфир), NaSH (продукт тиол), NaSCH3 (продукт сульфид). Суть такова же: R-галоген + Na-хрень = R-хрень + Na-галоген, уж простите за размытость формулировки. Ну, например CH3-Cl + Na-SCH3 = CH3-S-CH3 + NaCl.
Пример:  Как раз пример с правилом Зайцева, довольно сложный. Тут получится бутен-2. Как с этим бороться: Очередной шаблончик: спирт = алкен + вода. Вот и выбирайте алкен, и будет вам счастье. Бойтесь, если в вариантах два алкена, там уже думать надо, правило Зайцева вспоминать (если вкратце и примитивно – образуется алкен с двойной связью в середине цепи)
Пример:  Зловещий вопрос, что-то не то вам досталось. Спойлер – ответ этиламин. Как с этим бороться: Смиритесь, никак. Всегда происходит присоединение радикала к атому азота, хоть он в амине, хоть в аммиаке. Если азот один и нет каких то других подозрительных штук типа температуры, щелочей NaOH/KOH – то наверняка получится аммоний, если есть два азота и прочие подозрительные штуки, то получится амин, а уж какой – угадать весьма сложно, а в этом то и есть загвоздка. Надо очень хорошо разобраться, сколько каких радикалов тут будет. |
