1. Способы выражения концентрации раствора
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
Тема 9. Комплексные и малорастворимые соединения… Введение. Тема, которую никто никогда толком не понимал, поэтому не буду давать обобщений, перейдем сразу к примерам. Типичные вопросы:
Пример: 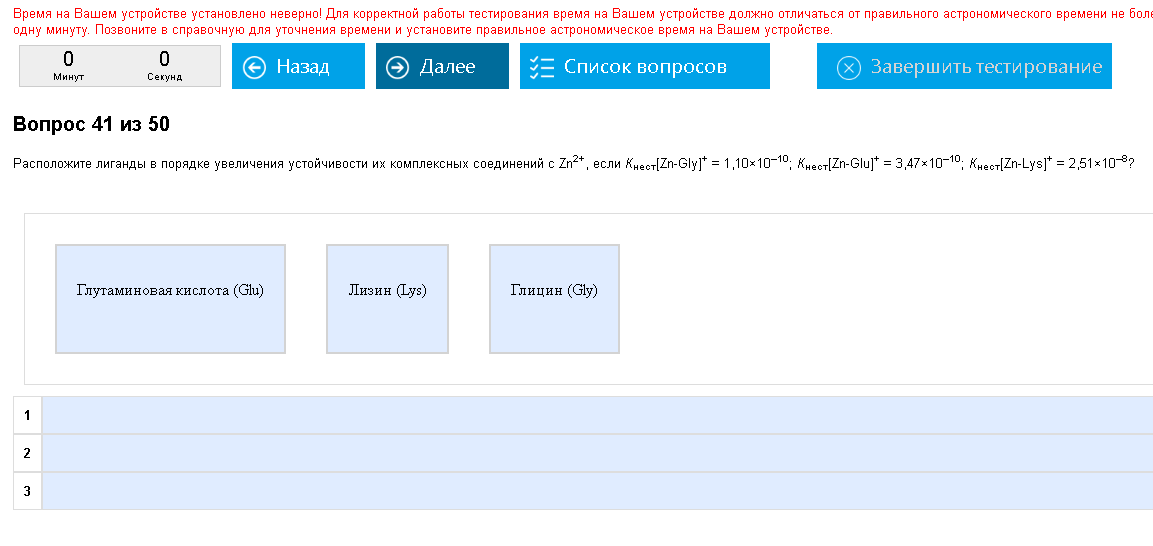 Как с этим бороться: Чем больше Куст (константа устойчивости) или чем меньше Кнест, тем: устойчивее комплекс; меньше концентрация иона комплексообразователя. Блин, капец как внимание! Не перепутайте, что увеличивается, а что уменьшается!!! Это очень просто сделать. Читайте внимательно условия мелким шрифтом написанные, это важно. В примере нужно расположить комплексы в порядке повышения устойчивости, а из теории известно, что чем меньше Кнест, тем устойчивее комплекс. Значит, комплекс с самой большой Кнест будет первым и самым неустойчивым, а дальше в порядке уменьшения Кнест. Отдельная проблема – сравнение таких
Пример: 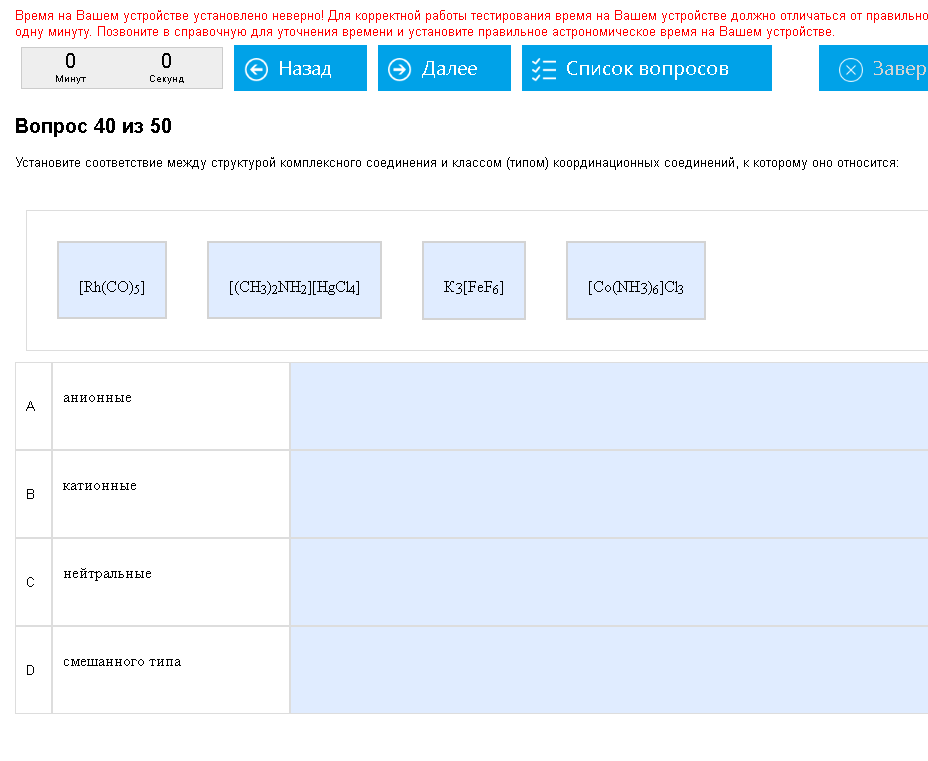 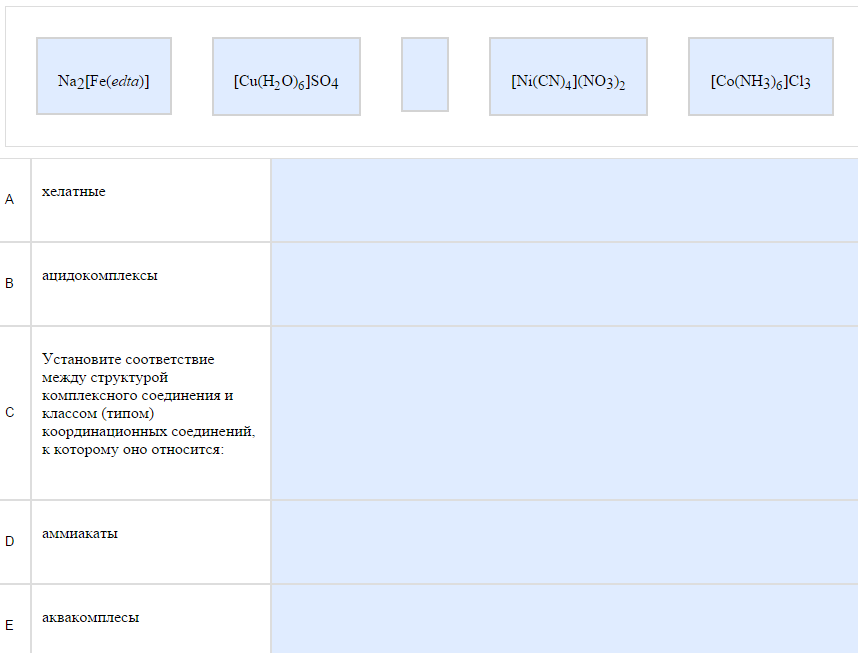 Блять! Сколько можно косячить?. Блять! Сколько можно косячить?.Как с этим бороться: Нейтральные – комплексы не содержащие т.н. внешней сферы, то есть за квадратными скобками ничего нет. Катионные – содержат внешнюю сферу-анион (ОН, Cl..), анионные – содержат внешнюю сферу-катион (К, Na…), смешанные – двое квадратных скобок. Еще попадались аква-комплексы – содержат Н2О уже в квадратных скобках, циано содержат CN-ион, хелатные – en (этилендиамин), амино-комплексы содержат NH3.
Пример: Пример. Что то я не заскринил Как с этим бороться: Для более полного осаждения надо добавлять второй ион или тот электролит, который его содержит. Например, для более полного осаждения Ca из насыщенного раствора CaSO4 надо было бы добавить что-нибудь, где есть SO4, H2SO4 например.
Пример: 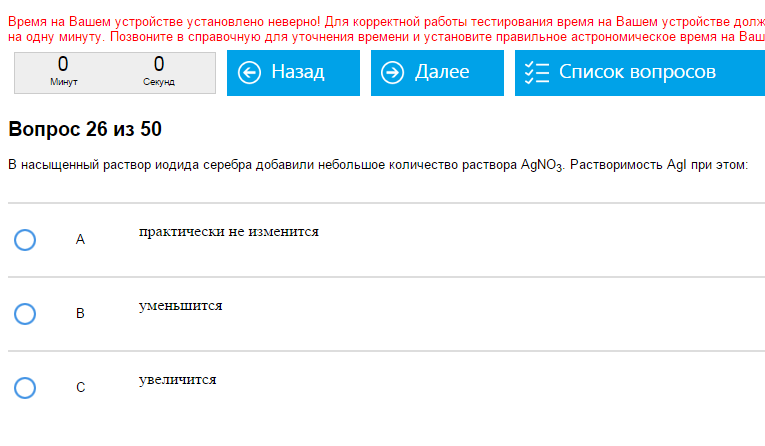  . Как с этим бороться: Если добавляют электролит, содержащий такой же ион, какой есть в малорастворимом веществе, растворимость уменьшается (как в примерах – к насыщенному раствору AgI добавили AgNO3 и т.п.). Если ионы разные – растворимость практически не изменяется.
Пример: ? нет. Как с этим бороться: Пока непонятно. Тема 10. Потенциал, ЭДС. Введение. Тоже мрачная, путанная тема, порождение сумрачного немецкого гения Нернста. Наиболее нелюбима мной в институтские годы, даже более, чем кинетика Типичные вопросы:
Пример: 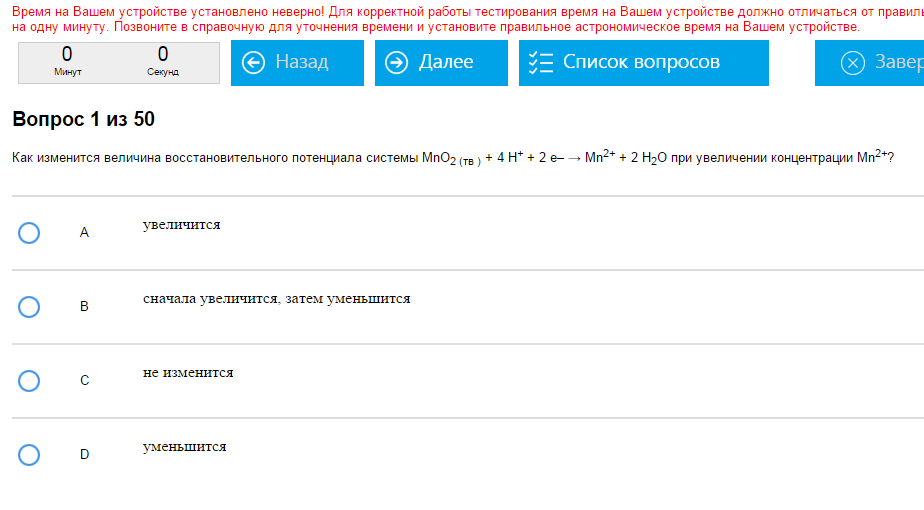 За что нам это? Как с этим бороться: Итак. Окислительный потенциал увеличивается при:
Окислительный потенциал уменьшится при:
Восстановительный потенциал увеличится при:
Восстановительный потенциал уменьшится при:
Бдительные товарищи наверняка заметят, что эти списки сделаны методом ctrl + c, ctrl + v. Не перепутайте уменьшение с увеличением, тут, как всегда, это легко сделать.
Пример: 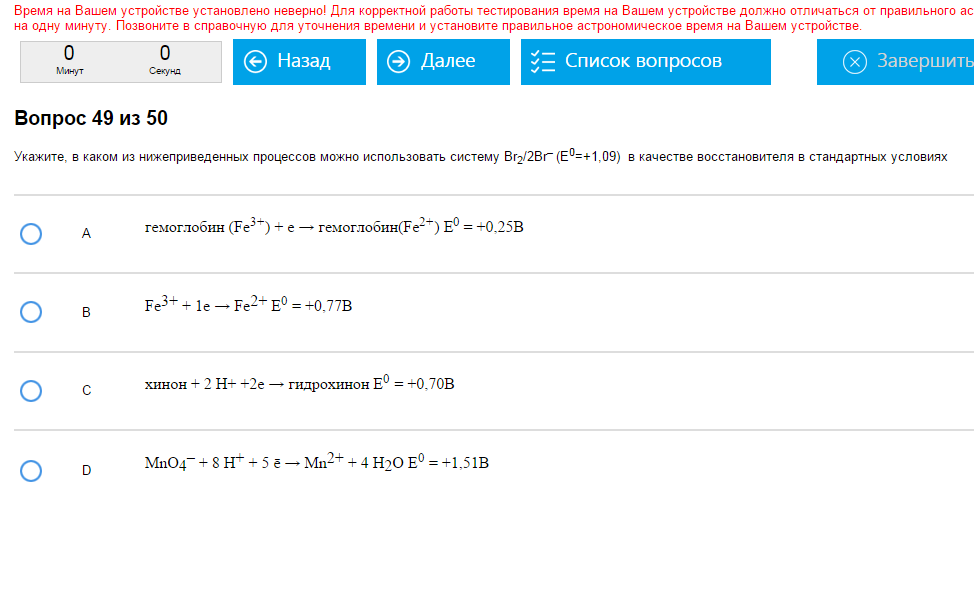 Правильное D. Как с этим бороться: Из двух систем воостановитель та, у которой потенциал меньше, а окислитель, соотетственно та, у которой потенциал больше. При решении таких задач на реакции и системы лучше даже не смотреть, а смотреть только на ϕ (или Е0). Сравниваем данную изначально систем с каждым вариантом и находим то, о чем спрашивали. В примере просят определить, в отношении какой системы данная может быть восстановителем. Сравниваем данную (Е0=1,09) с А (Е0=0,25) и понимаем, что в такой паре данная система восстановитель (это не подходит) а система А – восстановитель. Это не подходит. Повторяем эту операцию, пока не получим, что нужно.
Пример: ? нет. Как с этим бороться: Пока неизвестно. Тема 11. Ультрамикрогетерогенные системы. Мицеллы. Введение. Тут главное – научится строить мицеллы, потому что 1 из 50 вопросов точно будет про них. Кароч. Мицелла образуется в результате обменной реакции, в которой выпадает осадок, таблица растворимости в помощь. Например, AgNO3+NaCl=NaNO3+AgCl. При этом один из двух исходных электролитов должен быть взят в избытке, а то мицелла не получится. У нас будет NaCl. Дальше все просто, берем заготовку мицеллы, вот такую: { [ ( m… ) n… (n-x) … ] … } И заполняем ее содержимым. После m пишется всегда осадок, он по мицелльному называется агрегат, в нашем примере AgCl. Дальше внимание, самый сложный момент! – идет ион, одинаковый в осадке и в избытке. У нас это будет Cl, по мицелльски это называется потенциалопределяющий ион. Дальше – ион, который тоже в избытке, но не потенциалопределяющий, и дальше еще раз он же, в моем примере это Na, называется противоион. Итого: { [ ( mAgCl ) nCl- (n-x) Na+ ] Na+ } Потенциалопределяющий ион определяет заряд мицеллы, если он +, то и мицелла считается +, а хули вы хотели, потенциалопределяющий же. Если мицелла «+» то идет к катоду, «-» к аноду. Агрегат + потенциалопределяющий ион = ядро, все, что в квадратных скобках = гранула. Все полностью = мицелла. Потенциалопределяющий+первый противоион = плотный адсорбционный слой, второй противоион=диффузный слой. Так решаются задачи, когда известно, что в избытке, а определить надо потенциалопределяющий и противо-ион. Иногда бывают обратные задачи, когда известен противоион, или потенциалопределяющий, а построить надо мицеллу. Рассуждение обратное, что в противоионах, то и в избытке было. Типичные вопросы:
Пример: 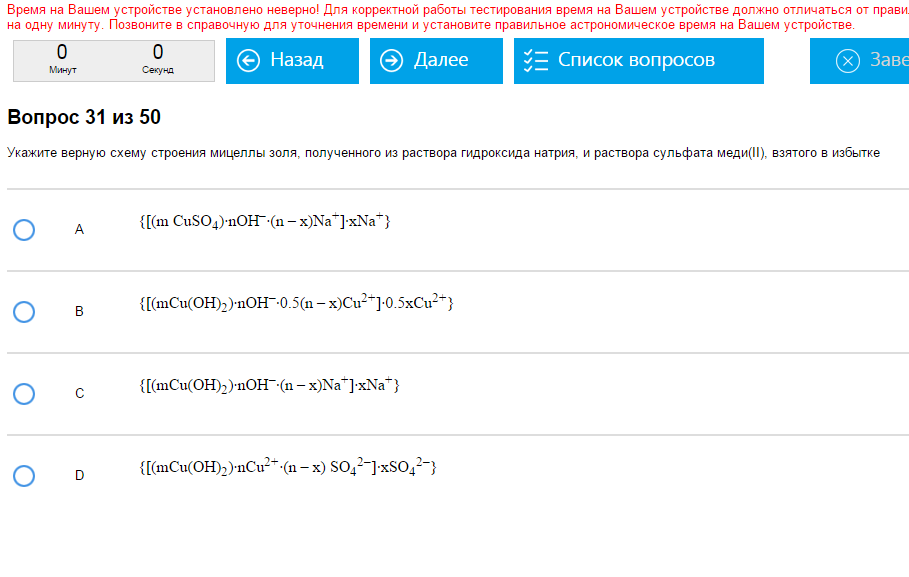 Красота. Как с этим бороться: Прочитать и понять введение к этому разделу, запомнить и научиться строить мицеллы быстро и находить в них составные части: агрегат-ядро-гранулу и т.д.
Пример: 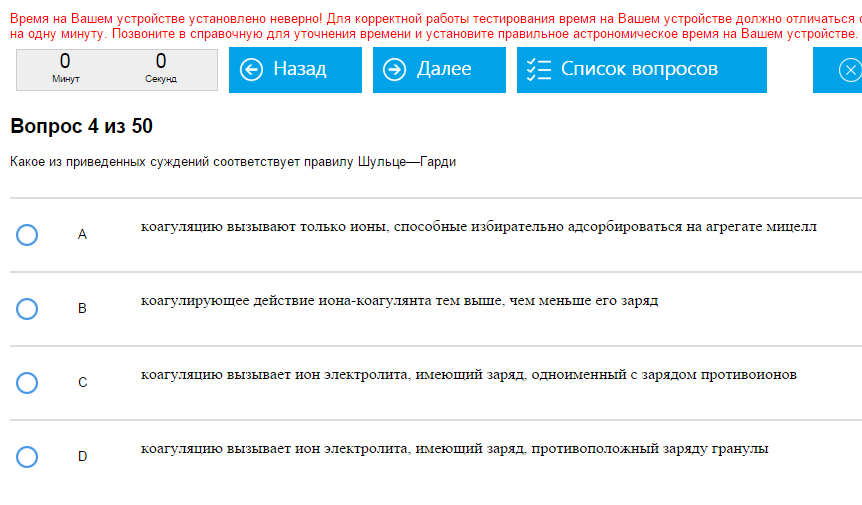 Как то так. Как с этим бороться: Само правило утверждает, что:
По первой части все ясно, на тему второй части попадаются порой знатные финты ушами. Например, В похоже на нее, но только наоборот. Или было про соотнесение коагулирующих способностей ионов с зарядами 1 и 3, соотношение получается 16:36=1:729. Всего не угадаешь, включайте голову.
Пример: 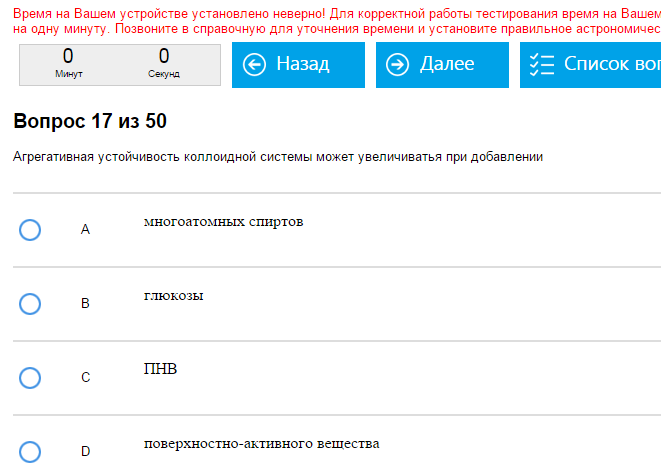 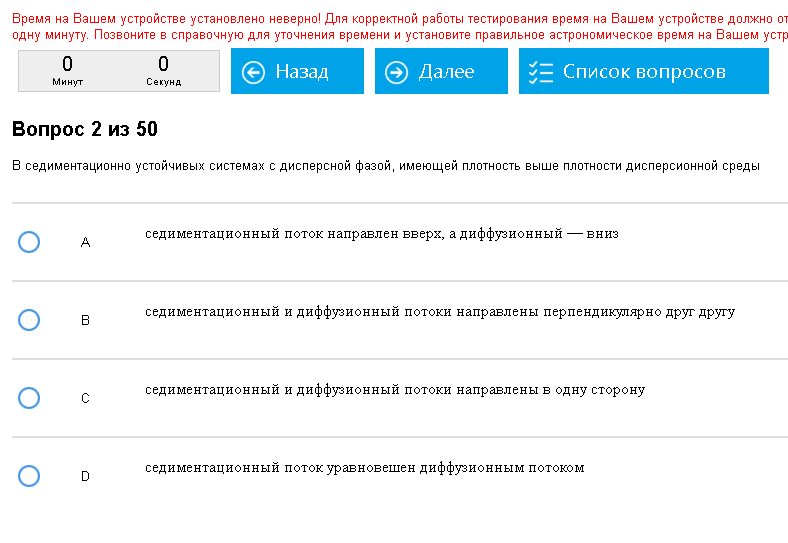 Жесть. Как с этим бороться: Общих методов тут нет, к сожалению, надо читать умную книжку и по данным там определениям ориентироваться. По примерам: агрегативная устойчивость повышается при добавлении ПАВ, этот вид устойчивости – устойчивость против объединения частиц. Седиментационная устойчивость – устойчивость к оседанию частиц, при этом седиментационный и диффузионный потоки уравновешены.
Пример: 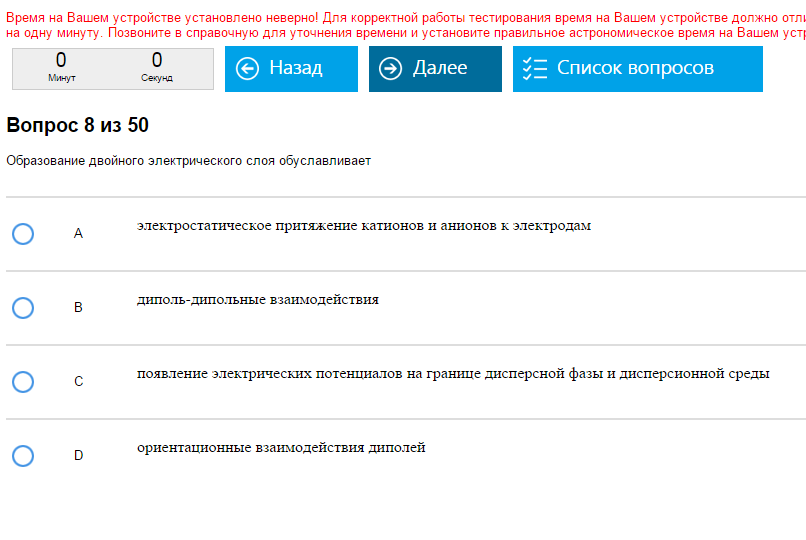   Болтовня. Как с этим бороться: Никак, только прочитав кучу умного текста и осмыслив его. В вопросах нет последовательности, их нельзя решать как одинаковые типовые задачи. Беда-беда. Первый пример – С, ну просто вот так есть и все, второй – тоже С, третий - А. Такова природа, вопросы почему в рамках этого пособия неуместны, хотя я мог бы и ответить. 2 модуль, Органика Тема 1. Номенклатура. Введение. Обязательно нужно иметь в голове/под рукой обе таблицы по органике из голубой методички, а так же дополнить их недостающими веществами: сложными эфирами, сложными тиоэфирами, амидами, иминами, полуацеталями, ацеталями, альдолями. Типичные вопросы:
Пример:  Блин… что же такое альдимин и кетоимин?!? Спойлер - это А и D соответственно. 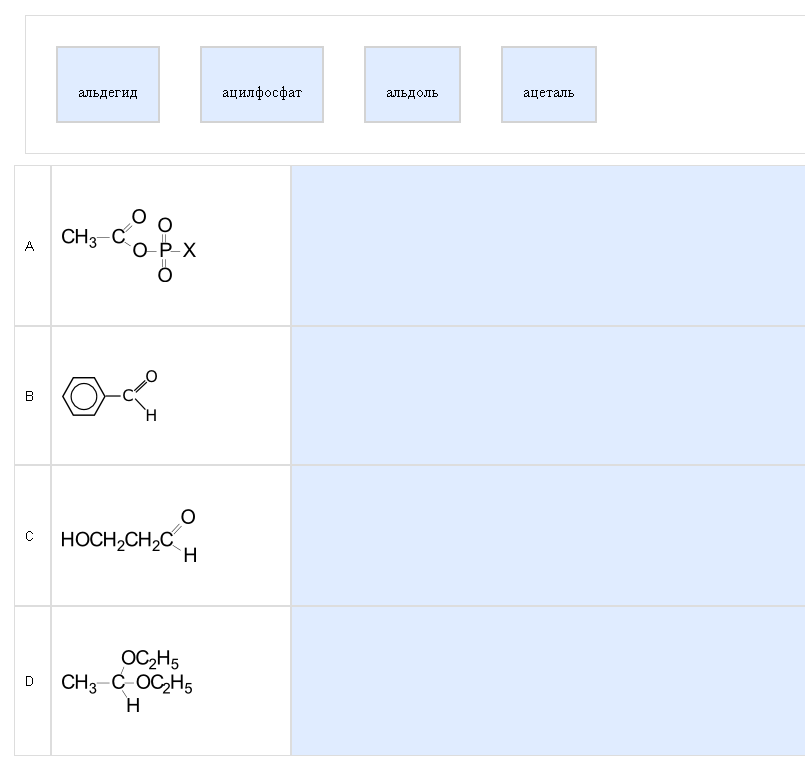 Довольно сложная разновидность вопросов такого типа. Как с этим бороться: элементарно, берем методичку и определяем по таблице, к какому классу какое вещество относится, есть гидроксильная группа – спирт, карбоксильная- кислота и т. д. Если в названии суффикс «ен» – то это алкен, «ол» – спирт и т. д. Суффикс «ат» характерен для сложных эфиров, оцените формиат, ацетат, пропионат. Важно извлечь связку: название класса-общая формула-приставка/суффикс в названии. Сложные случаи: двухатомный спирт НО-СН2-СН2-ОН, дикарбоновая кислота НООС-СООН, ангидрид
Пример:  Fail… вариант А – ответ вопросом на вопрос? А вы не верили в еврейский заговор 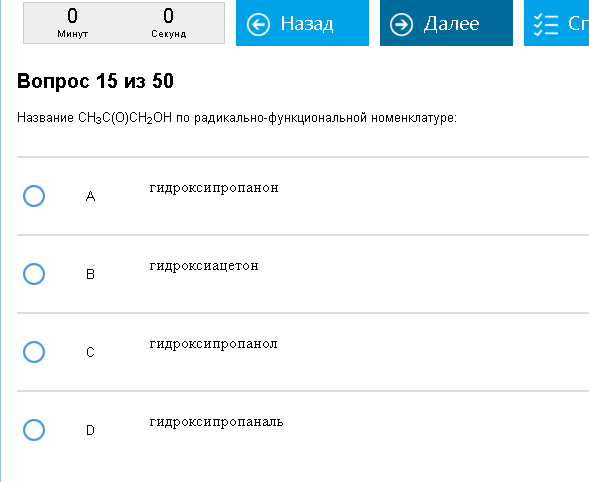 Ай. Ответ – гидроксиацетон, это патология не соответствующая алгоритму. Надеюсь, подобного больше нет  fail. Что же в итоге надо назвать? А еще эти люди запрещают нам ошибаться. Ответ – D. Вещество, которое дано в варианте А, называется дивинилкетон. Как с этим бороться: Для начала неплохо бы иметь под рукой/в голове таблицу радикалов и научиться отличать классы веществ друг от друга: спирты, амины, карбоновые кислоты, кетоны и проч. Освоив сию грамоту (вы же не халтурили в п. 1?), название по радикальной номенклатуре дается легко: называем радикалы, из которых состоит формула и добавляем название класса. С2Н5-ОН = этиловый спирт, СН3-О-СН3 = диметиловый эфир, N(СН3)3 = триметиламин, СН3-СН(-ОН)-СН2-СН3 = вторбутиловый спирт (извините, формула трудно читается, нету у меня сейчас хорошего редактора, чтобы красивую формулу нарисовать. Кафедра ОБОХимии, впрочем, тоже не особо заморачивается редактором химических формул, так что привыкайте). Еще нам попадался прикол про орто-, мета- и пара-изомеры бензола. Орто = заместители расположены на соседних углах, мета=через один угол, пара=через два угла, напротив друг друга. И еще прикол – карбоновые кислоты и альдегиды по непонятной причине в радикально-функциональной номенклатуре надо называть традиционными названиями: муравьиный альдегид, ацетальдегид, пропионовый альдеид – ряд альдегидов, муравьиная, уксусная, пропионовая, масляная – ряд кислот. Дополнительный бонус – нам может быть дана не формула, а название по заместительной номенклатуре, по которому нужно сначала понять, что это за
Пример:  Пропаналь такой пропаналь. Как с этим бороться: Заместительная номенклатура отлично описана в голубых методичках, но еще раз, для тех кто не осилил. Находим самую длинную из возможных углеродных цепей, находим функциональные (характеристические) группы, из них выбираем старшую (она обычно и единственная, если нет – смотрим правило старшинства групп), нумеруем цепь от старшей группы, строим название по схеме: приставки = радикалы и младшие группы с номерами, где они находятся, корень = длина главной цепи (метан, этан, пропан и т. д., вы ведь сдавали ЕГЭ и знакомы с этой херней, мои дорогие любители химии?), суффиксы «ан», «ен» и «ин» соответственно означают одинарные, двойные или тройные связи в главной цепи, суффикс = название старшей группы. Все эту
Пример:  Какую же группу содержит альдегид? Как с этим бороться: Блин, да это даже несерьезно обсуждать, я вас умоляю. Берете голубую методичку, вторая таблица, и вам откроется дивный мир органической химии, вы узнаете, что альдегиды содержат карбонильную группу, карбоновые кислоты – карбоксильную, простые эфиры – алкоксильную и т.д., и т.п. Главное, не забудьте – вы еще до сих пор умеете отличать классы органических веществ, на этой
Пример:  Вот и пропионовая кислота нарисовалась… Как с этим бороться: Довольно занудный вопрос. Насколько я могу судить, на кафедре ОБОХимии до сих пор нет внятного представления о том, что такое родоначальная структура, поэтому стоит иметь в виду следующее: родоначальная структура – это гомологический ряд карбоновых кислот, муравьиная, уксусная, пропионовая и прочее, что может быть найдено в табл. №1 голубой методички. То есть если вы видите что то типа H2N-CH2-COOH, и осознаете, что 1) это аминокарбоновая кислота 2) количество атомов «С» в ней совпадает с уксусной кислотой; то вы можете констатировать, что родоначальная структура для этой
Пример:  Нитро- и гидроксильная группы затаились в молекуле Как с этим бороться: Элементарно. Вы же не забыли, какие бывают группы, ну же? Смотрим на формулу и мысленно вычленяем из нее, как правило, две функциональные группы.
Пример: забыл заскринить, извините. Как с этим бороться: Довольно стремный вопрос. Мне попались фенол и амид, вероятно, есть еще варианты. Надо обладать какой никакой, а все таки логикой, чтобы догадаться, что N,N-диметилацетАМИД относится к классу амидов, и какими никакими, а знаниями+логикой, чтобы указать, что фенол содержит гидроксильную группу, связанную с ароматическим кольцом |
