Неорганическая химия, ответы. 1. Строение атома. Атом
 Скачать 436.56 Kb. Скачать 436.56 Kb.
|
|
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса:ΔG < 0 Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH. Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в заданном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции. Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG. По значению стандартной энергии Гиббса реакции можно рассчитать значение константы равновесия K и сделать вывод о положении равновесия. Для рассчета энергии Гиббса реакции необходимо использовать выражение:
где R - универсальная газовая постоянная: 8.31441 Дж/(моль·K). Для обратимых реакций можно найти такое значение температуры, при которой K = 1 и ΔG° = 0. При этой температуре (она обозначается так: T↔) протекание прямой и обратной реакции равновероятно; эта температура называется температурой равновесия протекания реакции. Между энергией Гиббса реакции и константой равновесия существует соответствие:
Таким образом, преобладающее направление протекания обратимой реакции определяется знаком энергии Гиббса; практически важное прямое направление реакции, т.е. сдвиг равновесия в сторону образования продуктов преобладает при условии ΔGT<< 0 K >> 1. Для кислотно-основных реакций, протекающих в водном растворе, величина ΔG°T определяется выражением:
где pKkI= -lgKkI и pKkII= -lgKkII; KkI - константа кислотности реагента - кислоты (справочное значение), KkII - константа кислотности реагента - основания (справочное значение). Для окислительно-восстановительных реакций, протекающих в водном растворе, величины ΔG°T рассчитывают по соотношению:
где ze - число электронов, переданное от восстановителя к окислителю в реакции; E°Ox - стандартный потенциал окислителя (справочная величина); E°Red - стандартный потенциал восстановителя (справочная величина); F - постоянная Фарадея (96485 Кл). 65. Растворы электролитов. Основные положения ТЭД Аррениуса Растворы ЭЛЕКТРОЛИТОВ Растворы электролитов имеют: Более высокое осмотическое давление Более высокую Т кипения Более низкую Т замерзания Способность проводить электрический ток С. Аррениус, В. Оствальд (1887 г.): Электролитическая диссоциация – распад электролитов на ионы при растворении в воде или плавлении. Электролиты в растворе или в расплаве частично или полностью распадаются на ионы и проводят электрический ток за счет движения ионов. С. Кислота: HnA → nH+ + An- Основание: М(ОH)n → Мn+ + nОH- Процесс диссоциации сильных электролитов идет нацело и до конца. В растворах слабых электролитов диссоциация происходит частично, этот процесс количественно характеризуется константой диссоциации. Предпосылки создания теории Для электролитов повышение температуры кипения, понижение температуры замерзания, относительное понижение давления насыщенного пара, осмотическое давление значительно больше расчетных величин. 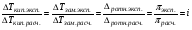 , ,где i – эмпирический коэффициент (i>1), введенный Вант-Гоффом. Основные положения теории Аррениуса 1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы. 2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз. 3 Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной 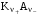 ↔ ν+ Kz+ + ν – Az- ↔ ν+ Kz+ + ν – Az-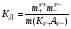 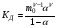 В частном случае при ν+=ν–=1 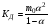 (*) (*)Здесь ν=ν++ν– - общее число ионов, образующихся при диссоциации одной молекулы, m+, m– - моляльности ионов, m(Kν+Aν–) – моляльность недиссоциированных молекул, m0 – моляльность раствора при расчете на полностью недиссоциированное вещество, α – степень диссоциации – доля диссоциированных молекул, КД – практическая константа диссоциации. 4 Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации. i – среднее суммарное число частиц (ионов и молекул), образующихся при диссоциации одной молекулы i = ν + α + ν- α + (1-α) = 1 + (ν++ν–-1)α = 1 + (ν – 1)α i = 1+(ν-1)α По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества): NaCl = Na+ + Cl- i→2 K2SO4 = 2K+ + SO 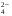 i→3 i→3AlCl3 = Al3+ + 3Cl- i→4 K4[Fe(CN)6] = 4K+ + [Fe(CN)6]2- i→5 67. Какая электронная конфигурация (валентные электроны) характерна для изолированного атома хрома. Хром расположен в 6 группе Периодической системы химических элементов Д.И. Менделеева. Хром – d-элемент. Валентные электроны атома хрома имеют электронную конфигурацию 3d44s2,однако вследствие устойчивости d5-состояния энергетическим более выгодным оказывается переход одного s-электрона на 3d-подуровень, поэтому валентные электроны хрома имеют следующую конфигурацию: 3d54s1. В соединениях хром проявляет степени окисления +2, +3, +4, +5, +6. Характерная степень окисления +3, в меньшей мере +6. Соединения хрома (II) проявляют преимущественно основные свойства, хрома (III) – амфотерные, соединения хрома (VI) – кислотные. 69. Высокоспиновые и низкоспиновые координационные соединения. Иное положение складывается, когда на d-орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Гунда требует затраты энергии для перевода некоторых электронов на dγ-орбитали. С другой стороны, при размещении максимального числа электронов на dε-орбиталях нарушается правило Гунда, и, следовательно, необходима затрата энергии для перевода некоторых электронов на орбитали, на которых уже имеется по одному электрону. Поэтому в случае слабого поля, т. е. небольшой величины энергии расщепления, энергетически более выгодным оказывается равномерное распределение d-электронов по всем d-орбиталям (в соответствии с правилом Гунда); при этом центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на dε-орбиталях; при этом создается низкоспиновый диамагнитный комплекс. Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации, например, sp3d2. Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталей предвнешнего d-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, d2sp3 или dsp2) 71. Номенклатура оксидов. Пероксиды. В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII). Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3. Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д. Пероксиды (перекиси) — сложные вещества, в которых атомы кислорода соединены друг с другом. Пероксиды — вещества, содержащие пероксогруппу —О—О— (например, пероксид водорода Н2О2, пероксид натрия Na2O2). В пероксидах кислород имеет степень окисления −1. Существуют неорганические и органические пероксиды. Неорганические пероксиды в виде бинарных или комплексных соединений известны почти для всех элементов. Пероксиды щелочных и щелочноземельных металлов реагируют с водой, образуя соответствующий гидроксид и пероксид водорода. Органические пероксиды подразделяются на диалкилпероксиды, алкилгидропероксиды, диацилпероксиды, ацилгидропероксиды (пероксокарбоновые кислоты), циклические пероксиды. Органические пероксиды термически неустойчивы и часто взрывоопасны. Используются как источники свободных радикалов в органическом синтезе и промышленности (ди-трет-бутилпероксид, диацетилпероксид), окисляющие антисептики (пероксид бензоила). 72. Характеристики атомов. Атомы различных химических элементов отличаются по их массе, и атомная масса в какой-то мере определяет периодичность повто рения химических свойств различных атомов, однако массовое число A не является однозначной характеристикой атомов любых веществ. Действительной характеристикой, определяющей физико-химическую индивидуальность атома вещества, является его атомный номер (z) в от крытой Д. И. Менделеевым Периодической Системе элементов. Называя атомный номер элемента z, мы фактически называем сам этот элемент, об атомах которого идёт речь. Например, если z = 6, нам ясно, что речь идет об углероде (С), а если z = 92, это равносильно тому, что элемент назван ураном (U), и т.д. Итак, массовое число A и атомный номер z элемента - пара характе ристик, полностью определяющих физико-химическую индивидуальность ато мов любого вещества. Атомная теория раскрывает физический смысл этих характеристик в следующих основных положениях: а) Все атомы состоят из положительно заряженного ядра и обращаю щихся вокруг него отрицательно заряженных частиц - электронов. б) Электрический заряд электрона qe = - 1.6022 .10-19 Кл - наимень ший электрический заряд, обнаруженный экспериментально, и это дало по вод назвать его элементарным зарядом, а заряды других частиц и струк тур на микроуровне - измерять в элементарных зарядах. в) Атомный номер элемента z - есть не что иное, как суммарное ко личество электронов в атоме. г) Поскольку устойчивый атом любого химического элемента электро нейтрален, отрицательный заряд электронных оболочек в атоме нейтрали зуется равным по величине положительным зарядом ядра. Поэтому другое представление об атомном номере состоит в том, что атомный номер хими ческого элемента - это положительный заряд ядра его атома, выражен ный в величинах элементарных электрических зарядов (то есть в зарядах электрона). д) Масса покоя одиночного электрона mе = 9.1095.10-28 г, что соот ветствует приблизительно 5.486.10-4 а.е.м. Разница в порядках величин масс всего атома (от единицы до сотен а.е.м.) и электронов в нём (от 5.486.10-4 до величин порядка 10-2 а.е.м.), которая, как видно из при веденных цифр, составляет четыре порядка, приводит к выводу о том, что практически вся масса атома сосредоточена в его ядре. е) Размеры атомов, найденные в экспериментах, выполненных по раз личным методикам, имеют порядок 10-8 см, тогда как размеры их ядер - величины порядка 10-13 см. Эти цифры говорят о том, что ядро занимает ничтожную часть объёма атома. Если под объёмом ядра понимать сферу, в пределах которой эффек тивно действуют ядерные силы, радиус этой сферы можно оценить по полу эмпирической формуле: Rя ≈ 1.21.10-13 А1/3, см,. (1.4) где А, а.е.м. - атомная масса элемента. |
