Неорганическая химия, ответы. 1. Строение атома. Атом
 Скачать 436.56 Kb. Скачать 436.56 Kb.
|
|
53. Гибридизация атомных орбиталей. Правила: Суммарное число гибридных орбиталей равно суммарному числу исходных АО. Гибридные орбитали асимметричны и образуют только σ-связи! Понятие гибридизации было введено для объяснения равноценности всех образующихся ХС. Условия образования гибридных орбиталей: • близость исходных АО по энергии •гибридная орбиталь должна наиболее полно перекрываться с орбиталями другого атома •в пространстве гибридные орбитали максимально удаленно друг от друга
54, 83. Как зависит протекание ОВР от рН среды? Примеры. Будет ли данное соединение окислителем или вoсстaнoвитeлeм, нередко зависит от среды В зависимости от среды может измениться характер протекания процесса между одними и теми же веществами. Известно, например, что перманганат–ион является сильным окислителем, но его окислительные свойства зависят от pH среды. Наибольшую окислительную активность перманганат- ион (MnO4– ) проявляет в кислой среде, восстанавливаясь до Mn2+. Меньшую – в нейтральной или слабощелочной средах, восстанавливаясь до Mn+4 (MnO2). Наименьшую – в сильнощелочной, восстанавливаясь до Mn+6 (MnO42–). 56. Какие элементы ЩЗМ? Почему? Щёлочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: кальций, стронций, барий Ве, Мg, Ca, Sr, Ba, Ra. Они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию. 57. Укажите какие из приведенных соединений являются оксидами: Li2O, Na2O2, OF2, Cl2O7, Cr2O3. 58. ИП воды. Изотопный состав воды — процент содержание молекул с различной изотопной массой (изотопологов) в воде. Содержание воды, состоящей из лёгких стабильных изотопов 1H216O («лёгкой воды», в отличие от содержащей повышенное количество тяжелого изотопа водорода 2H «тяжёлой воды») в природной воде составляет 99.73 — 99.76 мол.%. Изотопологи — молекулы, различающиеся только по изотопному составу атомов, из которых они состоят. Изотополог имеет в своём составе, по крайней мере, один атом определенного химического элемента, отличающийся по количеству нейтронов от остальных. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Водород имеет два стабильных изотопа — протий (Н) — 1H и дейтерий (D) — 2H. У кислорода три устойчивых изотопа: 16O, 17O и 18O (табл.1).
60.Следствие из закона объемных отношений. Стехиометрические коэффициенты в уравнении химических реакций для молекул газообразных веществ показывают в каких объемных отношениях реагируют или получаются газообразные вещества. 61.Взаимодействие простых и сложных веществ с кислородом. Реакции. 4. Взаимодействие кислорода с простыми веществами Кислород - окислитель. Он взаимодействует почти со всеми простыми веществами, кроме инертных газов, галогенов и таких неактивных металлов, как золото и платина. При взаимодействии образуются, как правило, высшие оксиды соответствующих элементов. Но есть и исключения. S + O2 = SO2 (не высший оксид!) N2 + O2 4P + 5O2 = 2P2O5 и 4P + 3O2 = P2O3 (в зависимости от избытка/недостатка кислорода) С + О2 = СО2 и 2С + О2 = 2СО (в зависимости от избытка/недостатка кислорода) 2Mg + O2 = 2MgO 3Fe + 2O2 = Fe3O4 или 4Fe + 3O2 = 2Fe2O3 (при высоких температурах) Реакции со щелочными металлами имеют особенности. Наиболее активные металлы (металлы главной подгруппы 1-й группы) реагируют более энергично (часто без нагревания) и образуют более насыщенные кислородом соединения – пероксиды и надпероксиды: 2Na + O2 = Na2O2 пероксид натрия 2Rb + 2O2 = Rb2O4 надпероксид рубидия Литий образует оксид, натрий - пероксид, калий, рубидий и цезий - надпероксиды. Это объясняется увеличением радиуса атома от лития к цезию. 5. Взаимодействие кислорода со сложными веществами Кислород окисляет многие сложные вещества. При этом окисление происходит, как правило, до тех же продуктов, которые образуются при окислении простых веществ соответствующих элементов: CS2 + 3O2 = CO2 + 2SO2 C7H16 + 11O2 = 7CO2 + 8H2О С2Н5ОН + 3О2 = 2СО2 + 3Н2О 4FeS2 + 11O2 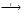 2Fe2O3 + 8SO2 2Fe2O3 + 8SO2Азотсодержащие вещества обычно сгорают с образованием молекулярного азота: 4NH3 + 3O2 = 2N2 + 6H2O Однако с помощью катализаторов это можно изменить: 4NH3 + 5O2 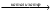 4NO + 6H2O 4NO + 6H2O2SO2 + O2 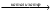 2SO3 2SO362. d-Металлы. Закономерности изменения максимальной степени окисления в периодах и группах. К d-элементам относят те элементы, атомы которых содержат валентные электроны на (n – 1)d ns-уровнях и составляют побочные (IIIВ–VIIВ, IВ, IIВ) подгруппы, занимая промежуточное положение между типичными s-металлами (IА, IIА) и p-элементами. Из 109 элементов периодической системы 37 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период. Электронное строение атомов d-элементов определяет их химические свойства. 3d-Элементы по химическим свойствам существенно отличаются от 4d- и 5d-элементов. При этом элементы IVВ–VIIВ подгрупп очень схожи по многим химическим свойствам. Это сходство обусловлено лантаноидным сжатием , которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения. Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами. Поскольку часть валентных электронов находится на s-орбиталях, то проявляемые ими низшие степени окисления как правило равны двум. Исключение составляют элементы, ионы которых Э +3 и Э + имеют устойчивые конфигурации d 0, d 5 и d 10: Sc 3+, Fe 3+, Cr +, Cu +, Ag +, Au +. Соединения, в которых d-элементы находятся в низшей степени окисления, образуют кристаллы ионного типа, в химических реакциях проявляют основные свойства и являются, как правило, восстановителями. Устойчивость соединений, в которых d-элементы находятся в высшей степени окисления (равной номеру группы),увеличивается в пределах каждого переходного ряда слева направо, достигая максимума для 3d-элементов у Mn, а во втором и третьем переходных рядах – у Ru и Os соответственно. В пределах одной подгруппы стабильность соединений высшей степени окисления уменьшается в ряду 5d > 4d > 3d 63. Кратность хим. связи. число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентнойхимическойсвязи. Так, в молекуле этана Н 3 С-СН 3 связь С-С одинарная, К. с. равна единице (одна общаяпара электронов); в молекуле этилена Н 2 С = СН 2 связь С = С двойная, К. с. равна двум (две - парыобобществлённых электронов); в молекуле ацетилена НС К. с. не всегда выражается целым числом. Так, в молекуле бензола С 6 Н 6 все связи углерод=углерододинаковы и длины их равны 0,140 нм. Считается, что К. с. С-С в молекуле бензола равна 1,5. В металлоор-ганич. и комплексных соединениях К. с. выражается дробным числом, а иногда и вовсе не поддаётсяоднозначному определению 64. Энтропия. Направление реакций. Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики). Энтропия связана с термодинамической вероятностью соотношением:
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло). Здесь ΔS° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1. Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии. В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тенденцией к беспорядочному расположению. Эти два фактора обусловливают химическую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH и ΔS. |
