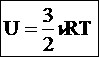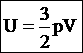Неорганическая химия, ответы. 1. Строение атома. Атом
 Скачать 436.56 Kb. Скачать 436.56 Kb.
|
                    1. Строение атома. Атом (от греческого atomos - неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойства вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома определяется массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A-Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом. Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объемом атома, то ядро условно принимается материальной точкой покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов. 1. Строение атома. Атом (от греческого atomos - неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойства вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома определяется массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A-Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом. Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объемом атома, то ядро условно принимается материальной точкой покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов. Квантовые числа Состояние электрона в атоме характеризуется набором квантовых чисел. 1. Главное квантовое число (n) – характеризует главный уровень энергии, определяет размер орбитали. n принимает значения целых чисел от 1 до ∞. Слои: 1-K, 2-L, 3 – M, 4 – N, 5-O, 6-P С ростом n повышается энергия электрона (при n= ∞ , Е→ 0). Чем меньше значение n, тем меньше энергия электрона, тем в более связанном состоянии он находится. Электроны атома, имеющие одно и то же значение n, относятся к общей электронной оболочке или энергетическому уровню. Максимальное количество электронов на оболочке равно 2n2 2. Орбитальное (побочное) квантовое число (l) – характеризует подуровень энергии, определяет форму орбитали. Орбиталь – совокупность положений электрона в атоме с одинаковом значением l. l принимает значения целых чисел от 0 до (n-1).
Каждой комбинации главного и орбитального квантовых чисел отвечает некоторая электронная подоболочка или энергетический подуровень. Максимальное количество электронов на подоболочке равно 2(2l+1). 3. Магнитное квантовое число (m) – определяет положение орбитали в пространстве по отношению к др. орбиталям m принимает значения целых чисел от -l до +l. S-орбиталь : l=0 m=0 р-орбиталь : l=1 m=-1; 0; +1 d-орбиталь : l=2 m=-2;-1; 0; +1;+2 f-орбиталь : l=3 m=-3;-2;-1; 0; +1;+2;+3 Каждая волновая функция однозначно определяется набором из трех квантовых чисел: n, l, m. Однако для полного описания поведения электрона необходимо использовать четвертое – спиновое квантовое число s. 4. Спиновое квантовое число (s) – характеризует собственный магнитный момент электрона s принимает 2 значения + ½ (↑) и - ½ (↓). 2. Солеобразующие оксиды. Солеобразу́ющие окси́ды (ангидри́ды) — оксиды неметаллов и металлов, при взаимодействии с водой образующие соответствующие кислоты, при взаимодействии с основаниями — соответствующие нормальные и кислые соли. Солеобразующие оксиды, в свою очередь, делятся на: осно́вные оксиды, элемент которых при образовании соли становится катионом; например, Na2O, CuO, K2O, СаО; кислотные оксиды, элемент которого при образовании соли входит в состав кислородсодержащего аниона; например, SO3, NO2; амфотерные оксиды, которые могут реагировать и как кислотные, и как основные оксиды; например, ZnO, Al2О3. 3. ЭО. Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у активных металлов (s-элементов I группы). 4. Изменение максимальной степени окисления атома в периодах ПС Менделеева. Степени окисления закономерно изменяются при переходе от одного элемента к другому в периодической системе. Высшая степень окисления элементов в группе обычно равна номеру группы таким образом, в периодах высшая степень окисления растет. П главных подгруппах при переходе от элементов сверху вниз обычно становятся более устойчивыми низкие степеннокисления,в побочных подгруппах — наоборот, более высокие. 5. Способы перекрывания электронных облаков. Ковалентная связь образуется за счет перекрывания электронных облаков связываемых атомов. Существуют разные способы перекрывания этих электронных облаков. 1. Прямое перекрывание: 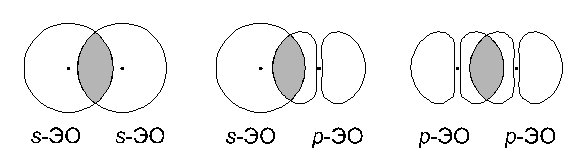 В этом случае единственная область перекрывания электронных облаков лежит на прямой, соединяющей ядра атомов. Связь, образованная таким образом, называется В зависимости от вида перекрывающихся облаков может образоваться
2. Боковое перекрывание: 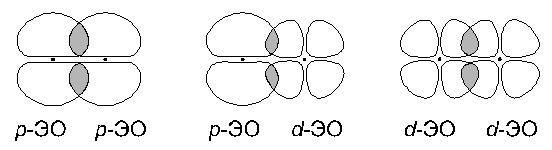 В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Связь, образованная при таком перекрывании ЭО, называется Как и в случае
И 6. Закон сохранения энергии. Первое начало термодинамики. (1905, А. Эйнштейн) При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
|