Неорганическая химия, ответы. 1. Строение атома. Атом
 Скачать 436.56 Kb. Скачать 436.56 Kb.
|
|
23. ПС Менделеева. Диагональное сходство. Примеры. Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Диагональное сходство — сходство между собой элементов, находящихся в Периодической системе элементов по диагонали друг от друга, а также соответствующих им простых веществ и соединений. Наиболее ярко выражено в парах литий-магний, бериллий-алюминий, бор-кремний. Элементы в указанных парах (особенно последних двух) схожи между собой гораздо сильнее, чем с соседними элементами в тех же группах. Сходство объясняют близкими отношениями заряд/радиус иона. 24.Метод валентных связей. Основатели МВС – Гейтлер и Лондон (1927 г.). Разработали квантово-механический метод приближённого расчёта длины и энергии ХС. В.Г. Гейтлер (1904-1981) Ф. Лондон (1900-1954) Они выразили зависимость волновой функции ψ от расстояния между атомами водорода, нашли плотность электронного облака │ψ│2, а по ней рассчитали потенциальную энергию E для двух атомов водорода. Квантово-механические расчеты показали, что понижение потенциальной энергии в молекуле водорода происходит только в случае противоположных спинов электронов. Таким образом, ХС возникает только при перекрывании электронных облаков с антипараллельными спинами. Основные положения МВС: •ХС обеспечивается двумя электронами, движущимися в ограниченном участке электростатического поля двух ядер – концепция двухэлектронной локализованной связи. •Общая пара электронов образуется по спин-обменному или донорно-акцепторному механизму. •ХС образуется только при взаимодействии электронов с противоположными спинами. •Образующаяся электронная пара одновременно принадлежит двум атомам. •Прочность связи прямо пропорциональна площади перекрывания электронных облаков взаимодействующих атомов, а также зависит от эффективных зарядов и радиусов атомов. •Кратность ХС определяется суммарным числом общих электронных пар, одновременно принадлежащим 2 атомам, образующих данную ХС. 25.Повышение температуры кипения раствора. Второй закон Рауля. Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Понижение температуры кристаллизации растворов Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около −2 °C. Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации. Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора. {\displaystyle T_{fr}^{o}-T_{fr}=\Delta T_{fr}=Km}Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур. Повышение температуры кипения растворов Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b. Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора 26,66. Внутримолекулярные ОВР. Примеры. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
27. Для каких 3d-элементов характерны «необычные» электронные конфигурации изолированного атома? Ответ обосновать. Первым элементом с таким нарушением является хром. Рассмотрим подробнее его электронное строение (рис. 6.16 а). У атома хрома на 4s-подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3d-подуровне пять электронов, а ведь этот подуровень заполняется после 4s-подуровня (см. рис. 6.4). Чтобы понять, почему так происходит, посмотрим, что собой представляют электронные облака 3d-подуровня этого атома. Каждое из пяти 3d-облаков в этом случае образовано одним электроном. Как вы уже знаете из § 4 этой главы, общее электронное облако таких пяти электронов имеет шарообразную форму, или, как говорят, сферически симметрично. По характеру распределения электронной плотности по разным направлениям оно похоже на 1s-ЭО. Энергия подуровня, электроны которого образуют такое облако, оказывается меньше, чем в случае менее симметричного облака. В данном случае энергия орбиталей 3d-подуровня равна энергии 4s-орбитали. При нарушении симметрии, например, при появлении шестого электрона, энергия орбиталей 3d-подуровня вновь становится больше, чем энергия 4s-орбитали. Поэтому у атома марганца опять появляется второй электрон на 4s-АО. Сферической симметрией обладает общее облако любого подуровня, заполненного электронами как наполовину, так и полностью. Уменьшение энергии в этих случаях носит общий характер и не зависит от того, наполовину или полностью заполнен электронами какой-либо подуровень. А раз так, то следующее нарушение мы должны искать у атома, в электронную оболочку которого последним "приходит"девятый d-электрон. И действительно, у атома меди на 3d-подуровне 10 электронов, а на 4s-подуровне только один (рис. 6.16 б). Именно внешние электроны принимают участие в образовании связи в первую очередь, хотя бы потому, что при сближении атомов электронные облака, образованные этими электронами, приходят в соприкосновение прежде всего. Но вместе с ними участие в образовании связи может принимать и часть электронов предвнешнего (предпоследнего) слоя, но только в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов. И те и другие электроны атома являются валентными. (У лантаноидов и актиноидов валентными являются даже некоторые "предвнешние" электроны) Энергия валентных электронов намного больше, чем энергия других электронов атома, а друг от друга валентные электроны по энергии отличаются существенно меньше. Внешние электроны – всегда валентные только в том случае, если атом вообще может образовывать химические связи. Так, оба электрона атома гелия – внешние, но назвать их валентными нельзя, так как атом гелия вообще никаких химических связей не образует. Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни. 28,68. Математическое выражение закона Оствальда. Какие электролиты подчиняются ему? Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности. 29. Хлорид дихлоротетраамминкобальта(III) [Co(NH3)4Cl2]Cl 30.Межмолекулярная водородная связь. 55.Внутримолекулярные водородные связи Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед). Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров: 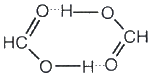 а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов. 31. Изотопы. Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон). Пример изотопов: 168O, 178O, 188O — три стабильных изотопа кислорода. 32. Закон постоянства состава. (1801-1808, Ж. Л. Пруст) Закон справедлив для веществ в жидком и газообразном агрегатных состояниях! Для твердых веществ наблюдаются отклонения за счет дефектов кристаллической решетки. Любое химически индивидуальное соединение имеет один тот же количественный состав, независимо от способа его получения.(дальтониды) Состав химических соединений зависит от способа их получения.(бертоллиды) 33.Типы солей. Если рассматривать соли как продукты замены протонов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей[4]: Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4). Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты). Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH-) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты. По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей[7]: Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl) Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O). Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl). Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например, Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], [Cu(NH3)4](OH)2). Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом[8]. 34. НеМе. Неметаллы – это химические элементы, для атомов которых характерна способность, принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое 4-х и более электронов и малому радиусу атомов по сравнению с атомами металлов. Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At. Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент. У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке: Все неметаллы, кроме фтора, проявляют восстановительные свойства (способность отдавать электроны). Причем эти свойства постепенно возрастают от кислорода к кремнию: Физические свойства: Простые вещества, образованные атомами неметаллов, построены с помощью ковалентных неполярных связей. Два типа строения простых веществ неметаллов: Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (H2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8) и лишь бром (Br2) является жидкостью. Все эти вещества летучи, в твердом состоянии они легкоплавки, и способны к возгонке. Атомное строение.Вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten) – имеют высокую твердость, высокие температуры кипения и плавления. Многие элементы-неметаллы образуют несколько простых веществ – аллотропных модификаций. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы представляют собой диэлектрики. Кристаллы непластичны, а любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска. Химические свойства. 1. Окислительные свойства неметаллов - взаимодействие с металлами: 2Na + S = Na2S - взаимодействие с водородом (образуются летучие водородные соединения): H2 + Cl2 = 2HCl - любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности: 2P + 3Cl2 = 2PCl3 - взаимодействие со сложными веществами: CH4 + 2O2 = CO2 + 2H2O 2. Восстановительные свойства - взаимодействие с кислородом (исключение – фтор): 4P + 5O2 = 2P2O5 - взаимодействие со сложными веществами-окислителями: S + 6HNO3 = H2SO4 + 6NO2? + 2H2O. При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2. 3. Реакция диспропорционирования Характерна для активных неметаллов. Протекает в щелочной среде: 3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O. |
