Химия дз. 1. Строение атома Задание. Составьте структуру электронной оболочки атомов элементовАиБ табл
 Скачать 231.67 Kb. Скачать 231.67 Kb.
|
  1. Строение атома Задание. 1. Составьте структуру электронной оболочки атомов элементов А и Б (табл. 2). 2. Покажите распределение электронов по ячейкам для атомов В и иона Г. Подсчитайте для них ковалентность. Таблица 2
Пример. Составьте структуру электронной оболочки атома 103 Lr. Покажите распределение электронов по ячейкам для атома Si* и иона Si2+. Подсчитайте для них ковалентность. Решение. Структура электронной оболочки атома 103Lr: 103Lr 1s22s2p63s2p6d104s2p6d10f145s2p6d10f146s2p6d17s2 Lr относится к семейству f - элементов. Структура электронной оболочки атома Si: 14Si 1s22s2p63s2p2 S 3 p K=2 К - ковалентность, определяется числом неспаренных электронов. В возбужденном состоянии (Si) электроны переходят на более высокие энергетические подуровни, ковалентность атома возрастает: Si3 S p K=4 Положительно заряженный ион Si2+ образуется в результате отдачи 2 электронов: Si2+=Si0-2e Следует учесть, что при образовании положительно заряженных ионов обычно происходит возбуждение электронов: Si2+3 S p K=2 2. Химическая связь Задание. Изобразите пространственную структуру молекул А и Б (табл. 3). Определите, полярна ли связь в молекулах и полярны ли молекулы в целом. Используйте справочные данные по электроотрицательности элементов. Таблица 3
Пример. Изобразите пространственную структуру молекулы BI3. Определите, полярна ли связь в молекуле и молекула в целом. Решение. Составим структуру электронной оболочки В, центрального атома молекулы: В 1s22s2p1 S 2 p К=1 Валентность бора в BI3 равна 3, следовательно, атом бора переходит в возбужденное состояние: В P S 2 К=3 В образовании связей участвуют орбитали одного s-и двух p-электронов атома бора, что приводит к образованию трех гибридных орбиталей, расположенных под углом 120°. Тип гибридизации sp2. Структура электронной оболочки атома йода I 1s22s2p63s2p6d104s2p6d105s2p5. S 5 P K=1 В образовании связей участвуют орбитали р-электронов атомов йода. 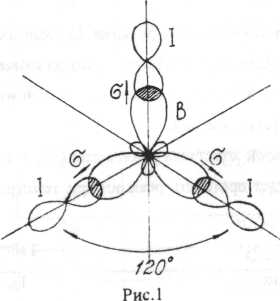 Молекула имеет форму плоского равностороннего треугольника с атомом В в центре. Угол между осями гибридных орбиталей составляет 1200. Разность электроотри-цательностей атомов В и I больше нуля, следовательно, связи в молекуле BI3 ковалентные полярные. ЭО=ЭО1 – ЭОв=2,5 – 2,0=0,5. Смещение электронной плотности происходит к атому I (на рис.1 изображено стрелкой). Молекула в целом не полярна, т.к. имеет симметрическую форму (векторная сумма дипольных моментов связей равна нулю). |
