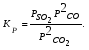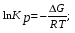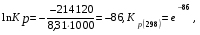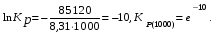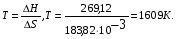3. Химическая термодинамика
Задание. Выпишите реакцию, соответствующую номеру вашего варианта (см. табл. 4). Для реакции выполните соответствующие расчеты:
Рассчитайте тепловой эффект реакции в стандартных условиях (H0298), используя справочные данные. Укажите, выделяется или поглощается теплота при протекании этой реакции. Как изменится тепловой эффект, если расходуется 1кг одного из исходных веществ?
По уравнению реакции и агрегатным состояниям веществ качественно оцените изменение энтропии реакции (S>0, S<0 или S0). Объясните полученный результат.
Рассчитайте S0298 реакции по значениям стандартных энтропий участников реакции (S0298)
Качественно оцените направление протекания реакции:
а) при высоких температурах, т.е. при Т,
б) при низких температурах, т.е. при T0. 5. Рассчитайте изменение энергии Гиббса (G0t) при T1=298К и Т2 (см. Табл. 4) для рассматриваемой реакции, допуская, что H0298 и S0298 не зависят от температуры. Укажите, какой фактор – энтальпийный или энтропийный – определяет знак G0298 и G0т2.
6. Постройте график зависимости G0т от температуры. Укажите, как влияет температура на направление реакции.
7. Напишите выражение для константы равновесия реакции Kp, выраженной через парциальные давления участников реакции, и рассчитайте термодинамическую константу равновесия для реакции при Т1 = 298 К и Т2. Укажите, при какой из этих температур равновесная смесь богаче продуктами реакции.
8. Определите температуру, при которой константа равновесия (Kp, P в атм.) равна 1. Укажите, в каком направлении будет протекать реакция при температуре, выше найденной.
Таблица 4
Номер варианта
|
Реакция
|
T2, 0C
|
1
|
4NH3(г)+5O2(г)=4NO(г)+6H2O(г)
|
250
|
2
|
4HCl(г)+O2(г)+2H2O(u)
|
500
|
3
|
2AgNO3(k)=2Ag(k)+2NO2(г)+O2(г)
|
700
|
4
|
2NaHCO3(k)=Na2CO3(k)+H2O(г)+CO2(г)
|
200
|
5
|
2CuS(k)+3O2(г)=2СuO(k)+2SO2(г)
|
150
|
6
|
Fe3O4(k)+4H2(г)=3Fe(k)+4H2O(г)
|
400
|
7
|
2H2S(г)+3O2(г)=2SO2(г)+2H2O(г)
|
200
|
8
|
4Fe(OH)2(k)+O2(г)+
2H2O(г)=4Fe(OH)3(k)
|
100
|
9
|
CS2(г0+3O2(г)=CO2(г)+2SO2(г)
|
900
|
10
|
MgCO3(k)=MgO(k)+CO2(г)
|
1000
|
11
|
Fe2O3(k)+3H2(г)=2Fe(k)+3H2O(г)
|
800
|
12
|
2KClO3(k)=2KCl(k)+3O2(г)
|
1000
|
13
|
BaO(k)+CO2(г)=BaCO3(k)
|
400
|
14
|
4HBr(г)+O2(г)=2Br2(г)+2H2O(г)
|
900
|
15
|
4NH3(г)+3O2(г)=2N2(г)+6H2O(г)
|
250
|
16
|
CaCO3(k)=CaO(k)+CO2(г)
|
1100
|
17
|
4FeS2(k)+11O2(г)=2Fe2O3(k)+8SO2(г)
|
300
|
18
|
2H2S(г)+O2(г)=2H2O(г)+2S(k)
|
500
|
19
|
FeO(k)+H2(г)=Fe(k)+H2O(г)
|
750
|
20
|
CaO(k)+H2O(г)-Ca(OH)2(k)
|
300
|
21
|
Al2O3(k)+3SO3(г)=Al2(SO4)3(k)
|
600
|
22
|
2NO(г)+O2(г)=2NO2(г)
|
800
|
23
|
2Pb(NO3)2(k)=2PbO(k)+4NO2(г)+O2(г)
|
900
|
24
|
CuSO45H2O(k)=CuSO4(k)+5H2O(г)
|
450
|
25
|
PbO(k)+SO3(г)=PbSO4(k)
|
800
|
26
|
4CO(г)+2SO2(г)=4CO2(г)+S2(г)
|
700
|
27
|
CO(г)+H2O(г)=CO2(г)+H2(г)
|
400
|
28
|
2HF(г)+O3(г)=H2O(г)+F2(г)+O2(г)
|
320
|
29
|
O3(г)+H2O2(ж)=2O2(г)+H2O(ж)
|
550
|
30
|
N2O(г)+NO2(г)=3NO(г)
|
1000
|
Пример. Выполните задание 1-8 для реакции
S(k)+2CO2(г)=SO2(г)+2CO(г), T2=727C.
Решение. Стандартные теплоты образования и энтропии веществ, участвующих в химической реакции, берём из справочника:
Вещество
|
S
|
CO2
|
SO2
|
CO
|
H298, кДж/моль
|
0
|
-393,51
|
-296,9
|
-110,5
|
S298,Дж/(мольК)
|
31,88
|
213,6
|
248,1
|
197,4
|
1. Согласно первому следствию из закона Гесса тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования реагирующих веществ с учётом стехиометрических коэффициентов:
H298=nH298(прод)-mH298(исх).
H298 = H298(SO2) + 2H298(CO) - H298(S)-
-2H298(CO2) = -296,9+2(-110,5)- (0)-
-2(-393,51)=269,12кДж.
Таким образом, при прохождении реакции тепло поглощается, то есть реакция эндотермическая (-Q). При взаимодействии 1 моль серы поглощается 269,12 кДж, а при использовании п моль серы поглощается тепла:
n(s)=m(s)/M(s); m(s)=1000г; M(s)=32г/моль.
n(s)=1000/32=31,25моль.
H298=31,25269,12=8410 кДж.
Изменение энтропии в химической реакции (S°298) определяет степень беспорядка в системе. В нашем примере S возрастает, так как образуется большее число газообразных молекул (S>0).
Изменение энтропии в химической реакции определяем по формуле:
S298=nS298(прод)-mS298(исх).
S298=S298(SO2)+2S298(CO)- S298(S)-2S298(CO2)=
=248,1+2197,4-31,88-2213,6=183,82 Дж/К.
4. Направление протекания реакции определяем по изменению энергии Гиббса
G=H-TS;
а) при высоких температурах, т.е. при Т, величиной Н в уравнении можно пренебречь, значит, G -TS. Для нашей реакции S > 0, следовательно, G< 0. Уменьшение величины энергии Гиббса свидетельствует о возможности протекания реакции в прямом направлении;
б) при низких температурах, т.е. при Т 0, можно пренебречь величиной TS и тогда GH.
В нашем примере H > 0, следовательно, G > 0 и протекание реакции в прямом направлении является маловероятным.
5. Изменение энергии Гиббса в химической реакции при стандартных условиях (Т1 =298 К):
G298=H298-TS298.
G298=269,12-298(183,82)10-3=214,29 кДж.
Знак G определяет энтальпийный фактор:
6. График зависимости G от T строим по 2 точкам (рис.2). При увеличении температуры величина энергии Гиббса уменьшается, а вероятность протекания прямой реакции возрастает.
T, K
T
1000
298
-G
G
0
Рис.2
7. Выражение константы равновесия Kpчерез парциальные давления имеет вид:
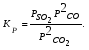
Взаимосвязь G и KP представляем уравнением:
G=-RTlnKP.
Вычислим lnKP:
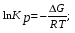
при T=298 К
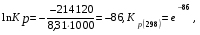
при T=1000 K
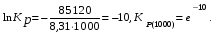
Равновесная смесь богаче продуктами при такой температуре, когда значение Kp выше. Для нашего это соответствует T2=1000 K.
8. Если Kp=1, то рассчитывая G=-R T ln Kp, получаем G=0. Из выражения H-TS=0 можно определить температуру, при которой возникает состояние равновесия:
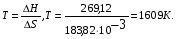
На графике это точка пересечения прямой со шкалой температур. При нагревании выше 1609 К реакция будет протекать в прямом направлении.
Кинетика и равновесие химических реакций
Задание. В газовой фазе протекает обратимая реакция (табл. 5).
Напишите уравнение для скорости прямой реакции согласно закону действующих масс.
Определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в А раз;
б) объём исходных веществ увеличить в Б раз.
Рассчитайте константу равновесия Кси первоначальные концентрации исходных веществ, учитывая заданные значения равновесных концентраций.
Укажите согласно принципу Ле - Шателье. как следует изменить по величине температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов.
Таблица 5
Номер варианта
|
Уравнение реакции
|
А
|
Б
|
Равновесные концентрации, моль/л
|
1
|
H2+Cl2=2HCl+Q
|
2
|
3
|
[H2]=0,1; [Cl2]=0,2; [HCl]=0,2
|
2
|
N2+3H2=2NH3+Q
|
2
|
3
|
[N2]=0,1; [H2]=0,3; [NH3]=0,5
|
3
|
2N2O=2N2+O2+Q
|
3
|
2
|
[N2O=0,5;[N2]=0,4; [O2]=0,2
|
4
|
2HI=H2+I2-Q
|
3
|
2
|
[HI]=0,2; [H2]=[I2]=0,5
|
5
|
2NO2=N2O4+Q
|
2
|
3
|
[NO2]=0,1; [N2O4]=0,25
|
6
|
2CO+O2=2CO2+Q
|
4
|
3
|
[CO]=0,2; [O2]=0,1; [CO2]=0,3
|
7
|
H2+I2=2HI+Q
|
3
|
4
|
[H2]=0,4; [I2]=0,3; [HI]=0,5
|
8
|
2NH3=N2+3H2-Q
|
2
|
4
|
[NH3]=0,2; [N2]=0,1; [H2]=0,3
|
9
|
CO+Cl2=COCl2+Q
|
2
|
4
|
[CO]=0,5; [Cl2]=0,1; [COCl2]=0,5
|
10
|
N2+O2=2NO-Q
|
3
|
2
|
[N2]=0,1; [O2]=0,2; [NO]=0,2
|
11
|
2NO+O2=2NO2+Q
|
3
|
2
|
[NO]=0,2; [O2]=0,3; [NO2]=0,4
|
12
|
CO+2H2=CH3OH-Q
|
2
|
3
|
[CO]=[H2]=0,1; [CH3OH]=0,
|
13
|
PCl3+Cl2=PCl5+Q
|
2
|
4
|
[PCl3]=0,3; [Cl2]=0,2; [PCl5]=0,2
|
14
|
SO2Cl2=SO2+Cl2-Q
|
4
|
2
|
[SO2Cl2]=0,2; [SO2]=[Cl2]=0,3
|
15
|
2H2+O2=2H2O+Q
|
3
|
2
|
[H2]=0,1; [O2]=0,3; [H2O]=0,3
|
16
|
COCl2=CO+Cl2-Q
|
4
|
3
|
[COCl2]=0,2; [CO]=[Cl2]=0,3
|
17
|
2HCl=H2+Cl2-Q
|
3
|
2
|
[HCl]=0,05; [H2]=[Cl2]=0,08
|
18
|
2F2+O2=2F2O+Q
|
4
|
3
|
[PCl5]=0,04; [PCl3]=[Cl2]=0,2
|
19
|
2F2+O2=2F2O+Q
|
4
|
3
|
[F2]=0,1; [O2]=0,05; [F2O]=0,3
|
20
|
2HBr=H2+Br2-Q
|
2
|
2
|
[HBr]=0,04; [H2]=[Br2]=0,05
|
21
|
2SO3=2SO2+O2-Q
|
2
|
3
|
[SO3]=0,05; [SO2]=0,2; [O2]=0,1
|
22
|
2NOCl=2NO+Cl2-Q
|
3
|
3
|
[NOCl]=0,04; [NO]=0,08; [Cl2]=0,04
|
23
|
2NO+Br2=2NOBr+Q
|
4
|
2
|
[NO]=0,2; [Br2]=0,1; [NOBr]=0,4
|
24
|
C2H2+H2=C2H4-Q
|
2
|
2
|
[C2H2]=0,05; [H2]=0,03; [C2H4]=0,1
|
25
|
N2O4=2NO2-Q
|
2
|
3
|
[N2O4]=0,02; [NO2]=0,1
|
26
|
C2H4+Cl2=C2H4Cl2+Q
|
3
|
2
|
[C2H4]=0,1; [Cl2]=0,2; [C2H4Cl2]=0,2
|
27
|
CO+Br2=COBr2+Q
|
4
|
3
|
[CO]=0,04; [Br2]=0,03; [COBr2]=0,1
|
28
|
2Cl2+O2=2Cl2O+Q
|
2
|
3
|
[Cl2]=0,1; [O2]=0,03; [Cl2O]=0,2
|
29
|
SO2+Cl2=SO2Cl2+Q
|
3
|
4
|
[SO2]=0,2; [Cl2]=0,1; [SO2Cl2]=0,4
|
30
|
PBr3+Br2=PBr5+Q
|
3
|
4
|
[PBr3]=0,01; [Br2]=0,03; [PBr5]=0,5
|
Пример 1 |
 Скачать 231.67 Kb.
Скачать 231.67 Kb.