Химия дз. 1. Строение атома Задание. Составьте структуру электронной оболочки атомов элементовАиБ табл
 Скачать 231.67 Kb. Скачать 231.67 Kb.
|
|
. Определите, как изменится скорость прямой реакции 2SO2 + О2=2SO3, если: а) концентрации исходных веществ увеличить в 2 раза; б) объём газовой смеси увеличить в 3 раза. Решение. Согласно закону действующих масс начальная скорость реакции V1=k[SO2][O2]. После увеличения концентраций SO2 и О2 V2 = k(2[SO2])22[O2] = 8k[SO2]2[O2]. Скорость прямой реакции увеличится в 8 раз. После увеличения объёма газовой смеси в 3 раза концентрации веществ соответственно уменьшатся в 3 раза: V3 = k(1/3[SO2])21/3[O2]=1/27 k[SO2]2[O2]. Скорость прямой реакции уменьшается в 27 раз. Пример 2. Равновесие гомогенной системы 2SO2+О2= 2SОз установилось при следующих концентрациях реагирующих веществ (моль/л): [SO2] = 0,2; [О2]= 0,1; [SO3] = 0,5. Рассчитайте константу равновесия и исходные концентрации SO2 и О2. Решение Определяем константу равновесия 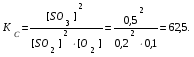 Исходные концентрации SO2 и О2 находим на основе уравнения реакции. На образование 2 моль SO3 расходуется 2 моль SO2, а на образование 0,5 моль SO3 потребовалось 0,5 моль SO2. Учитывая равновесную концентрацию SO2, находим его первоначальную концентрацию: [SO2]ИCX = 0,2 + 0,5 = 0,7 моль/л , на образование 2 моль SO3 необходимо израсходовать 1 моль О2, а для получения 0,5 моль SO3 потребуется 0,5/2=0,25 моль; [О2]исх = 0,1 + 0,25 = 0,35 моль/л.
Задание.
19. В 200 мл раствора содержится 2 г хлористого аммония (=1,03 г/мл). Определите массовую долю, нормальную и молярную концентрации раствора. 20. Какова молярность и титр 7,1%-ного раствора сульфата натрия (=1,103г/мл)? 21. Определите нормальность и титр раствора едкого калия, массовая доля которого равна 10% (=1,195 г/мл). 22. Определите молярность, нормальность и титр 3%-ного раствора азотвокжного серебра (=1,108 г/мл). 23. Определите молярность раствора, содержащего 15 г хлористого калия в 200мл воды (=1,12 г/мл).. 24. Сколько нужно взять сульфата марганца, чтобы приготовить 1 л раствора 0.25 н? Рассчитайте титр полученного раствора. 25. Сколько граммов соляной кислоты содержится в 250 мл 0,5 н раствора? 26. Определите нормальность и массовую долю раствора едкого натра, титр которого равен 0,071 г/мл (= 1,045 г/мл). 27. Для нейтрализации 20 мл раствора соды потребовалось 30 мл 0,1 н раствора кислоты. Определите нормальность и титр раствора соды. 28. В 250 мл раствора содержится 6 г сульфата магния ( = 1,08 г/мл). Определите массовую долю, нормальную и молярную концентрации раствора. 29.Сколько нужно взять роданистого аммония, чтобы приготовить 200 мл 0,2 М раствора? 30. Для нейтрализации 10 мл раствора щелочи NaOH потребовалось 15 мл 0,2 н раствора кислоты. Определите нормальность и титр раствора щелочи. Пример 1. Определите массовую долю (%) хлорида калия в растворе, содержащем 53 г КС1 в 0,5 л раствора, плотность которого равна 1,063 мл. Решение. Массовую долю (w, %) вещества в растворе рассчитываем по формуле: 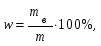 где mв - масса растворенного вещества, г; m – масса раствора, г. Учитывая, что =m/V, находим массу раствора: m=V. Рассчитываем массовую долю хлорида калия в растворе: 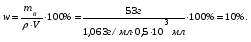 Пример 2. В иоде массой 200 г растворили гидроксид калия массой 11.2 г. Плотность полученного раствора равна 1,04 г/мл. Рассчитайте молярную концентрацию этого раствора. Решение. Молярную концентрацию (СM, моль/л) выразим формулой: 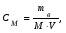 где mВ – масса растворенного вещества, г; M – молярная масса растворенного вещества, г/моль; V – объем раствора, л. Рассчитаем массу полученного раствора: m = m (H2O) + m (KOH); m = 200 + 11,2 = 211,2г. Объем полученного раствора составляет: 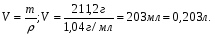 Рассчитаем молярную концентрацию раствора KOH: 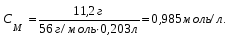 Пример 3. Определите молярную концентрацию эквивалента (нормальность раствора) хлорида железа (III), если в 0,3 л раствора содержится 32,44 г FeCl3. Решение. Молярную концентрацию эквивалента (нормальность в растворе) выразим формулой: 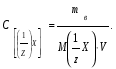 где mв – масса растворенного вещества, г; M(1/z X) – молярная масса эквивалента растворенного вещества, г/моль; V – объем раствора, л. Молярная масса эквивалента FeCl3 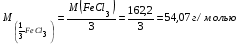 Рассчитаем молярную концентрацию эквивалента раствора FeCl3: 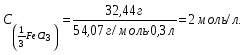 Молярную концентрацию эквивалента (нормальность) также можно обозначить Cy. Пример 4. На нейтрализацию 50 мл раствора кислоты израсходовано 25 мл 0,5 н раствора щелочи. Чему равна нормальность кислоты? Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е. V1/V2= CH2/CH1 или V1CH1=V2CH2. 50СH1=250,5; отсюда CH1=250,5/50=0,25 н.
Задание 1. Напишите уравнения диссоциации электролитов, указанных в табл. 6. Для слабых электролитов приведите выражение для константы диссоциации. Таблица 6.
Пример 1. Напишите уравнения диссоциации гидроксида кальция и гидроксида никеля. Решение. Ca(OH)2 является сильным электролитом (основание щелочно-земельного металла), поэтому диссоциирует необратимо в одну стадию: Ca(OH)2 Ca2+ +2OH-. Ni(OH)2 – малорастворимое в воде основание, является слабым электролитом. Ni(OH)2 диссоциирует ступенчато в две стадии. Процесс диссоциации слабых электролитов протекает обратимо, следовательно, можно записать выражение константы диссоциации: I Ni(OH)2 NiOH+ +OH- 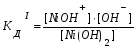 II. NiOH+ Ni2+ +OH- 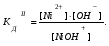 Пример 2. Напишите уравнения диссоциации серной и сероводородной кислот. Решение. Серная кислота – сильный электролит, диссоциирует в одну стадию: H2SO4 2H++SO42-. H2S – слабый электролит, диссоциирует в две стадии: I. H2SH++HS- 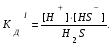 II. HS-H++S2- 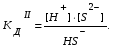 Пример 3. Напишите уравнения диссоциации сульфата алюминия, гидроксонитрата магния и гидрофосфата натрия. Решение. Сульфат алюминия Al2(SO4)3 относится к средним солям, является сильным электролитом: Al2(SO4)3 2Al3++3SO42-. При диссоциации основных и кислых солей первая стадия диссоциации соответствует диссоциации сильного электролита, а остаток основания или кислоты диссоциирует как слабый электролит: Гидроксонитрат магния MgOHNO3 – основная соль, диссоциирует по схеме: I. MgOHNO3 MgOH++OH- сильный электролит. II. MgOH+Mg2++ OH- слабый электролит. 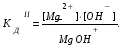 Гидрофосфат натрия Na2HPO4 – кислая соль, диссоциирует по схеме: I. Na2HPO4 2Na++HPO42- сильный электролит. II. HPO42- H++ PO43- слабый электролит. 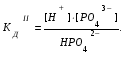 Задание 2. Определите pH раствора заданной концентрации С (табл. 7). При расчете pH раствора слабого электролита учитывайте первую стадию диссоциации. Значения констант диссоциации слабых электролитов приведены в справочных таблицах. Таблица 7.
|
