Химия дз. 1. Строение атома Задание. Составьте структуру электронной оболочки атомов элементовАиБ табл
 Скачать 231.67 Kb. Скачать 231.67 Kb.
|
|
6 Гальванический элемент Задание. 1. Составьте схему гальванического элемента. Материалы электродов и концентрации растворов солей указаны в табл. 10. 2. Рассчитайте электродные потенциалы анодного и катодного процессов, вычислите ЭДС гальванического элемента. Значения стандартных электродных потенциалов приведены в ряду напряжений. 3. Напишете уравнения процессов, протекающих на электродах. Таблица 10
Пример. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, погруженные в растворы их солей с концентрациями ионов Mg2+ и Zn2+, равными 0,01 моль/л. Вычислите ЭДС этого элемента. Напишите уравнения процессов, протекающих на электродах. Решение. Схема данного гальванического элемента: (-) Mg/Mg2+ //Zn2+/Zn (+). Стандартные электродные потенциалы: 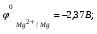 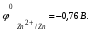 Для определения ЭЛС рассчитаем потенциалы анода и катода с учетом концентраций ионов в растворах согласно уравнению Нернста: 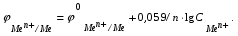 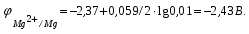 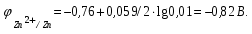 ЭДС = катода - анода. 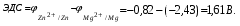 Магниевый электрод является анодом, т.к. имеет меньший потенциал. Цинковый электрод является катодом. Уравнения процессов, происходящих на электродах: Анод Mg – 2e = Mg2+ окисление. Катод Zn2+ + 2e = Zn восстановление.
Задание. Составьте схему электролиза раствора (табл. 11). Напишите электронные уравнения процессов, протекающих на электродах. Катодный процесс подтвердить расчетами. Значения стандартных электродных потенциалов металлов необходимо взять из ряда напряжений. Таблица 11.
Пример. Составьте схему электролиза раствора Mn(NO3)2 (pH раствора 7. CMn2+= 0,1 моль/л). Электроды: а) никелевые. 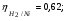 б) катод кадмиевый, анод графитовый, 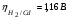 Решение. Диссоциация Мn(NO3)2 происходит по уравнению: Mn(NO3)2 Mn2++2NO3. Катодный процесс. При пропускании тока к отрицательному катоду притягиваются частицы Мn2+ и диполи Н2О.Раньше восстанавливаются частицы с более положительным потенциалом разряда i. Потенциал разряда частиц Мn2+ близок к равновесному потенциалу: 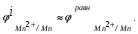 Равновесный потенциал металла определим по формуле Нернста: 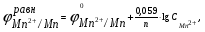 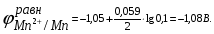 Равновесный потенциал восстановления водорода зависит от pH раствора и парциального давления водорода. 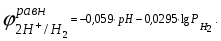 При pH раствора 7 и парциальном давлении водорода воздуха 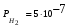 определим равновесный потенциал восстановления водорода: определим равновесный потенциал восстановления водорода: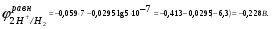 Потенциал разряда водорода на катоде меньше равновесного значения на величину перенапряжения Потенциал разряда водорода на катоде меньше равновесного значения на величину перенапряжения 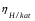 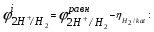 а) на никелевом катоде этот потенциал соответствует 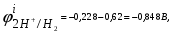 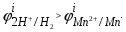 Сравнивая потенциалы разряда металла и водорода, приходим к выводу, что на катоде протекает процесс восстановления водорода: 2H2O+2e=H2+2OH. В результате образования OH групп возможен процесс образования в катодном пространстве Mn(OH)2; б) на кадмиевом электроде потенциал разряда водорода соответствует: 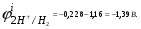 В этом случае 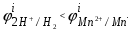 Поэтому на катоде восстанавливается металл: Mn2++2e = Mn. Анодный процесс. При прохождении тока к положительному аноду притягиваются ионы NO3 и диполи воды. Раньше окислению подвергаются частицы с более отрицательным потенциалом разряда: а) никелевый анод растворим, поэтому происходит окисление никеля: Ni – 2e Ni2+. В анодном пространстве при этом образуется Ni(NO3)2; б) графитовый анод нерастворим, значит, идет процесс окисления воды: 2H2O – 4e O2+4H+. В этом случае в анодном пространстве образуется HNO3.
Задание. 1. Определите термодинамическую возможность коррозии металла А с деполяризацией Б в среде с концентрацией ионов металла, равной В (табл.13), при заданном pH (Т=298 К). 2. Напишите электронные уравнения процессов, протекающих на анодных и катодных участках. При определении потенциалов водородного и кислородного электродов примите парциальные давления водорода и кислорода PH2 = 510-7 атм., PO2= 0,21 атм. Значения стандартных электродных потенциалов металлов приведены в ряду напряжений. Таблица 13
Пример 1. Определите термодинамическую возможность коррозии хрома с кислородной деполяризацией в щелочном растворе (pH 14) с концентрацией ионов Cr3+, равной 0,001 моль/л. Решение. Коррозия как самопроизвольный процесс протекает, если энергия Гиббса реакции имеет отрицательное значение (G<0). G = -nFЭДС, где n – число электронов, участвующих в процессе, F – постоянная Фарадея (96500 Кл). Для расчета ЭДС рассчитаем потенциал окислителя ( 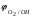 ) и восстановителя ( ) и восстановителя (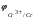 ). Определим потенциал кислородного электрода при 298 К согласно уравнению: ). Определим потенциал кислородного электрода при 298 К согласно уравнению: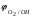 =1,23+0,0147lgP02 – 0.059 pH=1.23+0.0147lg 0,21-0,05914=0,391 В. =1,23+0,0147lgP02 – 0.059 pH=1.23+0.0147lg 0,21-0,05914=0,391 В.Рассчитаем потенциал металла в указанной среде: 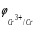 = =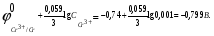 ЭДС=  - - =0,.391-(-0,799) =1.19 B. =0,.391-(-0,799) =1.19 B.ЭДС>0, следовательно, G<0. Коррозия возможна и описывается следующими уравнениями процессов, протекающих на анодных и катодных участках: Анод Cr – 3e = Cr3+. Катод O2+2H2O+4e = 4OH-. Пример 2. Определите термодинамическую возможность коррозии кадмия с водородной деполяризацией в кислом растворе (pH = 0) с концентрацией ионов Cd2+, равной 0,01 моль/л. Решение. Для определения возможности процесса коррозии рассчитаем потенциалы окислителя и восстановителя. Потенциал водородного электрода при 298 К описывается уравнением: 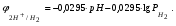 Учитывая, что 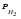 =510-7 атм., рассчитаем потенциал окислителя: =510-7 атм., рассчитаем потенциал окислителя: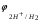 =-0,0590-0,0295lg510-7=0,186 В. =-0,0590-0,0295lg510-7=0,186 В.Рассчитаем потенциал восстановителя: 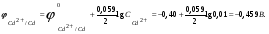 ЭДС = ЭДС = 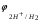 - -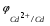 =0,186-(-0,459)=0,645 В. =0,186-(-0,459)=0,645 В.ЭДС>0, следовательно, G<0. Коррозия возможна и выражается следующими уравнениями процессов на анодном и катодном участках: Анод Cd - 2e = Cd2+ Катод 2H++2e = H2. Справочные данные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

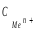 моль/л
моль/л