Патофизиология. Занятие 10. 1. Структура, функции и роль системы иммунобиологического надзора (ибн)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
6. Иммунодефициты с нарушением продукции антител (дефекты В-системы).СИНДРОМ БРУТОНА • наследственное заболевание, сцепленное с Ххромосомой • болеют мальчики • сопровождается снижением (отсутствием) иммуноглобулинов А, G, М • симптомы заболевания начинают проявляться с 5 – 12 мес жизни ребенка • характерны рецедивирующие гнойные инфекции (отит, пневмонии, абсцессы) • сохраняется резистентность организма к вирусам, грибам, туберкулезной палочке СИНДРОМ ЙОВА • селективный иммунодефицит IgA • высокий уровень IgЕ • эозинофилия • снижение хемотаксиса лейкоцитов • гиперчувствительность кожи и слизистых к стафилококку стафилококковые дерматиты и кондидозы кожи и слизистых оболочек 7. ИДС, обусловленные дефектами А-клеток иммунной системы (синдром Чедиака-Хигаси).СИНДРОМ ЧЕДИАКА - ХИГАСИ • дисфункция нейтрофилов • чрезмерная чувствительность к инфекциям • альбинизм • повышенная склонность к росту злокачественных образований 8. ИДС, обусловленные дефектами системы комплемента.Дефекты системы комплемента (ДСК) относятся к первичным иммунодефицитным состояниям человека, среди которых занимают чуть более одного процента случаев. Система комплемента представлена девятью компонентами, которые играют решающую роль в иммунном ответе организма на воздействие инфекционных патогенов. Соответственно, ДСК уменьшают устойчивость человека против болезней. Более часто встречается дефицит следующих факторов: C1, С2, С4, С6 и С10. Дефект каждого из компонентов системы имеет свои характерные клинические признаки. Считается, что данная патология является генетически детерминированной. Наследование осуществляется по аутосомно-рецессивному типу: у гетерозиготных носителей количество дефектного белка комплемента понижено на 50% против нормы, что легко выявляется при лабораторном исследовании. ДСК ведет к развитию клинического пейзажа, характеризующегося развитием септических инфекций и аутоиммунных заболеваний, а дефекты компонента С3 могут закончиться летально. У ряда больных с ДСК инфекционные заболевания протекают без лейкоцитоза. Прогноз заболевания в целом неблагоприятный, однако при своевременной диагностике и непрерывном лечении возможна пролонгация жизни пациентов. Симптомы дефектов системы комплемента Заболевания, типичные для дефицита каждого из компонентов: Дефицит С1-компонента: системные васкулиты, персистирующие синуиты, отиты, пневмонии, остеомиелит, менингит, сепсис, наследственный ангионевротический отек, люпус-нефрит. Дефицит С2-компонента: ксеродерма, капилляротоксикоз, герпетиформный дерматит, ходжкинская лимфома, хронический лимфолейкоз. Дефицит С3-компонента: пневмонии, менингиты, флегмоны, перитониты, СКВ, реактивные артриты, дерматиты, гломерулонефрит, синдром Шегрена. Дефицит С4-компонента: инфекции не наблюдаются, зато случается СКВ, синдром Шегрена, гиперкератоз ладоней и стоп, инсулинозависимый сахарный диабет. Дефицит терминальных компонентов (С5-С9): развитие тяжелых инфекций, вызванных N. meningitidіs и N. Gonorrhoeae, проявляющихся повторяющимися менингококковыми ринофарингитами, пневмониями, менингококкцемией, менингококковым менингитом. Гонорея в этих случаях имеет тяжелое течение и резистентна к антибактериальным препаратам. Диагностика дефектов системы комплемента Возможна с помощью следующих лабораторных методик: ОАК: анемия, лейкопения, тромбоцитопения, эозинофилия; количественное определение IgJ, IgМ и IgA; детекция уровня общего IgE в сыворотке; исследование фагоцитов; определение изогемагглютининов для оценки уровня IgM в сыворотке; определение уровня хлора в поте и оценка экзокринной функции поджелудочной железы; постановка кожных аллергических проб; определение титра комплементной активности: сниженный или неопределяемый уровень титра комплементной активности свидетельствует о наследственной недостаточности системы комплемента; определение количества Т- и В-лимфоцитов, их субпопуляций; биопсия лимфоузлов, кишечника, тимуса. 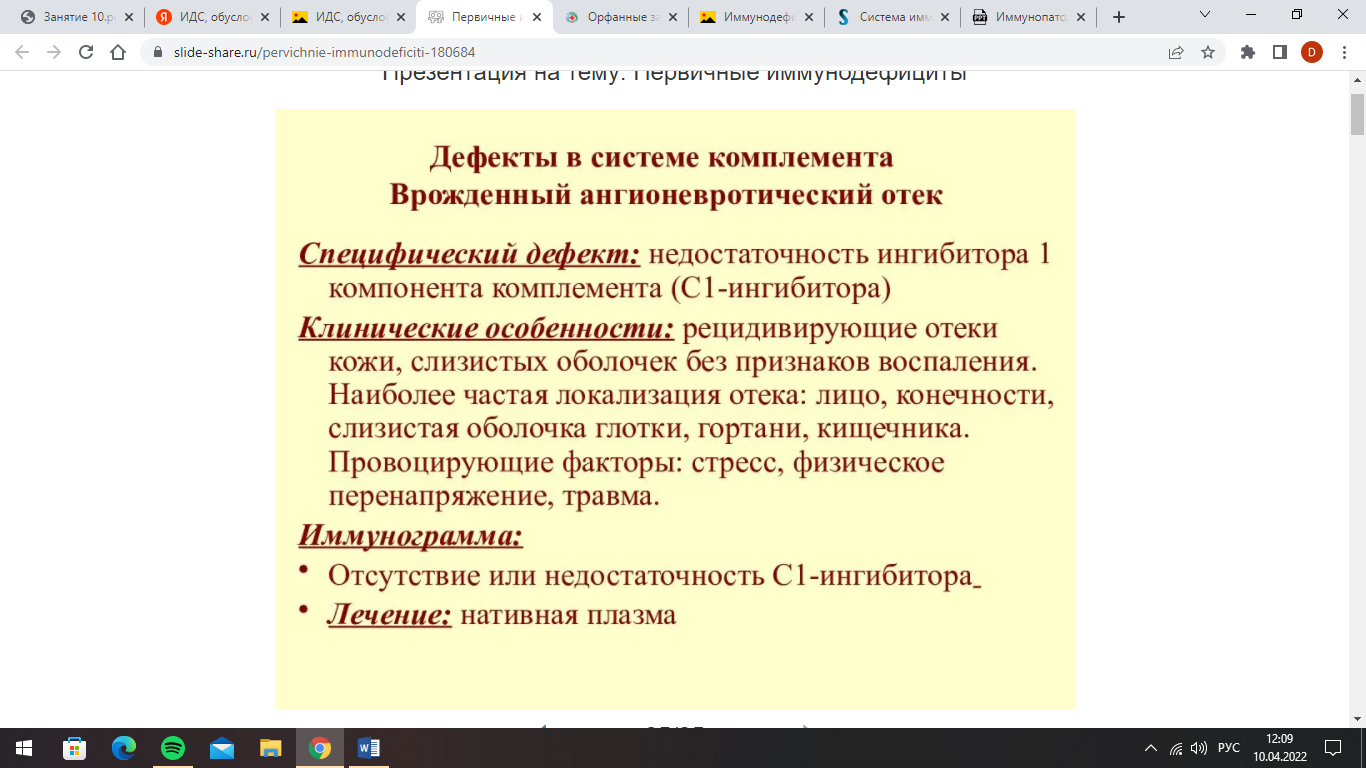 9. Комбинированные ИДС: ретикулярный дисгенез, «швейцарский тип», ферментодефицитные формы.Характеризуются нарушением дифференцировки стволовых клеток, блоком созревания Т- и В-лимфоцитов и их дефицитом. Комбинированные формы иммунодефицита встречаются чаще, чем селективные. При комбинированных ИДС ведущая роль принадлежит дефекту Т-лимфоцитов. Синдром ретикулярной дисгенезии характеризуется уменьшением в костном мозге количества стволовых клеток. Характерна внутриутробная гибель плода, или дети гибнут вскоре после рождения. «Швейцарский» тип иммунодефицита характеризуется поражением Т- и В-систем и, следовательно, нарушением клеточных и гуморальных реакций иммунологической защиты. Содержание В-лимфоцитов может соответствовать норме или превышать ее, но эти клетки не способны секретировать иммуноглобулины в достаточном количестве. Заболевание проявляется в первые месяцы жизни и часто характеризуется злокачественным течением. Наблюдается задержка прибавки массы тела, уже в первые дни жизни у некоторых детей появляются кореподобные высыпания на коже, что может быть связано с реакциями несовместимости по отношению к материнским лимфоцитам, поступающим через плаценту в кровоток ребенка. Развиваются признаки кожного кандидоза, диарея, острая интерстициальная пневмония, приобретающая затяжной и рецидивирующий характер. Дети очень восприимчивы к вирусным инфекциям. В крови выявляется значительная лимфопения, особенно низко содержание Т-лимфоцитов. Содержание иммуноглобулинов всех классов снижено. Исключение составляют грудные дети с IgG, полученными от матери. Патогномоничны изменения вилочковой железы, гипоплазия миндалин и лимфатических узлов. Возникает неспособность проявлять реакции гиперчувствительности замедленного типа. Дети редко доживают до 2–летнего возраста. Синдром атаксии-телеангиоэктазии (синдром Луи-Бар) обусловлен дефектом созревания, снижением функции Т-лимфоцитов, уменьшением их числа в крови (особенно Т-хелперов), дефицитом иммуноглобулинов (особенно IgA, IgE, реже IgG). Синдром характеризуется сочетанием атаксии и других неврологических отклонений с телеангиэктатическими изменениями сосудов склер, лица. Поражение нервной системы проявляется симптомами выпадения функций мозжечка, подкорковых ганглиев, диэнцефальной области, пирамидной системы. В результате их поражений возникают нарушение походки, замедленность произвольных движений, гиперкинезы, вегетососудистая дистония. У многих отмечаются вялотекущие пневмонии, развиваются ателектазы, пневмосклероз и бронхоэктазы. Выявляется гипоплазия вилочковой железы, лимфатических узлов, селезенки, лимфопения, не определяются IgA. Заболевание характеризуется аутосомно-рецессивным типом наследования. Прогноз синдрома неблагоприятен. Около 50 % летальных исходов обусловлено хроническим поражением бронхо-легочной системы, около 20 % – развитием злокачественных процессов, которые связывают с утратой функциональной активности тимусзависимых лимфоцитов и функции иммунологического надзора. Некоторые больные доживают до 40–50 лет. Синдром Вискотта-Олдрича – это Х-сцепленное заболевание, характеризующееся комбинированным иммунодефицитом в сочетании с тромбоцитопенией и экземой. Заболевание является результатом мутации гена, кодирующего белок, который принимает участие в полимеризации актина и формировании цитоскелета. Отсутствие этого белка в лимфоцитах и тромбоцитах больных приводит к развитию тромбоцитопении, нарушению функций Т-лимфоцитов и регуляции синтеза антител. Диагноз типичных форм синдрома Вискотта-Олдрича можно предположить у больных мужского пола при наличии тромбоцитопении с уменьшением размера тромбоцитов в сочетании с экземой и частыми инфекционными заболеваниями бактериальной, реже – вирусной и грибковой этиологии. Однако часто встречаются лёгкие формы заболевания, протекающие с тромбоцитопенией и геморрагическим синдромом разной степени выраженности, но без выраженного инфекционного синдрома и/или аллергического анамнеза. Отмечается лимфопения, в основном за счёт Т-лимфоцитов, снижение функциональной активности Т-лимфоцитов, нормальный или сниженный уровень IgG, повышенный уровень IgA и IgE. Клинические проявления заболевания, как правило, дебютируют на первом году жизни. Геморрагический синдром в виде мелены, носовых кровотечений, кожной геморрагической сыпи чаще всего имеется у всех больных на момент постановки диагноза. Часто встречается аутоиммунная анемия, гломерулонефрит, колит, иммунная нейтропения. Прогноз тяжелых форм неблагоприятен, дети погибают в возрасте до 10 лет. К летальному исходу приводят инфекции, геморрагии или злокачественные новообразования лимфоретикулярной системы. 10. Вторичные (приобретенные) иммунодефицитные и иммуннодепрессивные состояния при инфекциях, лучевых поражениях, потерях белка, интоксикациях, алкоголизме, опухолях, старении и др.; ятрогенные иммунодефициты. Иммунодефицитными состояниями называют постоянные (стойкие) или временные (транзиторные) состояния, характеризующиеся неадекватным иммунным ответом на антигены микробного или какого-либо иного происхождения. Иммунодефициты делятся на первичные (врожденные), физиологические и вторичные (приобретенные). Первичные иммунодефицитные состояния являются генетически обусловленными и проявляются на уровне генотипа. Вторичные иммунодефицитные состояния формируются у контингентов с исходно нормальной иммунной системой под действием окружающей среды или других факторов. Они проявляются на уровне фенотипа. Причины развития иммунодефицитных состояний: 1) вирусные, бактериальные, паразитарные инфекции 2) аутоиммунные заболевания 3) прием лекарств (кортикостероиды, иммунодепрессанты, цитостатики), лучевая терапия 4) эндокринные заболевания (ожирение, сахарный диабет) 5) онкологические заболевания 6) стрессы 7) хирургические вмешательства (особенно спленэктомия) 8) потери белка (ожоговая болезнь, хроническая почечная недостаточность, энтеропатии) 9) дефицит питания 10) воздействие неблагоприятных экологических факторов Вторичные иммунодефициты, возникающие при инфекционных заболеваниях. Инфекции - наиболее частые причины развития вторичных иммунодефицитов. Это связано Вирусные и др. инфекции. В соответствии с критериями ВОЗ вторичные иммунодефициты могут формироваться при острых вирусных инфекциях - кори, краснухе, гриппе, эпидпаротите, ветряной оспе, вирусном гепатите, персистирующих вирусных инфекциях - хроническом гепатите В, С, ЦМВИ, герпетической инфекции, врожденных вирусных инфекциях - краснухе, ЦМВИ, герпесе, также токсоплазмозе и т.д. Механизмы формирования: некоторые вирусы обладают тропностью к иммунокомпетентным клеткам - лимфоцитам и макрофагам. Размножаясь в Т- и В- лимфоцитах, вирусы подавляют их функциональную активность, способность к синтезу цитокинов, антител, разрушению клеток-мишеней. Инфицируя макрофаги, вирусы нарушают процессы презентации антигена, а также способность макрофагов к поглощению и перевариванию чужеродных антигенов. Сами иммунокомптентные клетки могут быть резервуаром для размножения вирусов. Самыми частыми при вирусных инфекциях являются нарушения Т-клеточного звена иммунитета. Снижение количества Т-лимфоцитов и их функциональной активности может наблюдаться при кори, краснухе, инфекционном мононуклеозе, гриппе, РС-инфекции, полиомиелите, гепатите В, ВИЧ-инфекции. Иммунодефицитное состояние при этом может длиться от нескольких недель (грипп, краснуха) до нескольких месяцев (корь, гепатит В) и даже лет (инфекционный мононуклеоз). При ВИЧ-инфекции иммунологические нарушения постепенно прогрессируют и становятся причиной гибели больного. Выраженные нарушения Т-клеточного звена иммунитета возникают при хронических и длительно персистирующих вирусных инфекциях (герпес, ЦМВ, хронический гепатит В, С, Д). В ряде случаев они сохраняются пожизненно. Некоторые вирусы обладают способностью вызывать дефекты нейтрофильных гранулоцитов, уменьшать их бактерицидную и переваривающую активность, что наблюдается при гриппе, парагриппе, РС-инфекции, ЦМВ, герпесе, ветряной оспе, гепатите В, краснухе, ВИЧ-инфекции. Роль нейтрофилов в защите от этих инфекций не является определяющей. Однако эти клетки осуществляют основную защиту организма от бактериальных и грибковых антигенов и их дефекты являются главной причиной бактериальных осложнений при вирусных инфекциях (отиты, пневмонии, синдром токсического шока, сепсис, менингит). Дефициты гуморального звена иммунитета (гипогаммаглобулинемии) часто связаны с внутриутробными инфекциями (краснуха, ЦМВ, герпес). У детей с ВУИ может наблюдаться снижение иммуноглобулинов вплоть до формирования первичных дефицитов гуморального звена. Для таких детей характерен селективный дефицит IgA, поздний «иммунологический старт». Бактериальные инфекции В соответствии с критериями ВОЗ вторичные иммунодефициты могут формироваться при лепре, туберкулезе, сифилисе, пневмококковой, менингококковой, стафилококковой инфекциях. Механизмы развития: Острые бактериальные инфекции редко ведут к развитию стойкой иммунной недостаточности. Возникающие нарушения чаще всего имеют транзиторный характер и отражают активность бактериального воспаления. При хронических и рецидивирующих бактериальных инфекциях, сопровождающихся накоплением в организме большого количества бактериальных антигенов, токсико-инфекционными перегрузками, может наблюдаться истощение компонентов системы комплемента, иммуноглобулинов, снижение функциональной активности фагоцитирующих клеток. Хронические бактериальные инфекции могут сопровождаться снижением активности системы комплемента, его отдельных компонентов, уровня пропердина. Снижение поглотительной активности фагоцитов при бактериальных процессах наблюдается редко и встречается преимущественно при генерализованных инфекциях, сепсисе, перитоните. Бактерицидная активность фагоцитов крови снижается при длительных бактериальных инфекциях. Ослабление кислородзависимой бактерицидности предрасполагает к вторичному инфицированию кожи и слизистых стафилококком, кишечной палочкой, грибами Aspergillus, Candida albicans. Снижение переваривающей активности нейтрофилов и незавершенный фагоцитоз связаны со способностью ряда бактерий размножаться внутри фагоцитирующих клеток. Это характерно для сальмонеллеза, иерсиниоза, брюшного тифа, паратифа, менингококковой, стафилококковой и стрептококковой инфекции. Является одной из основных причин возникновения затяжных и хронических форм бактериальных инфекций, длительного бактерионосительства. При острых бактериальных инфекциях нарушений Т-клеточного звена иммунитета, как правило, не возникает. Исключение составляют внутриклеточные бактериальные инфекции (сальмонеллез, туберкулез, листериоз, бруцеллез, туляремия). В иммунологическом статусе при этих инфекциях может наблюдаться: снижение количества Т-лимфоцитов (CD3), повышение уровня Т-цитотоксических (CD8), НК-клеток (CD16). Снижение уровня Т-хелперов (CD4) характерно для пневмококковой, менингококковой инфекций. Грибковые инфекции Почти все слизисто-кожные и висцеральные микозы возникают на фоне недостаточности Т-клеточного звена иммунитета и/или недостаточности фагоцитирующих клеток. Прогрессирование грибковых инфекций может вызывать дальнейшее снижение количества Т-лимфоцитов и их функциональной активности. В целом, иммунологические нарушения являются важным звеном в патогенезе инфекционных заболеваний. Максимальные изменения в иммунологическом статусе, как правило, соответствуют острому периоду заболевания и нормализуются к периоду клинического выздоровления. Однако восстановление иммунного статуса может затянуться на месяцы. Последствием формирующейся иммунологической недостаточности является затяжной характер инфекционных заболеваний, склонность к рецидивам, хронизации, длительному выделению микробных агентов. С иммунологическими нарушениями связывают и развитие вторичных инфекционных осложнений, возбудителями которых часто являются условно-патогенные микроорганизмы разных классов: бактерии, вирусы, грибы, простейшие. Вторичные инфекции проявляются в виде отитов, синуситов, пневмоний, синдрома токсического шока, менингита, сепсиса. Нередко именно они определяют клиническое течение и исход инфекционного процесса. Дефицит белкового питания (нефротический синдром, энтеропатии, синдром мальабсорбции). У детей раннего возраста неполноценное питание ведет к снижению массы тимуса, часто с отсутствием или истончением коры. Может наблюдаться нарушение нормального становления иммунологической реактивности. Потери белка приводят к снижению уровня иммуноглобулинов, компонентов системы комплемента При синдроме мальабсорбции может наблюдаться снижение количества Т-лимфоцитов, их функциональной активности. Дефицит микроэлементов. Дефицит цинка и железа часто вызывают Т-клеточный иммунодефицит. Дефицит магния может вызывать снижение количества НК-клеток, нарушать процессы адгезии и взаимодействия иммунокомпетентных клеток. Дефицит селена ведет к формированию Т-клеточной недостаточности. Селен - важный антиоксидант, при его недостатке могут возникать различные нарушения неспецифических факторов защиты, клеточного и гуморального звеньев иммунитета. Онкологические заболевания. Индукторами опухолевого роста могут быть неблагоприятные физические, химические, лучевые факторы. Однако, при адекватной работе иммунитета функционирует мощная система иммунобиологического надзора, основными компонентами которой являются натуральные киллеры и тканевые макрофаги. Они обладают способностью быстро элиминировать опухолевые, мутантные, разрушенные клетки организма. Опухоль, как правило, возникает на фоне нарушений иммунобиологического надзора. С другой стороны, онкологические заболевания (особенно опухоли лимфоидной ткани) сами обладают мощным иммунодепрессивным действием, усугубляющим имеющийся иммунодефицит. Опухоли лимфоидной ткани: При онкологических заболеваниях может наблюдаться нарушение всех звеньев иммунитета: снижение количества Т-лимфоцитов и их субпопуляций, снижение функциональной активности Т-лимфоцитов, снижение или повышение уровня иммуноглобулинов, снижение факторов неспецифической защиты. Вторичные ИДС при опухолях проявляются в виде бактериальных, микотических, вирусных инфекций с преимущественным поражением кожи, слизистых, органов дыхания, ЖКТ. Очень часто у иммунокомпрометированного хозяина развиваются рецидивирующие пневмонии, кожно-слизистый кандидоз, инфекции ЖКТ, сепсис. Типичным является развитие оппортунистических инфекций. Эмоциональное перенапряжение, депрессия, стрессы. Оказывают угнетающее влияние на большинство показателей клеточного и гуморального иммунитета. Клинически это проявляется снижением резистентности к инфекциям и развитием опухолей. Посттравматический и послеоперационный периоды. Часто осложняется развитием вторичного иммунодефицитного состояния. Нарушаются преимущественно неспецифические факторы защиты (барьерная функция кожи, система фагоцитирующих клеток). Результатом формирующейся иммунодепрессии является развитие послеоперационных нагноений, послеоперационный сепсис. Возбудителями гнойной инфекции, как правило, являются представители условно-патогенной микрофлоры. Спленэктомия сопровождается развитием вторичного иммунодефицитного состояния. После спленэктомии наблюдается нарушение фильтрующей функции макрофагов селезенки, снижение в сыворотке крови IgM, (в селезенке синтезируется значительная часть сывороточного IgM), нарушение механизмов активации системы комплемента, активности естественных киллеров. Удаление селезенки в детском возрасте часто способствует развитию септических инфекций. Ожоги. Нарушение функции иммунной системы при ожоговой болезни обусловлено следующими факторами: -повреждение пограничных тканей (нарушение барьерных функций кожи и слизистых) -мощное стрессорное воздействие -повышенная антигенная нагрузка за счет денатурированных и дегидратированных тканевых белков и ферментного аутолиза тканей. -интенсивная потеря иммуноглобулинов с плазмой. На 1 этапе вследствие потери иммуноглобулинов развивается В-клеточный иммунодефицит с повышенной чувствительностью к бактериальным инфекциям. Вторичный Т-клеточный дефицит развивается при значительной площади ожогового поражения (более 30% поверхности кожи). На фоне ожогов может наблюдаться снижение функции нейтрофильных гранулоцитов, снижение опсонизирующей активности сыворотки за счет потери иммуноглобулинов и компонентов комплемента. Следствием этого является присоединение инфекций. Ионизирующая радиация. Выраженность вторичного пострадиационного иммунодефицита связана с высокой чувствительностью лимфоцитов и их костно-мозговых предшественников к повреждающему действию ионизирующей радиации. Под действием облучения может наблюдаться нарушение всех звеньев иммунитета: неспецифических факторов защиты, системы Т- и В-лимфоцитов, макрофагов. Загрязняющее действие окружающей среды химическими веществами. Воздействие вредных химических веществ вызывает повреждение иммунной системы и формируют ИДС, на фоне которых снижается устойчивость организма к инфекциям, нарушается течение воспалительных, репаративных процессов, нарушается обмен веществ, повышается риск возникновения злокачественных новообразований, аллергических и аутоиммунных заболеваний. Различные звенья иммунной системы обладают различной чувствительностью к действиям окружающей среды. В первую очередь повреждаются неспецифические формы защиты, в дальнейшем, на фоне развивающейся интоксикации может возникать недостаточность Т-системы иммунитета. Другие причины. Сахарный диабет сопровождается угнетением Т-клеточного звена иммунитета, нарушениями в системе комплемента, фагоцитирующих клеток, что сопровождается развитием частых нагноений, неблагоприятным течением хронических инфекций. Уремия ведет к развитию Т-клеточной иммунодепрессии (снижению количества Т-лимфоцитов, нарушение их функций). Нарушается также переваривающая активность фагоцитирующих клеток за счет снижения продукции активных форм кислорода. Болезни печени (острый и хронический гепатит, цирроз) сопровождаются нарушением синтеза компонентов комплемента, снижением количества Т-лимфоцитов, их функциональной активности, уменьшением переваривающей активности фагоцитирующих клеток. Клинические проявления вторичных иммунодефицитов. Различные причины возникновения ИДС вызывают разнонаправленные изменения иммунологического статуса. Основными клиническими проявлений формирующегося иммунодефицита является развитие инфекций, аллергий, аутоиммунных, опухолевых заболеваний. Возбудителями инфекций часто являются условно-патогенные возбудители. При нарушениях в Т-системе иммунитета чаще развиваются инфекции, вызываемые внутриклеточными паразитами. При недостаточности иммуноглобулинов повышается чувствительность к кокковой флоре. При нарушениях в системе фагоцитирующих клеток увеличивается восприимчивость к бактериальным (внеклеточным) и некоторым грибковым инфекциям (кандидоз, аспергиллез). Иммунная недостаточность, возникающая на фоне инфекционного процесса, часто является основной причиной его хронизации. |
