Лекции. 1 Выделение нуклеиновых кислот
 Скачать 231.21 Kb. Скачать 231.21 Kb.
|
|
1.1. Выделение нуклеиновых кислот Выделение нуклеиновых кислот (НК) – это важный подготовительный этап для большинства молекулярно-генетических методов исследования. Источником НК может служить любой биологический объект. Большое внимание необходимо уделять процедуре сбора и формирования коллекций образцов для молекулярно-генетического исследования. Для каждого образца используют индивидуальные инструменты и одноразовые контейнеры для хранения. Это необходимо для предотвращения перекрестного загрязнения (контаминации) одного образца генетическим материалом другого. Образцы хранят в замороженном состоянии или сразу используют для выделения нуклеиновых кислот. К настоящему времени разработано множество методов выделения, как суммарной фракции НК, так и выделения или только ДНК (хромосомной, митохондриальной, плазмидной и др.), или только РНК (матричной, транспортной и т.д.). Методы основаны на различиях в свойствах выделяемых молекул. Например, в присутствии щелочи происходит гидролиз РНК, а ДНК остается стабильной. Основными этапами методов выделения НК являются лизис клеточных структур, очистка НК от примесей и концентрирование. Процедура лизиса может включать механическое разрушение (измельчение с помощью пестика, гомогенизатора, применение ультразвука и др.), воздействие температурой (кипячение, замораживание-оттаивание), химическими веществами (использование детергентов, хаотропных агентов, высоких концентраций солей и др.) и гидролитическими ферментами (лизоцим, трипсин, протеиназа К и др.). Очистка НК от примесей в большинстве случаев сопряжена с концентрированием. Используют различные физико-химические лабораторные методы: фильтрование, экстракция органическими растворителями (фенол, хлороформ и др.), преципитация спиртами или полиэтиленгликолем, центрифугирование, электрофорез, хроматография и др. Среди хроматографических методов наиболее часто применяют адсорбционную, аффинную, ионно-обменную, обращенно-фазную, гидрофобную хроматографии или гель фильтрацию. Для получения препаратов содержащих только ДНК или РНК применяют нуклеазы (РНКазы или ДНКазы) или системы, селективно связывающие нуклеиновые кислоты. Выбор наиболее подходящей методики выделения и очистки НК зависит от поставленных задач и основывается на следующих критериях: источник НК, вид нуклеиновой кислоты, количество и чистота конечного препарата НК. Ниже приведены краткие описания принципов наиболее распространенных физико-химических методов выделения и очистки НК. Детальное описание протоколов методик доступно в специализированной справочной литературе. Экстракция на основе температурного лизиса. Методика, позволяющая в кратчайшие сроки получить препарат НК. Принцип метода заключается в следующем: образец биоматериала инкубируется с лизирующим буфером при высокой температуре (порядка 90-95оС), в процессе чего происходит деструкция клеточных мембран, вирусных оболочек и других биополимерных комплексов и высвобождение нуклеиновой кислоты. При последующем центрифугировании нерастворимые компоненты осаждаются на дне пробирки, а супернатант (надосадочная жидкость) содержит НК. Применение данного метода достаточно ограничено, так как его недостатком является низкое качество выделенного препарата НК – загрязнение продуктами лизиса клеток (белками и липидами). Экстракция смесью фенола с хлороформом. Данный метод в различных вариациях применяется, когда требуется достичь высокой стандартизации в процедуре экстракции и получить высокоочищенные препараты НК из разных типов биологических объектов. Принцип метода основан на том, что НК является полярной молекулой и не растворяется в органических растворителях. Смесь фенола с хлороформом не смешивается с водой. При добавлении к лизату смеси фенола с хлороформом и интенсивном перемешивании, присутствующие в растворе белки денатурируют, а гидрофобные примеси (липиды, жиры и др.) растворяются хлороформом. Последующее центрифугирование приводит к разделению на водную (верхнюю) и органическую (нижнюю) фазы. НК находится в водной фазе, а денатурированные белки формируют кольцо на границе раздела фаз или растворяются в нижней фазе. Экстракция перхлоратом натрия. Применяется для удаления белковых примесей. Принцип метода основан на денатурации белков под действием высоких концентраций перхлората натрия. Последующий этап центрифугирования образца позволяет отделить денатурированные белки и другие нерастворимые примеси. Следует отметить, что буферный раствор перхлората натрия может использоваться на этапе лизиса клеточных структур. Преципитация (осаждение) НК спиртами. Применяется для концентрирования растворов НК и удаления большинства химических примесей. Принцип метода основан на том, что в присутствии спирта соли НК образуют агрегаты, которые осаждаются центрифугированием. Для осаждения используют следующие соли: аммония ацетат (AcNH4) в концентрации не менее 2.0M, лития хлорид (LiCl) – не менее 0.8M, натрия хлорид (NaCl) – не менее 0.2M или натрия ацетат (AcNa) – не менее 0.3M. Наибольшее распространение нашло использование этилового и изопропилового спиртов. Преципитация НК происходит при концентрации этилового спирта в препарате 70% и выше, а изопропилового спирта – 40% и выше. При низких концентрациях НК в образце дополнительно используют соосадители (тРНК, гликоген и др.). После центрифугирования, образовавшийся осадок дополнительно промывают 70% этанолом для удаления остатков солей. Следует отметить, что при осаждении НК спиртами происходит копреципитация белков, фосфатов, ЭДТА и других веществ. Для получения высокоочищенных препаратов НК, пригодных для проведения ферментативных реакций, применяют комбинацию физико-химических методов лизиса, экстракции и осаждения НК. Ниже приведен пример комбинированной методики выделения НК из биологических образцов, включающей лизис клеточных структур с использованием хаотропной соли (гуанидин тиоционата) и детергента (Triton X-100), экстракцией смесью фенола с хлороформом и осаждением НК спиртом. Комбинация данных методов позволяет получить степень очистки НК достаточную для проведения ферментативных реакций, таких как синтез комплементарной ДНК (обратная транскрипция) и полимеразная цепная реакция (ПЦР). Необходимое оборудование Микропипетки с переменным объемом 20-200 мкл и 200-1000 мкл, одноразовые наконечники к ним. Микроцентрифуга. Ламинарный шкаф. Термостат с функцией нагрева до 37оС. Аспиратор с колбой приемником. Настольное устройство для перемешивания образцов типа «вортекс». Стерильные полипропиленовые пробирки для микроцентрифуги (V=1,5 мл) и штатив для них. Перманентный маркер по стеклу. Одноразовые перчатки из латекса или сходного материала. Необходимые реактивы Лизирующий буфер следующего состава: 4М гуанидин тиоционат, 25 мМ цитрат натрия, 0,5% Triton X-100. Ацетат натрия 3М, рН5,2. Смесь насыщенного водой фенола с хлороформом в соотношении 1:1. Изопропиловый спирт (изопропанол). Этиловый спирт в концентрации 70%. Дважды дистиллированная вода, свободная от нуклеаз. Ход работы В штатив расставляют микроцентрифужные пробирки в количестве равном количеству исследуемых образцов, и маркируют их. Используя микропипетку с индивидуальным для каждого реактива наконечником, в пробирку вносят по 200 мкл лизирующего буфера, 50 мкл 3 М ацетата натрия, 400 мкл смеси фенола с хлороформом. Используя индивидуальный наконечник, добавляют 200 мкл исследуемого образца и закрывают пробирки крышкой. Содержимое пробирок, перемешивают с использованием аппарата «вортекс» в течение 5 сек. Пробирки помещают в микроцентрифугу, соблюдая принцип равновесия. Проводят центрифугирование при скорости 14,5-16 тыс. об/мин в течение 10 мин. За время центрифугирования в штатив расставляют микроцентрифужные пробирки в количестве равном количеству исследуемых образцов и маркируют их. В каждую пробирку вносят по 200 мкл изопропанола. После окончания центрифугирования, используя для каждого образца индивидуальный наконечник, переносят 200 мкл водной (верхней) фазы исследуемого образца в пробирку, содержащую изопропанол. Закрывают пробирки крышкой. Содержимое пробирок, перемешивают с использованием аппарата «вортекс» в течение 5 сек. Пробирки помещают в микроцентрифугу, соблюдая принцип равновесия. Проводят центрифугирование при скорости 14,5-16 тыс. об/мин в течение 15 мин. После окончания центрифугирования, из пробирок удаляют надосадочную жидкость (не захватывая осадок), используя аспиратор с индивидуальным для каждого образца наконечником. В пробирку вносят 800 мкл 70% этанола, закрывают крышку и аккуратно переворачивают пробирку 2-3 раза. Пробирки помещают в микроцентрифугу, соблюдая принцип равновесия. Проводят центрифугирование при скорости 14,5-16 тыс. об/мин в течение 5 мин. После окончания центрифугирования, из пробирок удаляют надосадочную жидкость (не захватывая осадок), используя аспиратор с индивидуальным для каждого образца наконечником. Подсушивают осадок в термостате при температуре 37оС с открытой крышкой до исчезновения запаха спирта (10-15 мин). В пробирки вносят по 20 мкл воды свободной от нуклеаз и закрывают крышки. Содержимое пробирок перемешивают с использованием аппарата «вортекс» в течение 5 сек. Пробирки помещают в микроцентрифугу, соблюдая принцип равновесия. Проводят центрифугирование при скорости 14,5-16 тыс. об/мин в течение 15 сек. Полученные образцы НК используют для проведения ферментативных реакций. При необходимости образцы НК хранят при температуре не выше минус 16ºС в течение 1 месяца или при температуре не выше минус 68ºС в течение года. Сорбционная экстракция. Метод получил широкое распространение в молекулярно-генетической диагностике, как для научных исследований, так и в медицинской практике для выявления возбудителей инфекций, из-за простоты применения. В основе сорбционной экстракции лежит избирательная сорбция НК в присутствии хаотропной соли на носитель, содержащий кремний. В качестве носителя используются суспензии тонкоизмельченных стеклянных порошков, диатомовые земли, диоксид кремния, стеклянные волокна. В качестве компонентов хаотропного буфера используют йодид натрия, перхлорат натрия, гуанидин тиоционат и др. Следует отметить, что многие из используемых хаотропных солей так же осуществляют лизис клеточных компонентов. После аффинной сорбции НК на поверхности носителя, ингибиторы ферментативных реакций, другие примеси и компоненты биологического материала остаются в растворе. Носитель, связавший НК, осаждается с помощью центрифугирования, а надосадочная жидкость удаляется. Серия последующих отмывок обеспечивает получение высокоочищенного препарата. Модификацией данного метода является использование кремниевых носителей с магнитными свойствами, которые достигаются добавлением в их состав оксида железа, что позволяет отказаться от этапа центрифугирования. При выделении носитель задерживается на дне пробирки при помощи обычного магнита, а надосадочная жидкость удаляется. Использование магнитных частиц позволяет автоматизировать процесс выделения НК. В настоящее время на рынке представлен широкий спектр коммерческих наборов, содержащих готовые реагенты, а так же роботизированные станции для выделения и очистки НК. 1.2. Определение концентрации нуклеиновых кислот Измерение концентрации нуклеиновых кислот является рутинной практикой во многих молекулярно-биологических лабораториях. Определение концентрации и качества препарата нуклеиновых кислот – один из ключевых начальных шагов в экспериментах, включающих ПЦР, секвенирование и др. Для оценки качества и концентрации нуклеиновых кислот в лабораторной практике используют качественные и количественные методы. Качественный метод оценки концентрации нуклеиновых кислот основан на проведении электрофоретического разделения в агарозном геле препарата нуклеиновой кислоты и контрольного образца с известной концентрацией (например, коммерческий маркер размерности ДНК). При этом для более точного определения количества нуклеиновой кислоты используют стандартное разведение контрольного образца. После проведения электрофореза концентрацию препарата нуклеиновой кислоты оценивают по яркости свечения полосы в ультрафиолетовом свете по сравнению с флуоресценцией контрольного образца с использованием специализированного программного обеспечения. Количественный (спектрофотометрический) метод оценки концентрации нуклеиновых кислот основан на их способности поглощать ультрафиолетовый свет при определенной длине волны. Белки и нуклеиновые кислоты поглощают свет в ультрафиолетовом спектре в пределах длин волн между 210 и 300 нм. Максимум поглощения растворов ДНК и РНК при 260 нм, а для белковых растворов – при 280 нм. Для оценки качества (содержания примесей) препарата нуклеиновых кислот используют отношение А260/А280, которое для чистого препарата ДНК приблизительно равно 1,8, а для РНК – примерно 2,0. Важно отметить тот факт, что примеси РНК в растворе ДНК не могут быть выявлены методом спектрофотометрии. Спектрофотометр использует прохождение света через раствор для определения концентрации растворенного в растворе вещества. Прибор работает на основе простого принципа, по которому свет с известной длиной волны проходит через образец, и количество пропущенной энергии света измеряется в фотоэлементе. Существует линейная зависимость между поглощением «А» (так же называемой оптической плотностью, OD) и концентрацией макромолекул, которая описывается формулой (1): А=OD= εlc (1) ε – коэффициент молярной экстинкции, c – концентрация, l – длина пути прохождения света Современные спектрофотометры рассчитывают концентрацию нуклеиновых кислот автоматически с использованием специального программного обеспечения. В настоящее время существуют как обычные кюветные, так и спектрофотометры для микрообъёмов, позволяющие проводить измерения в объёмах 0,5-2,0 мкл. При этом измерение производится непосредственно в капле жидкости, которую наносят на неподвижный модуль прибора. Сверху на каплю опускают подвижный модуль прибора, в результате чего из образца формируется столбик жидкости между подвижным и неподвижным модулями. Прибор измеряет поглощение света в столбике образца. Правила работы со спектрофотометром При проведении процедуры измерения концентрации препарата нуклеиновой кислоты необходимо четко соблюдать инструкцию к прибору. Кюветы и неподвижный модуль прибора следует держать в чистоте. После измерения необходимо тщательно вымыть кюветы в дистиллированной воде, ополоснуть в бидистилляте и высушить на воздухе положив кювету вверх дном на фильтровальную бумагу. У спектрофотометра для микрообъёмов протереть неподвижный модуль смоченной в бидистиллированной воде салфеткой и вытереть насухо. 1.3. Гибридизация нуклеиновых кислот Гибридизация (отжиг) нуклеиновых кислот – объединение одноцепочечных молекул нуклеиновых кислот в двуцепочечные структуры (дуплексы), по принципу комплементарности. Гибридизация может происходить с образованием дуплексов, между молекулами ДНК, РНК или ДНК и РНК. Гибридизация происходит, как при полной, так и при частичной комлементарности двух цепей НК. Образование дуплекса зависит от протяженности и степени комплементарности цепей НК, температуры и ионного состава раствора. Для описания дуплекса используют температуру его плавления (Tm). Температура плавления ДНК – это температура, при которой цепи ДНК диссоциированы наполовину. Приблизительно, Tm высчитывают исходя из первичной структуры НК. Например, для коротких олигонуклеотидов применима простая формула (2): Tm = 2(L+NC+NG) (2) L – общее количество нуклеотидов в последовательности (длина олигонуклеотида), NC – количество цитозинов, NG – количество гуанинов Существуют более сложные формулы, которые учитывают состав раствора, в котором проводится гибридизация. Однако ни одна формула не учитывает всех особенностей реакции, поэтому точное значение Tm определяют экспериментальным путем. Определение Tm имеет ключевое значение при подборе олигонуклеотидов используемых в качестве праймеров или зондов в молекулярно-биологических исследованиях. Определение Tm так же позволяет определять несовпадения (mismatch) оснований внутри дуплекса, приводящих к уменьшению его стабильности, что используется при исследованиях генетической неоднородности между видами или отдельными представителями вида. Сравнение Tm между образцами позволяет детектировать присутствие несовпадений в нуклеотидных последовательностях. В настоящее время широкое распространение получил метод точного определения Tm с использованием интеркалирующего флуоресцентного красителя, специфичного к дуплексам нуклеиновых кислот (SYBR Green), и прибора – программируемого термостата с регистрацией флуоресценции в реальном времени. Метод состоит в том, что готовят смесь двуцепочной НК и флуоресцентного красителя для каждого образца. С помощью прибора снимают кривые флуоресценции и анализируют их. Обнаружение различий в значении Tm позволяет сделать заключение о несовпадении нуклеотидных последовательностей (рис. 1). Методы, основанные на гибридизации нуклеиновых кислот, широко применяют в научных исследованиях и молекулярной диагностике заболеваний. К ним относят различные модификации блоттинга (от англ. blot: Southern, northern, western, southwestern, eastern и dot blot) – в которых нуклеиновые кислоты переносят из геля или прямо из раствора на связывающую мембрану. Далее проводят гибридизацию с содержащим метку зондом и регистрируют результаты реакции. На гибридизации основаны методы детекции нуклеиновых кислот с использованием микрочипов (microarray), в которых на твердой подложке закрепляют большое количество специфичных олигонуклеотидных зондов. Всю нуклеиновую кислоту, содержащуюся в образце, метят и гибридизуют с зондами чипа. После отмывки не связавшихся компонентов регистрируют результаты реакции. Гибридизация часто используется в цитогенетике для детекции нуклеиновых кислот в фиксированных препаратах единичных клеток (FISH – fluorescence in situ hybridization) или срезах тканей (TISH – tissue in situ hybridization). 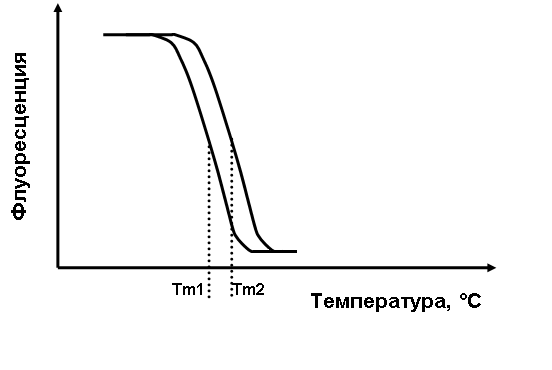 Рис. 1. Схема сравнения Tm дуплексов НК по кривым плавления С развитием техники молекулярного клонирования генов и методов синтеза олигонуклеотидов практически любая нуклеотидная последовательность может быть получена в большом количестве для создания диагностических зондов. В качестве меток нуклеиновых кислот используют радиоактивные изотопы, флуоресцентные красители и метки с непрямой детекцией, например биотин или дигоксигенин. |
