|
|
Лекции. 1 Выделение нуклеиновых кислот
1.4. Полимеразная цепная реакция (ПЦР)
1.4.1. Основы полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе). Метод ПЦР широко используется во всех областях биологии и медицины: молекулярной диагностике (детекции микроорганизмов и вирусов, анализе экспрессии генов, выявлении индивидуальных генетических особенностей), а также в молекулярном клонировании, секвенировании и в других молекулярно-генетических исследованиях.
В начале 1970-х годов Хьелль Клеппе предложил способ амплификации ДНК с помощью пары коротких одноцепочечных молекул ДНК — праймеров. Однако в то время эта идея осталась нереализованной. ПЦР была изобретена в 1983 году Кэри Муллисом, а в 1993 году получена Нобелевская премия. Метод позволял амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента – ДНК зависимой ДНК-полимеразы. В 1980 году Городецкий и др. выделили из термостабильных бактерий Thermus aquaticus ДНК полимеразу, названную Taq. В 1986 с использованием Taq-полимеразы было предложено проводить ПЦР.
ПЦР – это многократное повторение денатурации ДНК, отжига праймеров (затравок) и праймированного синтеза комплементарной цепи ДНК в условиях invitro. Метод основан на способности термостабильных ДНК-полимераз выдерживать без ощутимой потери активности высокие температуры, необходимые для денатурации ДНК. ДНК-полимераза катализирует синтез длинных полинуклеотидных цепей из мономеров – дезоксинуклеозидтрифосфатов (дНTФ), используя одну из цепей ДНК в качестве матрицы для построения комплементарной цепи. Для начала синтеза новой цепи ферменту необходимы праймеры – синтетические олигонуклеотиды длиной 15-30 оснований, которые ограничивают синтезируемый фрагмент. Для синтеза одного фрагмента используют два олигонуклеотидных праймера – прямой и обратный, которые гибридизуются с противоположными цепями ДНК и ограничивают участок синтезируемой нуклеотидной последовательности. Работа полимеразы заключается в удлинении строящейся цепи путем добавления нуклеотидов, комплементарных последовательности матричной ДНК. Таким образом, в одном температурном цикле вновь синтезируется два новых фрагмента ДНК, а за 25-35 циклов в пробирке накапливаются миллиарды копий участка ДНК, ограниченного праймерами. Структура отдельного цикла ПЦР представлена на рисунке 2.
Серия таких циклов позволяет получить экспоненциальное накопление фрагмента ДНК. В идеальном случае, наработка специфического фрагмента подчиняется закону 2n, где n – число циклов, а 2 – количество исходной двуцепочечной ДНК. После проведения 25-30 циклов происходит увеличение фрагмента в 106-108 раз.
В техническом исполнении, ПЦР требует большого внимания, аккуратности и определенных навыков работы по дозированию микрообъемов. Готовят реакционную смесь, в состав которой входят: буферный раствор определенного состава, праймеры, смесь дНТФ, термостабильная ДНК-полимераза и образец ДНК. Для предотвращения испарения реакционной смеси, добавляют небольшое количество минерального масла. Пробирку с полученным раствором помещают в программируемый термостат (ДНК-амплификатор) и выбирают необходимую программу циклической смены температуры и длительности каждого шага реакции. Общий объем реакционной смеси обычно составляет от 10 до 100 мкл. Выбор оптимального режима работы определяется длиной амплифицируемого участка ДНК, характеристиками олигонуклеотидных праймеров и свойствами используемой ДНК-полимеразы. К недостатку данного метода, относят высокую вероятность перекрестного загрязнения (контаминации) между исследуемыми образцами, что приводит к ложноположительным результатам.
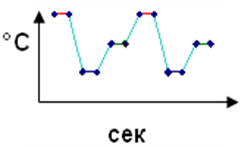
94оС
Денатурация
 Отжиг 60оС 30 циклов = 108 копий ДНК Отжиг 60оС 30 циклов = 108 копий ДНК
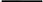 Исходная ДНК Исходная ДНК
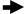 Элонгация 72оС Праймеры Элонгация 72оС Праймеры
 Синтезированная ДНК Синтезированная ДНК
Рис. 2. Структура отдельного цикла ПЦР
Денатурация ДНК. На первом этапе проведения ПЦР исследуемая двунитевая ДНК переводится в однонитевую форму путем денатурации (плавления, расхождение цепей ДНК) при температуре 92-95С от 10 секунд до 15 минут. Отжиг праймеров. В молекулярной биологии гибридизацию праймеров на специфическом участке ДНК называют “отжигом”. Гибридизация (отжиг) достигается понижением температуры реакционной смеси до 40-60С. При этом происходит образование двунитевого участка в той области, где праймеры комплементарны участку последовательности ДНК. Элонгация (удлинение или развитие) цепи, включает синтез новой цепи ДНК начиная с 3 концевого нуклеотида праймера в направлении 5→3. При этом оптимальная температура работы термостабильной ДНК-полимеразы составляет 60-72С, а время зависит от длины синтезируемого фрагмента
Для предотвращения контаминации соблюдают ряд требований:
Этапы очистки нуклеиновых кислот, приготовления реакционных смесей и анализа результатов реакции проводят в отдельных помещениях, с использованием отдельных комплектов автоматических дозаторов.
Используют одноразовые микропробирки и наконечники, желательно с аэрозольными фильтрами, не содержащие нуклеаз.
Все этапы проводят в новых одноразовых перчатках.
В каждый эксперимент включают отрицательный и положительный контроли.
1.4.2. Компоненты реакционной смеси ПЦР
ДНК (кДНК). Для проведения специфической амплификации не требуется больших количеств ДНК и, в принципе, достаточно даже одной молекулы. Источником ДНК может служить любой биологический материал. В медицинской практике наряду с препаратами цельной крови, используют высушенные на фильтровальной бумаге пятна крови, небольшие кусочки тканей, смывы полости рта, других слизистых поверхностей и т.д. ДНК должна быть хорошо очищена от белков, липидов и растворена в воде или низкосолевом буфере (рН 7.5 – 8.5). Количество ДНК (кДНК) для проведения ПЦР обычно составляет 0,1–100 пг ДНК в зависимости от длины фрагмента. Для амплификации уникальных последовательностей на сложных матрицах (геномная ДНК, первая цепь кДНК) требуется 10–200 нг ДНК, при этом ДНК рекомендуют прогреть при 65°С в течение 2 минут и хорошо перемешать перед добавлением в реакцию.
Праймеры. Специфичность метода достигается за счет использования искусственно синтезированных олигонуклеотидных праймеров длиной от 8 до 1000 оснований, (оптимально 20–30 оснований), комплементарных уникальным участкам нуклеотидной последовательности исследуемой ДНК. Выбор уникального участка осуществляют при сравнительном анализе нуклеотидной последовательности исследуемой ДНК с гомологичными последовательностями. Расстояние между выбранными уникальными участками нуклеотидной последовательности определяет длину синтезируемой молекулы. Определение размера синтезируемой молекулы ДНК в последующем используют для подтверждения специфичности метода. Учитывают температуру плавления (Tm) обоих праймеров, которая должна быть сходной. Для олигонуклеотидов размером 15-30 оснований, Tm рассчитывают по формуле (3):
Tm (ºС) = 2(A+T) + 4(G+C) (3)
А+Т общее количество оснований аденина (A) и тимина (Т) в олигонуклеотиде; G+C общее количество оснований гуанина (G) и цитозина (С) в олигонуклеотиде
Данная формула дает приблизительное значение Tm (ºС), с погрешностью около 5ºС. Точное значение подбирается эмпирически. Предпочтительная температура плавления праймеров 55–65ºС, а содержание G+C оснований – около 50%. Для праймеров с низким содержанием G+C используют более длинные последовательности, чтобы повысить температуру плавления. В реакцию добавляют обычно 20–500 нМ каждого праймера. Слишком низкая концентрация праймеров может снижать эффективность амплификации, а высокая - приводить к неспецифической амплификации.
Смесь дНTФ – дезоксинуклеотидтрифосфаты используются для достройки растущей цепи ДНК полимеразой. дНТФ обычно используют в концентрации 20 – 400 мкM. Следует помнить, что избыток дНТФ приводит к возникновению ошибок при синтезе новой цепи, а недостаток снижает эффективность ПЦР. Чистота препарата дНТФ имеет критическое значение для эффективности ПЦР.
Реакционный буфер – создает оптимальные условия для работы термостабильной ДНК-полимеразы. В состав буфера в классическом варианте входят: компоненты, создающие буферную емкость раствора (Tris HCl, tricine и др. рН
8,7); компоненты, формирующие ионную силу раствора – чаще других используют соли KCl или NH3SO4 (повышают активность полимеразы на 40–60%); неионные детергенты, например Tween 20 или Тритон Х-100 (предотвращают адсорбцию ДНК-полимеразы на поверхности пробирки); ион Mg2+ – является кофактором ДНК полимеразы и образует комплексы с дНТФ. Концентрация Mg2+ влияет на специфичность и эффективность ПЦР. Повышение концентрации Mg2+ увеличивает эффективность ПЦР, но снижает специфичность. Оптимальная концентрация этого иона подбирается эмпирически (обычно в диапазоне 1 – 3 мМ) и во многом зависит от первичной структуры исследуемой ДНК и олигонуклеотидных праймеров.
Термостабильные ДНК полимеразы – белки, по молекулярной массе приближающиеся к 90 – 95 кДа, температурный оптимум работы которых составляет 72 – 84°С. Обнаружены в термофильных бактериях. Первая термостабильная ДНК-полимераза была обнаружена и выделена из штамма бактерии Thermus aquaticus YTl (Taq ДНК-полимераза), обитающей в гейзерах (7). Использование рекомбинантного белка позволило упростить и автоматизировать проведение ПЦР. В настоящее время в молекулярной диагностике используется множество модификаций Taq ДНК-полимеразы, полученных с использованием генной инженерии. В экспериментах по молекулярному клонированию использование Taq ДНК-полимеразы имеет ограничение. Недостатком Taq ДНК-полимеразы является высокая вероятность внесения ошибочного нуклеотида в растущую цепь ДНК. Это связано с отсутствием 3'→5' экзонуклеазной активности, которая позволяет удалять ошибочный нуклеотид. Такой активностью обладают ДНК полимеразы Pfu, Vent и др. Их использование значительно уменьшает число ошибочных нуклеотидов в растущей цепи ДНК, однако они более требовательны к условиям реакции. При амплификации фрагментов ДНК с целью молекулярного клонирования, применяют смеси Taq и Pfu ДНК полимераз, чтобы добиться одновременно высокой скорости и точности копирования.
Вода является компонентом всех реакционных смесей. От степени ее чистоты зависит эффективность реакции. В ПЦР используют дважды дистиллированную воду свободную от нуклеаз.
Дополнительные компоненты ПЦР. В реакционную смесь часто вносят дополнительные компоненты, повышающие или понижающие эффективность отдельных стадий реакции. Для повышения эффективности гибридизации ДНК (РНК) и праймера используют тетраметиламмонийхлорид (ТМАК), при этом ингибирование ДНК-полимеразы не наблюдается. Амплификацию GC-богатых матриц рекомендуется проводить с добавлением диметилсульфоксида (ДМСО) или формамида в концентрации 3–5%, при этом снижают температуру отжига праймеров на 2–3ºС. Добавление ДМСО или формамида приводит к снижению эффективности спаривания молекул праймера и ДНК тем самым, уменьшая количество не специфических спариваний.
1.4.3. Модификации ПЦР
Обратная транскрипция - ПЦР (ReversetranscriptionPCR) –применяется для исследования РНК. ПЦР способна проходить только на матрице ДНК. Для исследования РНК перед ПЦР проводят реакцию обратной транскипции (ОТ), которая представляет собой метод синтеза коплементарной ДНК (кДНК) на матрице РНК. В ходе ОТ-ПЦР одноцепочечная молекула РНК превращается в комплементарную одноцепочечную ДНК, которую затем амплифицируют, используя традиционную ПЦР. Такой синтез возможен с участием фермента РНК-зависимой ДНК-полимеразы, которую также называют обратной транскриптазой или ревертазой. Ревертаза кодируется геномами некоторых РНК-содержащих вирусов и подвижных генетических элементов генома высших организмов. Наиболее часто для ОТ-ПЦР используют ревертазу вируса мышиного лейкоза Молони (M-MLV от англ. Moloney Murine Leukemia Virus) или вируса птичьего миелобластоза (AMV от англ. Avian myeloblastosis virus). Ниже приведен пример проведения реакции обратной транскрипции с использованием M-MLV ревертазы: Смешивают 4,5 мкл очищенной РНК с 0,5 мкл (0,2 мкМ) праймера. РНК денатурируют в амплификаторе при 70С в течение 2 мин и охлаждают до комнатной температуры. В пробирку вносят 5 мкл реакционной смеси содержащей: 2 мкл х 5 буферного раствора для M-MuLV, 0,5 мкл 8 мМ dNTP, 0,2 мкл (40 единиц активности) ревертазы M-MuLV. Полученную смесь инкубируют 30 минут при 42С. Реакцию останавливают нагреванием при 94С в течение 5 минут.
ПЦР в два раунда используется для детекции нуклеиновых кислот в следовых количествах (1–100 копий на пробу). Этот вариант ПЦР также получил название «гнездовая» ПЦР (от англ. nested PCR), из-за расположения праймеров, которые формируют на схематическом рисунке структуру похожую на гнездо (рис. 3). Праймеры подбираются таким образом, чтобы места их гибридизации во втором раундеПЦР находились внутри участка ДНК, ограниченного праймерами для первого раундаПЦР. При таком проведении ПЦР ДНК, синтезируемая в первом раунде, служит матрицей для второго раунда реакции. ПЦР в два раунда позволяет добиться повышения чувствительности реакции, за счет увеличения числа циклов ПЦР, и повышения специфичности, за счет использования комбинации из четырех праймеров. Следует отметить, что при использовании ПЦР в два раунда повышается вероятность контаминации между исследуемыми образцами.
                               ДНК ДНК
  
 
F1 R1
F2 R2
Рис. 3. Схема расположения праймеров (F1, F2, R1,R2) на ДНК мишени при проведении ПЦР в два раунда («гнездовой ПЦР»)
ПЦР с горячим стартом (“Hot start “PCR) - применяется для уменьшения неспецифического отжига праймеров в ходе приготовления реакционной смеси при комнатной температуре. В классическом варианте ПЦР с горячим стартом один из критических для реакции компонентов добавляют к реакционной смеси при температуре 80°С. Описаны методы, в которых между компонентами создают механическую преграду (например, восковую). После нагревания преграда расплавляется и компоненты смешиваются. Альтернативным подходом является использование химически модифицированных ДНК полимераз или полимераз связанных с моноклональными антителами. Прогрев реакционной смеси, содержащий такие ДНК полимеразы, при повышенной температуре приводит к их активации.
ПЦР с плавным снижением температуры отжига праймеров (“Touch down” PCR)– применяется для повышения специфичности реакции. В первых циклах ПЦР температура отжига праймеров превышает расчетную, что снижает вероятность неспецифического отжига праймеров. Последовательное снижение температуры отжига праймеров в каждом цикле приводит к увеличению доли специфического фрагмента ПЦР.
Протяженный ПЦР (“Long” PCR)– применяется для амплификации протяженных участков ДНК (от 5 до 15–20 тыс. п.о.). Обычно используют смесь ДНК-полимераз, например смесь Taq и Pfu полимераз в соотношении 10:1. Также существенно увеличивается время элонгации.
ПЦР в ткани (“In situ” PCR) – проводится в образцах тканей фиксированных на предметном стекле. Позволяет изучать процессы внутриклеточного размножения и развития вирусов, экспрессии генов в различных клетках ткани. Регистрация результатов реакции обычно проводится методом гибридизации с использованием флуоресцентных меток.
ПЦР в одной клетке (“Singl-cell” PCR) – это ПЦР, в которой в качестве матрицы используется нуклеиновая кислота, полученная из одной клетки.Применяется в экспериментах по генетике человека и животных, в перинатальной диагностике.
Множественная ПЦР (multiplex PCR) – это ПЦР, в которой одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к одновременной амплификации нескольких фрагментов ДНК. Такая реакция позволяет экономить время и реактивы. В молекулярной диагностике наиболее часто применяется для проведения ПЦР с внутренним положительным контролем. Широко используется для экспресс-идентификации инфекционных агентов или для исследования состояния нескольких аллельных генов у эукариотических организмов.
|
|
|
 Скачать 231.21 Kb.
Скачать 231.21 Kb.

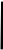

 Исходная ДНК
Исходная ДНК
 Синтезированная ДНК
Синтезированная ДНК




