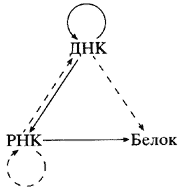
Шапероны и прионы. 1. Заякоривание белков в мембранах Белки, синтезируемые в шероховатом эндоплазматическом ретикулуме (шэр) и несущие стоптранспортсигнал
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
Те же функции выполняет и дисульфидизомераза белков, осуществляя образование дисульфидных связей в секретируемых белках после их переноса через мембраны эукариотических клеток. Лимитирующей стадией в образовании правильной третичной структуры полипептидных цепей является цис-транс-изомеризация остатков пролина в полипептидных цепях. Этот процесс в клетках эукариот осуществляется с участием пролил-цис-транс-изомеразы. В процессе трансляции растущие полипептидные цепи приобретают высокоспецифическую пространственную структуру, которая формируется полностью после завершения биосинтеза. Процесс сворачивания полипептидной цепи в пространственную структуру получил название фолдинга. В результате фолдинга в водных растворах у водорастворимого полипептида уменьшается свободная энергия, гидрофобные остатки аминокислот упаковываются преимущественно внутрь молекулы, а гидрофильные остатки располагаются на поверхности белковой глобулы. Гидрофобные области образуются и на внешней поверхности молекул белков, формируя полости активных центров и места контактов субъединиц мультимерных белков друг с другом и биологическими мембранами. Увеличение гидрофобности поверхности белков снижает их внутриклеточную стабильность, так как множество протеолитических ферментов гидролизуют с большой скоростью пептидные связи, образуемые гидрофобными аминокислотами или находящиеся вблизи от них. Опасность протеолитической деградации для растущей полипептидной цепи возникает после ее появления на поверхности транслирующей рибосомы. Установлено, что около 1/3 синтезированных полипептидных цепей претерпевает протеолитический распад сразу после завершения их синтеза рибосомами. Большинство вновь синтезированных белков не распадается благодаря образованию комплекса NAC (nascent polypeptide associated complex) , ассоциированного с растущими полипептидными цепями. Имеется группа белков с молекулярными массами 21-33 кДа, которые взаимодействуют как с такой цепью, так и с самой рибосомой, предохраняя растущий полипептид от деградации путем формирования NAC. Когда же гидрофобная сигнальная последовательность аминокислотных остатков синтезируемого белка достигает длины примерно в 70 аминокислотных остатков и покидает NAC, с ней взаимодействует комплекс белков SRP (signal recognition particle), который не только предохраняет гидрофобную часть растущего полипептида от ранней деградации протеиназами, но и направляет ее к месту назначения - к мембранам эндоплазматического ретикулума. Растущие полипептидные цепи, у которых отсутствует сигнальная последовательность аминокислотных остатков, покидая NAC, взаимодействуют с обеспечивающей фолдинг системой, в состав которой входят шапероны Hsp70 и Hsp40 . 6. Шапероны в лечении заболеваний Американские ученые нашли вещество, которое может стать лекарством в лечении Паркинсона. Это белки, которые известны как шапероны. Хотя большая часть исследования была выполнена ими на насекомых, ученые полагают, что подобные защитные механизмы существуют и у человека. Если защитный эффект белка Hsp-70 и других шаперонов будет доказан на млекопитающих, это открытие может лечь в основу создания лекарств от неизлечимых сегодня болезней. Рисунок 5. Участие шаперонов (HSP) в системе клеточного иммунитета. 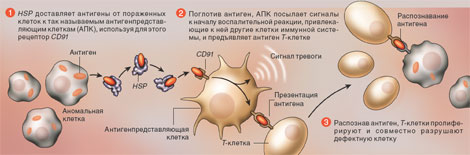 Помимо выше названных функций, шапероны выполняют по крайней мере еще две: влияют на канцерогенез и активируют иммунную систему, что делает их потенциальными мишенями для лекарственных средств ( рис.5). Б. Прионы Классификация, размножение, свойства молекул приона и молекулярные основы патогенеза прионных инфекций. Прио́ны (от англ. proteinaceousinfectiousparticles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»). Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои. Текущая версия (не проверялась)  Рис.1 Белок, образующий β-амилоиды - предшественник прионов
1. История Во второй половине XX века врачи столкнулись с необычным заболеванием человека — постепенно прогрессирующим разрушением головного мозга, происходящим в результате гибели нервных клеток. Это заболевание получило название губчатой энцефалопатии. Похожие симптомы были известны давно, но наблюдались они не у человека, а у животных (скрейпи овец), и долгое время между ними не находили достаточной обоснованной связи. Новый интерес к их изучению возник в 1996 г., когда в Великобритании появилась новая форма заболевания, обозначаемая как «новый вариант болезни Крейтцфельдта-Якоба (nvCJD)». Важным событием было распространение «Коровьего бешенства» в Великобритании, эпидемия которого была сначала в 1992—1993 гг, а потом и в 2001 г охватила несколько европейских государств, но тем не менее мясо было экспортировано во многие страны. Заболевание связывают с использованием «прионизированной» костной муки в кормах и премиксах, изготовленной из туш павших или заболевших животных, возможно, и не имевших явных признаков заболевания. Пути переноса причинного фактора болезни, механизмы проникновения прионов в организм и патогенез заболевания изучены пока недостаточно. 2.Классификация
3. Свойства молекул приона Прионовые белки млекопитающих не сходны с прионовыми белками дрожжей по аминокислотной последовательности. Несмотря на это, основные структурные особенности (формирование амилоидных волокон и высокая специфичность, препятствующая передаче прионов от одного вида организмов к другому) у них общие. Вместе с тем, прион, отвечающий за коровье бешенство, обладает способностью передаваться от вида к виду. Правый рисунок — модель двух конформаций приона; слева известная, нормальная, конформация структуры терминального участка C-terminal PrPC. (для отображения/загрузки см. RCSB Protein Databank). В белке РгРSc обнаруживается существенно больше так называемых -слоев - около 43% (в РгРC -3%)-и несколько уменьшается количество (43-34%) так называемых -спиралей. При этом инфекционный белок, образующий уже упомянутые амилоидные тяжи, оказывается более кислотоустойчивым, термоустойчивым и более устойчивым к протеолизу, нежели его клеточный гомолог РгРC. Оказалось, что инфекционный белок возникает путем модификации своей структуры из обычного клеточного белка и при этом приобретает свойство инфекционности. 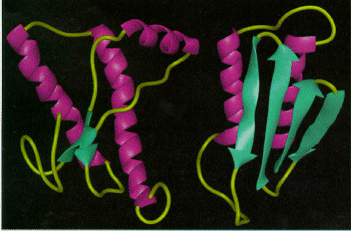 Рис.2 Трехмерные структуры С-концевых участков белков PrPC (слева) и PrPSc. Фиолетовым цветом окрашены альфа-спирали, зелёным — бета тяжи. N-концевой участок белка релаксирован и не поддаётся рентгеноструктурному анализу. На короткий период конца 70-х - начала 80-х годов возникла гипотеза белковой наследственности, то есть наследственности без ДНК, коль скоро инфекционный агент - белок, а он к тому же еще и накапливается в зараженном организме, то есть воспроизводится. Эта сенсация просуществовала недолго, так как вскоре был открыт ген, который кодирует первичную структуру, то есть аминокислотную последовательность белка-приона и его клеточного предшественника. Ген оказался очень консервативным, то есть очень похожим у всех млекопитающих . Функция его до сих пор точно неизвестна. Зато известно, что он необходим для развития заболевания. Мыши, лишенные этого гена, вполне жизнеспособны и практически здоровы, но не заболевают, если их инфицировать белком-прионом.
Особый интерес представляет начальный конец гена и соответственно так называемый N-терминальный конец белка. Здесь закодированы пять повторов из восьми аминокислот. Уменьшение числа повторов на один не сопровождается патологическими последствиями, в то время как увеличение числа повторов (известны варианты вплоть до 12 повторов) приводит к одной из наследственных форм заболевания. Следовательно, эти повторы играют существенную роль в организации структуры белка и каким-то образом влияют на возможность его превращения в инфекционную форму. Итак, наследственные варианты заболевания - результат мутационного изменения первичной структуры белка, облегчающего превращение его в прион и далее - превращение всех вновь синтезируемых полипептидов в прионную, патогенную и инфекционную форму. Спорадическая форма заболевания - спонтанное изменение характера укладки полипептидной цепи, превращающее клеточный белок в прион, а далее - опять же превращение всех вновь синтезируемых полипептидов в прионную, то есть инфекционную и патогенную, форму. Здесь очень важно отметить, что при одной и той же первичной структуре, то есть одной и той же аминокислотной последовательности, без всяких изменений кодирующего гена может возникнуть несколько вариантов укладки приона, и эти различающиеся варианты укладки воспроизводятся при последующей инфекции. Они получили название штаммов или правильнее - клонов приона. И, наконец, инфекционная форма прионных заболеваний - результат проникновения в организм, в клетку млекопитающих инфекционного белка, возникшего любым из двух упомянутых способов. В стандартные концепции легко укладывается возникновение наследственных форм заболевания. Можно представить, что одна первичная структура служит основой для разных способов пространственной укладки белковой молекулы. Чего мы не понимаем - как одна форма укладки сменяет другую и как далее эта укладка воспроизводится. То, что это явление (воспроизведение пространственной структуры, или конформации) имеет место, доказывают изящные эксперименты с так называемыми трансгенными мышами, у которых собственный ген PRNP заменен на гомологичный ген человека (рис. 4). 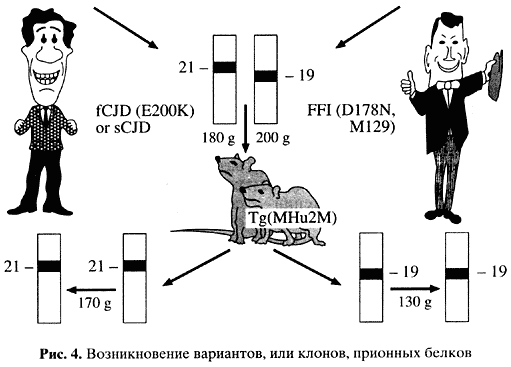 Можно взять прион от людей, погибших от разных вариантов прионных заболеваний. Такие белки различаются по физико-химическим свойствам, выявляемым в электрофорезе, то есть по подвижности в электрическом поле после их частичного разрушения при помощи протеолиза. Если этими различающимися формами белка человека заразить такую мышь, то она рано или поздно заболеет (инкубационный период - около 150 дней) и можно выделить белок-прион с исходными характеристиками инфекционного начала. Таким образом, в результате модификации пространственной структуры белка могут появляться штаммы, или клоны, прионов. Механизм этого явления остается загадкой. Что это за белки? Чтобы ответить на этот вопрос, вернемся к таблице генетического кода. 61 кодон, или триплет, этой таблицы узнают специальные транспортные РНК (тРНК), и только три оставшихся кодона - знаки терминации, или стоп-сигналы, узнают специальные белки. Это было известно у бактерий, а в последние годы сходные белки обнаружены и у эукариот млекопитающих, лягушек и дрожжей. Было высказано предположение, что эти гены дрожжей (SUP35 и SUP45) кодируют именно белки, вовлеченные в процесс терминации трансляции. Позже эта гипотеза получила подтверждение в прямых биохимических исследованиях Л.Л. Киселева и других, идентифицировавших продукты генов SUP45 и SUP35 как факторы терминации трансляции eRF1 и eRF3 соответственно. В начале 90-х годов нам удалось выяснить в совместных исследованиях, прежде всего с группой М.Д. Тер-Аванесяна, что один из этих генов, а именно ген SUP35, кодирует дрожжевой прион. 4. РАСШИФРОВКА СИСТЕМЫ SUP35-[PSI] В любом гене стоп-сигнал может появиться не на своем месте в результате мутации. Тогда синтез соответствующего белка будет блокирован, поскольку произойдет преждевременная терминация синтеза этого белка. Если же инактивировать упомянутый уже белок-фактор терминации, узнающий стоп-сигналы, они же нонсенсы, то эти сигналы будут читаться как значащие и синтез соответствующего белка будет восстановлен. Это явление называется нонсенс-супрессией. Отсюда и название гена SUP от английского suppression. Тогда, имея нонсенс-кодоны не на своем месте в каких-либо генах, мы легко можем видеть, работает ли этот самый белок-фактор терминации. Есть супрессия - не работает. Нет супрессии - работает. Оказалось, что фактор терминации можно инактивировать двумя способами: мутационным путем, и тогда соответствующий нонсенс-супрессор наследуется, согласно менделевской схеме, как ядерный ген. Тот же белок может быть инактивирован за счет его модификации без изменения гена. Тогда нонсенс-супрессор передается с цитоплазмой и не обнаруживает менделевского расщепления. Собственно, такой цитоплазматический супрессор был известен давно, его открыл британец Б. Кокс в 1965 г. и назвал [PSI]-фактором. С тех пор никому не удавалось объяснить физическую природу его наследования. Наш результат заключался в том, что мы сумели показать: усиление экспрессии нормального немутантного гена SUP35, кодирующего фактор терминации, приводит с большой частотой к возникновению этого самого цитоплазматически наследуемого нонсенс-супрессора, или [РSI]-фактора. Появление в клетке большого числа молекул фактора терминации при сверхэкспрессии гена SUP35 увеличивает вероятность, в пересчете на клетку, его перехода в иную, полностью или частично неактивную конформацию. Возникает нонсенс-супрессия. Очевидно сходство с прионами млекопитающих. Именно эти результаты и использовал Р. Уикнер, когда произнес словосочетание "прионы дрожжей". Белковая природа дрожжевого приона - [РSI]-фактора - была доказана тем, что необходима именно активная "наработка" белка, кодируемого геном SUP35, а не увеличение копийности этого гена или количества соответствующей информационной РНК. Инфекционен ли дрожжевой прион? Инфекционность PSI-фактора можно показать, передавая при гибридизации только цитоплазму дрожжей, но не передавая ядро, в котором локализован ген SUP35. При этом вместе с цитоплазмой передается и свойство нонсенс-супрессии. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||