Шапероны и прионы. 1. Заякоривание белков в мембранах Белки, синтезируемые в шероховатом эндоплазматическом ретикулуме (шэр) и несущие стоптранспортсигнал
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
5. РАЗМНОЖЕНИЕ ПРИОНА Область исследования дрожжевых прионов очень быстро стала модной на Западе. В течение весны и лета 1997 г. в двух американских лабораториях были получены сенсационные результаты. Было показано, что дрожжевые прионы в клетках образуют такие же белковые агрегаты, как и прионы млекопитающих в тканях мозга. Более того, удалось показать, что образование дрожжевого приона может происходить вне клетки - в бесклеточном растворе. Причем для этого достаточно только фрагмента белка, содержащего прионизирующие повторы. Самые интересные результаты по эффективному размножению приона в бесклеточной системе получила группа М.Д. Тер-Аванесяна. Если в экстракт из клеток, не содержащих [РSI]-фактор, добавить очень небольшое количество экстракта из клеток, содержащих этот дрожжевой прион, то количество белка-приона быстро нарастает. Теперь в качестве затравки можно взять немного материала из этой смеси и вновь добавить его в экстракт из клеток без [PSI]-фактора. Результат будет тем же самым. И это можно повторять бесконечно.  Рис.5 Предполагаемый механизм «размножения» прионов. 6. ГИПОТЕЗА КОНФОРМАЦИОННЫХ МАТРИЦ Открытым остается вопрос о механизмах возникновения нового характера укладки (конформации) белка приона и последующего воспроизведения этой конформации. Очевидно, что спонтанно возникший или привнесенный в клетку прион далее превращает все вновь синтезируемые полипептиды с идентичной или очень близкой ему первичной структурой в свое подобие. Напрашивается гипотеза о существовании своеобразного механизма копирования конформации, или гипотеза конформационных матриц. В пользу этого предположения говорит результат, недавно полученный в нашей лаборатории. Если в дрожжевую клетку, не содержащую [PSI]-фактор, но потенциально способную его поддерживать, ввести искусственно сконструированный ген, кодирующий прионизующий пептид, - те аминокислотные повторы, которые содержит фактор терминации с пришитым к нему геном ADE-2, кодирующим один из ферментов синтеза пуринов, то в клетке появляется дрожжевой прион - [РSI]-фактор. Такая реакция является следствием введения в клетку дополнительной копии прионизующего пептида. О прионизации фактора терминации eRF3 мы судим по появлению нонсенс-супрессии. Этот прион можно изгнать при помощи гидрохлорида гуанидина, как и обычный дрожжевой прион. Интересно, однако, что такой прион можно изгнать и другим способом - просто потеряв из клетки введенный ранее искусственный ген. Следовательно, возникший или индуцированный в клетке дрожжевой прион требует для своего последующего размножения именно тот же белок, который его индуцировал. Дело в том, что если вы индуцируете прион, используя дополнительные копии непосредственно гена SUP35, кодирующего фактор терминации, способный прионизироваться и превращаться в [PSI]-фактор, то потеря этой дополнительной копии гена, или прекращение его сверхэкспрессии, не приведет к потере [PSI], ибо такой же ген останется в хромосоме и материал, необходимый для воспроизведения прионной конформации, будет синтезироваться в клетке. Искусственно индуцированный [PSI]-фактор "помнит" индуцировавший его белок и требует его присутствия для дальнейшего "размножения". Налицо характеристика матричного процесса, но при этом воспроизводятся не сами молекулы белка, а только их конформация. Таким образом, в клетке, видимо, существуют две категории матричных процессов: копирование последовательностей ДНК и РНК (см. рис. 1) и копирование конформации, характерное по крайней мере для некоторых белков. Своего рода матричное воспроизведение конформации имеет место в таких процессах, как образование структур цитоскелета при росте актиновых и тубулиновых волокон, воспроизведение ядерной мембраны, копирование внешнего кортекса у простейших. Эти механизмы могут лежать в основе так называемой эпигенетической наследственности/изменчивости. Вряд ли можно считать случайным совпадением то, что исследуемые нами факторы терминации синтеза белка имеют непосредственное отношение к функциям цитоскелета. Дело в том, что мутации по гену SUP35, кодирующему фактор терминации, приводят не только к нонсенс-супрессии. Они делают клетки сверхчувствительными к беномилу - агенту, специфически разрушающему микротрубочки, входящие в состав цитоскелета и образующие нити, ответственные за правильное расхождение хромосом. Видимо, поэтому упомянутые мутанты проявляют повышенную нестабильность хромосом в митозе. К аналогичному эффекту в мейозе приводит инактивация гомолога SUP35 у мухи Drosophila melanogaster. На основании этих данных можно предположить, что дрожжевой прион - своеобразный побочный результат процесса обычного конформационного копирования элементов цитоскелета в клетке. Результаты данного исследования показывают, что феномен прионов не является экзотикой, характерной для млекопитающих, а скорее - частным случаем общебиологического механизма, лежащего в основе эпигенетического наследования. На это же указывает изучение другого приона дрожжей - фактора [URE3], вовлеченного в регуляцию метаболизма азота. Он был открыт в 1971 г. Ф. Лакрутом. Известен также прион het-s, контролирующий тип несовместимости у гриба Podospora anseria, открытый недавно в лаборатории Бежере. В результате представленной здесь работы создана модельная система для изучения у дрожжей механизма возникновения и поисков лечения прионных заболеваний человека и животных. Преимущества данной модели очевидны. Дрожжи - прекрасно разработанный молекулярно-генетический объект. Известна полная последовательность ДНК его генома. Он дешевле мышей, у него больше разрешающая способность генетического анализа, а кроме того, эти исследования свободны от морально-этических проблем, связанных с правами человека и животных. Дрожжевые прионы, в отличие от прионов млекопитающих, не представляют опасности для человека. Если теперь вернуться к началу нашего рассказа - к центральной догме молекулярной биологии (см. рис. 5), то ее следует дополнить. Необходимо ввести в нее возможность модифицирования и копирования конформации белков. 7. Молекулярные основы патогенеза прионных инфекций. В ходе исследований мозговых тканей умерших от прионных инфекций животных было показано, что прионы не содержат нуклеиновых кислот, а представляют собой белки. Одним из первых охарактеризованных прионнных белков стал PrP (от англ. prion-related protein или protease-resistant protein) массой около 35 кДа. Известно, что PrP может существовать в двух конформациях — «здоровой» — PrPC, которую он имеет в нормальных клетках (C — от англ. cellular — «клеточный»), в которой преобладают альфа-спирали, и «патологической» — PrPSc, собственно прионной (Sc- от scrapie), для которой характерно наличие большого количества бета-тяжей. При попадании в здоровую клетку, PrPSc катализирует переход клеточного PrPC в прионную конформацию. Накопление прионного белка сопровождается его агрегацией, образованием высокоупорядоченных фибрил (амилоидов), что, в конце концов, приводит к гибели клетки. Высвободившийся прион, по-видимому, оказывается способен проникать в соседние клетки, также вызывая их гибель. Функции белка PrPC в здоровой клетке пока не определены. В норме белок PrPC ассоциирован с клеточной мембраной, гликозилирован остатком сиаловой кислоты. Он совершает циклические переходы внутрь клетки и обратно на поверхность в ходе эндо- и экзоцитоза. Один такой цикл длится около часа. В эндоцитозном пузырьке или на поверхности клетки молекула PrPC может разрезаться протеазами на две примерно равные части. До конца механизм спонтанного возникновения прионных инфекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе белков. Мутации генов, кодирующих прионный белок (PrP), ошибки трансляции, процессы протеолиза — считаются главными кандидатами на механизм возникновения прионов. Есть данные, дающее основание считать, что прионы являются не только инфекционными агентами, но и имеют функции в нормальных биопроцессах. Так, например, существует гипотеза, что через прионы осуществляется механизм генетически обусловленного стохастического старения. 8. Этиология прионных инфекций. Человек может заразиться прионами, содержащимися в пище, так как они не разрушаются ферментами пищеварительного тракта. Беспрепятственно проникая через стенку тонкого кишечника, они в конечном итоге попадают в центральную нервную систему. Так переносится новый вариант болезни Крейтцфельдта-Якоба (nvCJD), которой люди заражаются после употребления в пищу говядины, содержащей нервную ткань из голов скота, больных бычьей губчатой энцефалопатией (BSE, коровье бешенство). Прионы могут проникать в тело и парентеральным путем. Были описаны случаи заражения при внутримышечном введении препаратов, изготовленных из человеческих гипофизов (главным образом гормоны роста для лечения карликовости), а также заражение мозга инструментами при нейрохирургических операциях, поскольку прионы устойчивы к применяемым в настоящее время термическим и химическим методам стерилизации. Эта форма болезни Крейтцфельдта-Якоба обозначается как ятрогенная (1CJD). При определённых, неизвестных условиях, в организме человека может произойти спонтанная трансформация прионового протеина в прион. Так возникает так называемая спорадическая болезнь Крейтцфельдта-Якоба (sCJD), впервые описанная в 1920 г. независимо друг от друга Гансом Герхардом Крейтцфельдтом и Альфонсом Марией Якобом. Предполагается, что спонтанное возникновение этой болезни связано с фактом, что в норме в человеческом теле постоянно возникает небольшое количество прионов, которые эффективно ликвидируются клеточным аппаратом Гольджи. Нарушение этой способности «самоочищения» клеток может привести к повышению уровня прионов выше допустимой границы нормы и к их дальнейшему неконтролируемому распространению. Причиной возникновения спорадической болезни Крейтцфельдта-Якоба согласно этой теории является нарушение функции аппарата Гольджи в клетках. Особую группу прионовых заболеваний представляют собой наследственные (врожденные) болезни, вызванные мутацией гена прионового протеина, который делает возникший прионовый протеин более подверженным спонтанному изменению пространственной конфигурации и превращения их в прионы. К этой группе наследственных заболеваний относится и наследственная форма болезни Крейтцфельдта-Якоба (fCJD), которая наблюдается в ряде стран мира. При прионовой патологии наивысшая концентрация прионов обнаружена в нервной ткани заражённых людей. Значительное количество прионов встречается в лимфатической ткани. Наличие прионов в биологических жидкостях, включая слюну, пока не было однозначно подтверждено. Если представление о постоянном возникновении небольшого количества прионов верно, то можно предположить, что новые, более чувствительные методы диагностики откроют это количество прионов, разбросанное по различным тканям. В данном случае, однако, речь пойдёт о «физиологическом» уровне прионов, которые не представляют собой никакой угрозы для человека. 9. Пути заражения Очень мало известно о молекулярном характере прионов, вызывающих заболевания. Заражение могут вызвать примерно 100 000 молекул, которые в большинстве случаев образуют большие скопления. Значение агрегации отдельных молекул в ассоциации для вирулентности прионов пока не известна. Нельзя исключить, что вирулентными являются и отдельные молекулы прионов. Из некоторых экспериментов следует, что для возникновения прионов в ткани достаточно лишь временного контакта ткани с материалом, содержащим прионы, и нет необходимости, чтобы прионы были навсегда внесены в организм. Этот риск является актуальным, например, в связи с использованием хирургических инструментов, заражённых прионами. Процесс трансформации «здоровых» прионовых протеинов в прионы может быть инициирован простым контактом здоровых тканей с прионами, зафиксированными на хирургическом инструменте. Ход болезни и распространение прионов по организму зависит от типа приона. Прионы отличаются составом аминокислот, характерных для данного вида, определяемых видовым геном прионового протеина, а также так называемыми посттрансляционными модификациями или степенью гликозилирования базовой белковой цепочки. Посттрансляционная модификация значительно влияет на характеристики прионов и именно ей приписывают разницу между так называемыми прионовыми родами. В случае нового варианта (nvCJD) был пока что описан лишь один вид приона, сходный с прионами скота, заражённого бычьей губчатой энцефалопатией. Поэтому течение заболевания у человека и животных, заражённых новым вариантам, практически одинаков. У прочих видов живых существ, однако, известно много прионовых родов. У овец были описано примерно два десятка таких родов, которые не вирулентны для человека. Течение овечьего прионового заболевания в зависимости от рода прионов и драматически отличается — от очень быстрого, с практически внезапной гибелью, до медленного, затяжного. Нетипичные случаи клинического течения нового варианта у скота, заражённого бычьей губчатой энцефалопатией, которые имели место в Японии и Италии, наводят на мысль о существовании большего количества родов бычьих прионов. Если бы этот род бычьих прионов попал в организм человека, следовало бы ожидать возникновение нового варианта с симптомами и клиническим течением, отличными от известных случаев. 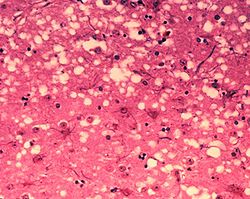 Гистологический препарат, поражение ткани прионами с образованием характерной губчатой структуры. У пациентов, больных болезнью Крейтцфельдта-Якоба, прионы распространяются в нервной системе, тканях глаза и лимфатических тканям, включая миндалины, селезенку, а также в слепой кишке. Наибольшее количество прионов находится в нервной системе, а наименьшее — в лимфатической ткани. Пока что не был зарегистрирован ни один случай переноса нового варианта болезни Крейтцфельдта-Якоба (nvCJD) при медицинском вмешательстве, что является, разумеется, хорошей новостью. С другой стороны, специалисты предупреждают о преувеличенном оптимизме, прежде всего в условиях Великобритании, так как инкубационный период может быть достаточно долгим (от 5-8 месяцев до 10-15 лет). 10. Прионы и медицинские инструменты Прионы очень стойки к обычным методам дезинфекции. Ионизирующее, ультрафиолетовое или микроволновое излучение на них практически не действует. Дезинфекционные средства, обычно используемые в медицинской практике, действуют на них лишь в очень ограниченной мере. Надёжно их ликвидируют дезинфицирующие реактивы — сильные окислители, разрушающе действующие на протеины. Другое затруднение представляет собой стойкость прионов к высоким температурам. Даже при автоклавировании при 134 °C в течение 18 минут невозможно достичь полного разрушения прионов, и прионы «выживают» в форме, способной вызвать заражение. Стойкость к высоким температурам ещё более возрастает, если прионы засохнут на поверхности металла или стекла или если образцы перед автоклавированием были подвергнуты действию формальдегида. В Великобритании, где новый вариант является очень серьёзной проблемой, по этим причинам уже используются одноразовые хирургические инструменты для тонзиллэктомии. В будущем напрашивается альтернативное решение: создания новых инструментов, с учётом повышенных требований к очистке и обеззараживанию. Одноразовое использование инструментов согласно принципам ВОЗ требуется в случае стоматологического обслуживания пациентов с диагностированным прионным заболеванием или в случае подозрения на него. Намного более сложным решением этой проблемы является лечение пациентов группы риска. К ним относятся пациенты, которые подверглись операциям, при которых была использована потенциально заражённая твёрдая мозговая оболочка, или пациенты из семей с наследственной формой болезни Крейтцфельдта-Якоба. ВОЗ в этом случае не требует никаких специальных мер. Британский Консультационный научный комитет по губчатой энцефалопатии в своём решении в 1998 г. счёл возможным ограничиться более тщательной очисткой и обеззараживанием инструментов, в сочетании с более длительным автоклавированием. 11. Прионные заболевания человека Наиболее известные прионные инфекции, связанные с поражением головного мозга: болезнь Кройтцфельдта — Якоба (Creutzfeldt-Jakob disease); фатальная семейная бессонница (Fatal Familial Insomnia); болезнь Куру (Kuru), связана с ритуальным каннибализмом в некоторых странах Океании; синдром Герстманна — Штройслера — Шейнкера (Gerstmann-Sträussler-Scheinker disease). 12.Потенциальная опасность для человека Несмотря на незначительное количество явных случаев прионных заболеваний у людей, многие специалисты считают, что имеется высокая степень опасности «медленных» инфекций для человека. Имеются данные, что источником распространения могут быть стоматологические процедуры, связанные с попаданием прионов в кровяное русло. Под подозрение попал также лецитин животного происхождения, что вызвало сокращение применения его в фармакологической промышленности, и вытеснение растительным (в основном, соевым) лецитином. Исследования прионов дрожжей и др. микромицетов Прион-подобные белки, поведение которых подобно поведению PrP найдены в природных популяциях микромицетов и дрожжей. Исследования прионов дрожжей подтвердили гипотезу о том, что превращение белков в прионное состояние зависит только от белков. Было показано, что прионы, экстрагированные из клеток, могут служить «семенами» образования прионов в пробирке. Одним из наиболее хорошо изученных белков, склонных к образованию прионов у дрожжей — фактор терминации трансляции (eRF3), который образует так назваемые PSI+ клетки. Такие клетки имеют изменёное физиологичеcкое состояние и изменённый уровень выражения некоторых генов, что позволило выдвинуть гипотезу о том, что у дрожжей образование прионов может играть адаптативную роль [1] . Критика Mark Purdy и David R. Brown предположили, что металлоионы, взаимодействуя с протеинами приона могут быть причиной развития прион-индуцированных (prion-mediated) заболеваний.[2] Purdy провёл кластерное эпидемиологическое исследование при прионных заболеваниях в районах с низкой концентрацией меди в почвах. Литература: Galkin AP, Mironova LN, Zhuravleva GA, Inge-Vechtomov SG. (2006). "Yeast prions, mammalian amyloidoses, and the problem of proteomic networks". Genetica 42 (11): 1558. PMID 17163073. 2000-09-22, Normal Function of Prions, Statement to the BSE Inquiry |
