Шапероны и прионы. 1. Заякоривание белков в мембранах Белки, синтезируемые в шероховатом эндоплазматическом ретикулуме (шэр) и несущие стоптранспортсигнал
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
А. ШАПЕРОНЫ Пострансляционные изменения белковых молекул. Внутриклеточный транспорт, структурная модификация белков и функции шаперонов 1.Заякоривание белков в мембранах Белки, синтезируемые в шероховатом эндоплазматическом ретикулуме (ШЭР) и несущие «стоп-транспорт-сигнал», остаются в мембране ШЭР и закрепляются там за счет гидрофобных взаимодействий в качестве интегральных мембранных белков. Фиксация белка в мембране (рис.1) может быть также осуществлена путем присоединения липофильного якоря Рисунок 1 Фиксация( заякоривание) белка в мембране 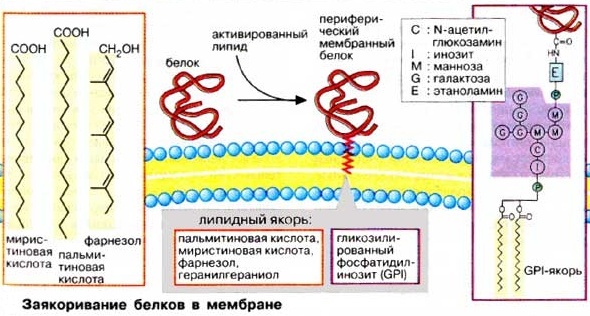 Такие периферические мембранные белки присоединяют липиды во время или сразу после трансляции. Соответствующий сигнал обычно содержится в белке в форме специфической пептидной последовательности. Мембранными якорями являются жирные кислоты (ацильные остатки) или изопреноиды (пренильный остаток). Белки могут быть ацилированы пальмитиновой (C16) или миристиновой (C14) кислотами, пренилированы путем связывания с фарнезолом (С15) или геранилгераниолом (С20). Некоторые белки несут на С-конце гликозилированный фосфатидилинозит (ГФИ (GPI)]. В эту группу входят многие адгезионные молекулы (например, N-CAM, гепаринсульфатпротеогликан), ряд мембранных ферментов, таких, как щелочная фосфатаза, ацетилхолинэстераза и различные протеиназы. 2.Транслокация белков Аминокислотная последовательности синтезируемых на рибосомах белков остатков (сигнальная последовательность) обеспечивают направленную доставку этих вновь синтезированных белковых молекул к внутриклеточным органеллам и микрокомпартментам клетки. Они оказывают влияние на характер фолдинга, посттрансляционные модификации и метаболическую стабильность. Существуют пять биохимических процессов с участием вновь синтезируемых белков, контролируемых сигнальными последовательностями аминокислотных остатков: 1.транслокация белка через плоскость мембраны; 2.внутриклеточный перенос белка без пересечения плоскости мембраны; 3.химические модификации белка без гидролиза пептидных связей; 4. расщепление некоторых пептидных связей в белке; 5.конформационные и иные пространственные изменения белков, включая фолдинг и олигомеризацию полипептидных цепей. Большинство внутриклеточных белков заканчивают существование в результате протеолитического гидролиза, превращаясь в небольшие пептиды и свободные аминокислоты, которые утилизируются в синтезе новых белков. Многие протеолитические ферменты используют в качестве субстратов индивидуальные белки. Имеется множество протеиназ широкой субстратной специфичности, чья неразборчивость в субстратах компенсируется их строгой компартментализацией. Они локализованы в лизосомах и вакуолях, где гидролизуют любые белки после их попадания в эти органеллы. Такая компартментализация протеолитических ферментов является жизненно важным условием существования клетки. Перенос, транслокация белков через плоскость биомембраны осуществляется специальными транспортными системами (рис2.) Рисунок 2 Транслокация белков 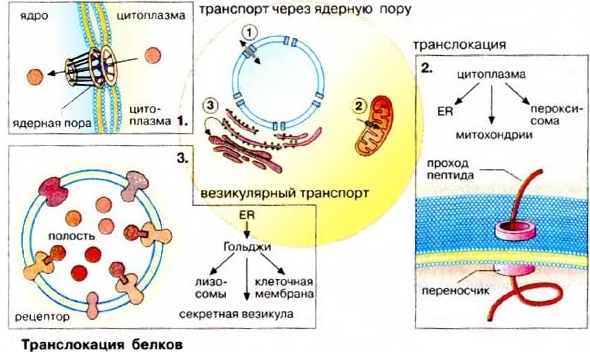 1.Транспорт белков из цитоплазмы в ядро через ядерную пору (пориновый механизм). Из цитоплазмы в ядро белки попадают через крупный (125000 кДа ) заполненный водой пориновый комплекс. Транспорт белков через этот комплекс энергозависим и поэтому может регулироваться. Ядерные белки несут одну или несколько сигнальных последовательностей, с помощью которых они связываются с пориновым комплексом и импортируются с сохранением третичной структуры. 2. Везикулярный транспорт. При этом виде транспорта перенос белков от одних органелл к другим происходит с помощью везикул.Везикулы отпочковываются от мембран одной органеллы, а затем исчезают, сливаясь с мембраной другой органеллы. Белки переносятся в полости пузырька или в составе мембран подобно интегральным белкам. 3. Транслокация белков из цитозоля от рибосом в органеллы (эндоплазматический ретикулум, митохондрии, пероксисомы и др.) осуществляется белками-переносчиками, которые представляют собой белковые комплексы, переносящие линейные полипептиды через биомембраны энергозависимым образом. Специфичность процесса обеспечивается за счет связывания сигнальной последовательности с ближайшим рецептором. При этом виде транспорта процессы развертывания и вторичной укладки белков контролируются шаперонами. 3.Строение и функции шаперонов. В результате сложного многоступенчатого процесса пептидная цепь белковой молекулы, растущая в процессе трансляции, принимает вторичную и третичную структуру. Для образования правильной её структуры с еще не свернувшейся пептидной цепочкой связываются специальные белки — шапероны (рис 3), которые осуществляют структурную модификацию, пространственную укладку молекулы белка без гидролиза пептидных связей. Поддержание контроля качества структуры белка, сборка полипротеинов и укладка мультипротеиновых комплексов, также осуществляется шаперонами. Шапероны связываются с гидрофобными участками неправильно уложенных белков и помогают им свернуться и достигнуть правильной стабильной нативной структуры и, тем самым, предотвращают их включение в нерастворимые и нефункциональные агрегаты. Рисунок 3. Функции шаперонов 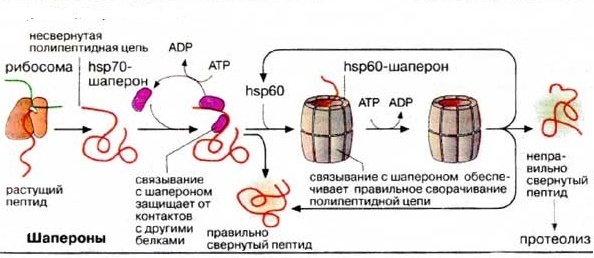 Шапероны обладают сродством к экспонированным гидрофобным участкам полипептидной цепи. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для нормального сворачивания растущего пептида. Взаимодействие с шаперонами — процесс энергозависимый: при освобождении шаперонов гидролизуется АТФ (АТР). Шапероны также нужны для рефолдинга белков после переcечения ими клеточных мембран, поскольку белки пересекают клеточные мембраны в дефолдированной конформации. Шапероны представляют собой длинную цилиндридрическую полисубъединичную четвертичную структуру, которая связывает нефолдированные белки с центральной гидрофобной полостью шаперона. Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp60, hsp70, hsp90). Свое название эти белки получили потому, что их синтез возрастает при повышении температуры и других формах стресса. При этом они выполняют функцию защиты белков клетки от денатурации. Белки — представители семейства hsp70 — связываются на начальной фазе образования растущего пептида. Одни из них контролируют процесс сворачивания белка в цитоплазме, другие — участвуют в переносе белков в митохондрии. Белки hsp60охватывают синтезированный полипептид наподобие бочонка, тем самым обеспечивая условия для принятия правильной конформации (рис.2). Таким образом, шаперо́ны — класс белков, главная функция которых состоит в восстановлении правильной вторичной и третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. В настоящее время высказана гипотеза, в соответствии с которой шапероны, если не могут обеспечить транспорт белков, то способствуют быстрой деградации этих белков. Известно об ускорении протеолиза, индуцированного денатурирующим эффектом нагревания белка. 4. Шапероны и фолдинг белковых молекул Вновь синтезированные молекулы белки после выхода с рибосом для правильного функционирования должны укладываться в стабильные трехмерные структуры и оставаться такими на протяжении всей функциональной жизни клетки. Правильное сворачивание (фолдинг) полипептидных цепей обеспечивается специфическими белками, называемыми шаперонами, которые необходимы для эффективного формирования третичной структуры полипептидных цепей белков, но не входят в состав конечной белковой структуры. В течение своей функциональной жизни, белок может подвергаться различным стрессам и денатурации. Такие частично денатурированные белки могут стать мишенью протеаз, агрегировать или вновь укладываться в нативную структуру с помощью шаперонов. Баланс и эффективность, с которой происходят эти три процесса, определяются соотношением компонентов, участвующих в этих реакциях. К этому классу белков-шаперонов относятся цитозольные белки теплового шока Hsp70 и Hsp60 , а также гомологичные им белки, например белок, связывающийся с тяжелой цепью иммуноглобулинов. Шапероном является также ядерный нуклеоплазмин, обеспечивающий сборку нуклеосом . У E. coli соответствующие функции выполняют белки SecB , триггерный фактор, а также GroEL и GroES , обеспечивающие экспорт полипептидов из цитоплазмы и участвующие в морфогенезе бактериофагов. Два последних белка - GroEL и GroES, известные также как Cpn60 и Cpn10 , кодируются генами оперона groE , регулируемого тепловым шоком. Белки, эволюционно родственные белку GroEL, получили название шаперонинов. Один из таких белков, обнаруженный в хлоропластах высших растений, участвует в сборке D-рибулозо-1,5- дифосфаткарбоксилазы-оксигеназы (Rubisco), которую часто используют в качестве модельного белка в исследованиях механизмов сворачивания полипептидных цепей. Шапероны кроме своей основной функции, укладки белков также осуществляют много других важных функций связанных с изменением конформации белков, а именно: 1. Транспорт многих белков из одного компартмента в другой, например, перенос субъединицы фермента Rubisco из цитоплазмы в хлоропласт происходит при участии шаперона Hsp70, который находится с ним в комплексе [ Checa ea 1997 ]. 2. Участие в сигнальных путях, например, присутствие Hsp70 необходимо для активации фосфатазы, которая путем дефосфорилирования ингибирует протеин киназу JNK, компонент сигнала стресс-индуцированного апоптоза, т.е. Hsp70 является частью антиапоптозного сигнального пути [ Yaglom, 1999 ] 3. Регуляция функции различных молекул, например, стероидный рецептор, находящийся в цитоплазме, связан с Hsp90. Лиганд, попадающий в цитоплазму, присоединяется к рецептору и вытесняет шаперон из комплекса. После этого комплекс рецептор-лиганд приобретает способность связываться с ДНК, мигрирует в ядро и осуществляет функцию транскрипционного фактора [ Scherrer ea 1992 ]. 5. Представители, классы и механизм действия шаперонов. Термин «шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина предотвращающего агрегирование белков-гистонов с ДНК при образовании нуклеосом. Шапероны есть во всех живых организмах, и механизм их действия связан с нековалентным присоединением к белкам и их «расплетение - укладка» с использованием энергии гидролиза АТФ. 
Термин белки теплового шока или белки стресса, или шапероны (HSP от heat shock protein), появился в конце 70-ых годов для обозначения новой группы белков, синтез которых начинается в клетках под действием различных стрессовых факторов, например, нагрева; отсюда и происходит название этой группы белков. То, что эти белки имеют огромное значение для жизнедеятельности организма в нормальных условиях, стало ясно несколько позже, когда были исследованы молекулярные свойства HSP и особенности их поведения в живой клетке. Было установлено, что в ответ на тепловой шок в клетках эукариот включается активация транскрипции всех генов, индуцируемых стрессом, осуществляемая специальным транскрипционным фактором (фактор теплового шока HSF). В клетках, не подвергшихся стрессу, HSF присутствует и в цитоплазме и в ядре в виде мономерной формы, связанной с шапероном Hsp70, и не имеет ДНК- связывающей активности. В ответ на тепловой шок или другой стресс, Hsp70 отсоединяется от HSF и начинает укладывать денатурированные белки. HSF собирается в тримеры, у него появляется ДНК связывающая активность, он аккумулируется в ядре и связывается с промотором. При этом транскрипция шаперонов в клетке возрастает во много раз. После того, как стресс прошел, освободившийся Hsp70 опять присоединяется к HSF, который при этом теряет ДНК-связывающую активность и все возвращается в нормальное состояние. Аналогичным образом все происходит и при других стрессах. Шапероны, образуя комплекс с растущей полипептидной цепью, предотвращают их неспецифическую агрегацию и деградацию под действием внутриклеточных протеиназ, способствуя их правильному фолдингу, происходящему с участием других шаперонов. Шапероны семейства Hsp70 принимают участие в ATP-зависимом разворачивании полипептидных цепей, делая неполярные участки полипептидных цепей доступными действию протеолитических ферментов. Один из наиболее хорошо изученных белков теплового шока - белок Hsp70, главный представитель одноименного семейства. Индукция (синтез) Hsp70 происходит в ответ на действие многих стрессовых факторов. Молекула Hsp70 содержит 641 аминокислотный остаток и состоит из двух функционально различных доменов. В N-концевой части молекулы находится АТФ-связывающий сайт, а С-концевой домен обладает пептид-связывающей активностью. Члены семейства шаперонов молекулярной массой 70 kDa узнают гидрофобные домены белков, которые экспонируются при нарушенной (не нативной) конформации. Шапероны не связываются с нативными белками. Активация при стрессах является важным свойством многих шаперонов. Если же шаперонов не хватает для укладки всех поврежденных белков, то укладка осуществляется неправильно и белки будут подвергаться деградации с помощью протеаз и/или агрегировать. Основные шапероны млекопитающих и дрожжей (табл 1) структурно и функционально очень похожи между собой.
Они представлены семействами, состоящими из гомологичных по строению и функциям белков, которые отличаются по характеру экспрессии и присутствию в разных компартментах клетки. Такие основные семейства шаперонов как Hsp90 , Hsp70 , Hsp60 , Hsp100 и их кошапероны (белки, помогающие шаперонам осуществлять свою функцию более эффективно) есть у обоих типов организмов. У дрожжей имеется шаперон, который не встречается у млекопитающих, - Hsp104 , относящийся к семейству Hsp100. Для функционирования всех шаперонов требуется гидролиз ATP . Шапероны разных семейств могут функционировать в разных компартментах клетки. Например, существуют различные члены семейства Hsp70, работающие в цитоплазме, митохондриях, хлоропластах и в эндоплазматическом ретикулуме. В сворачивании полипептидных цепей участвуют белки фолдазы и изомеразы. Наиболее хорошо изученными ферментами этой группы являются тиоредоксин и глутатионредуктаза, которые наряду с глутатионзависимым превращением рибонуклеотидов в дезоксирибонуклеотиды способны восстанавливать дисульфидные связи в белках, способствуя формированию у них правильной третичной структуры. | ||||||||||||||||||||||||||||||||||||||||
