белки. Белки. Ферменты. Витамины
 Скачать 189.08 Kb. Скачать 189.08 Kb.
|
|
Биологическая химия Специальность- Фармация Контрольное задание Модуль 1 Тема занятия: Белки. Ферменты. Витамины «. Функции шаперонов и шаперонинов (белков теплового шока). Их роль в развитии адаптивной реакции организма. Шаперо́ны (англ.chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Термин «молекулярный шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина, способного предотвращать агрегирование белков- гистонов с ДНК при образовании нуклеосом. Шапероны есть во всех живых организмах, и механизм их действия, нековалентное присоединение к белкам и их «расплетение» с использованием энергии гидролиза АТФ также консервативен. Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы. Тепло сильно влияет на фолдинг белка, а некоторые шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков. Другие шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие. Другие типы шаперонов участвуют в транспортировке веществ сквозь мембраны, например, в митохондриях и эндоплазматическом ретикулуме у эукариот. Продолжают обнаруживаться новые функции шаперонов, например, участие в разрушении белка, деятельности бактериального адгезина и в реакциях на заболевания, связанные с агрегацией белков. При синтезе белков на рибосоме N-концевая область полипептида синтезируется раньше С-концевой. Для формирования нативной конформации необходима полная аминокислотная последовательность белка. В процессе синтеза белков шапероны-70, благодаря строению их активного центра, способны закрывать склонные к агрегации участки полипептида, обогащенные гидрофобными радикалами аминокислот до завершения синтеза 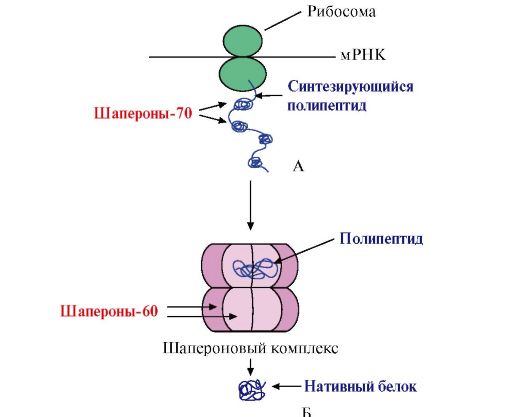 Рис.1 А - участие шаперонов-70 в предотвращении гидрофобных взаимодействий между участками синтезирующегося полипептида; Б - формирование нативной конформации белка в шапероновом комплексе Многие высокомолекулярные белки, имеющие сложную конформацию, например доменное строение, осуществляют фолдинг в специальном пространстве, сформированном Ш-60. Ш-60функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц. Они формируют два полых кольца, каждое из которых состоит из семи субъединиц, эти кольца соединены друг с другом. Каждая субъединица Ш-60 состоит из трех доменов: апикального (верхушечного), обогащенного гидрофобными радикалами, обращенными в полость кольца, промежуточного и экваториального (рис. 2). 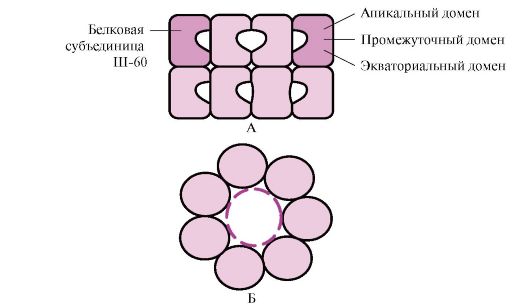 Структура шаперонинового комплекса, состоящего из 14 Ш-60 А - вид сбоку; Б - вид сверху Структура шаперонинового комплекса, состоящего из 14 Ш-60 А - вид сбоку; Б - вид сверхуСинтезированные белки, имеющие на поверхности элементы, характерные для несвернутых молекул, в частности гидрофобные радикалы, попадают в полость шапероновых колец. В специфической среде этих полостей происходит перебор возможных конформаций, пока не будет найдена единственная, энергетически наиболее выгодная (рис. 1, Б). Формирование конформаций и высвобождение белка сопровождается гидролизом АТФ в экваториальной области. Обычно такой шаперонозависимый фолдинг требует затрат значительного количества энергии. Шапероны также необходимы для протекания таких фундаментальных процессов, как сборка олигомерных белков, узнавание и транспорт в лизосомы денатурированных белков, транспорт белков через мембраны, участие в регуляции активности белковых комплексов. 24. Влияние рН среды на активность ферментов (графическая зависимость, механизмы). Чем объясняется характер кривой V = f (pH)? Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный (рис. 1). 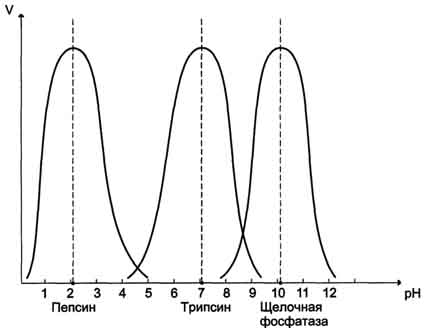 Рис. 1. Зависимость скорости ферментативной реакции (V) от рН среды Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН. Оптимальные значения рН для некоторых ферментов
41. Гликогенсинтаза (фермент, участвующий в синтезе гликогена в печени) может находится в двух формах с различной активностью: в виде простого белка (активный фермент) и в виде фосфопротеина (неактивный фермент). Объясните, каким путем активный фермент переходит в неактивный и почему этот переход сопровождается изменением активности. Активность гликогенфосфорилазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активна в фосфорилированной форме и неактивна в дефосфорилированной. Присоединение фосфатов к ферменту производят протеинкиназы, источником фосфата является АТФ: фосфорилаза гликогена активируется после присоединения фосфатной группы. Например, во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения. при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови. Способы активации фосфорилазы гликогена Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: ковалентная модификация, кальций-зависимая активация, аллостерическая активация с помощью АМФ. Ковалентная модификация фосфорилазы При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает: Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором; Активный гормон-рецепторный комплекс воздействует на мембранный G-белок; G-белок активирует фермент аденилатциклазу; Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер); цАМФ аллостерически активирует фермент протеинкиназу А; Протеинкиназа А фосфорилирует различные внутриклеточные белки: одним из этих белков является синтаза гликогена, ее активность угнетается, другим белком – киназа фосфорилазы, которая при фосфорилировании активируется; Киназа фосфорилазы фосфорилирует фосфорилазу "b" гликогена, последняя в результате превращается в активную фосфорилазу "а"; Активная фосфорилаза "а" гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата. 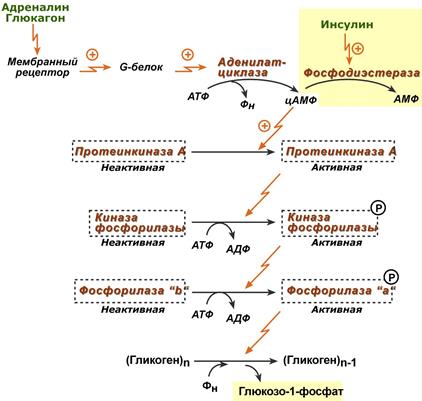 Аденилатциклазный способ активации фосфорилазы гликогена Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ и, следовательно, снижает активность гликоген-фосфорилазы. 104. Из перечисленных ниже витаминов выберите витамины, которые принимают участие в реакциях трансметилирования. Ответ подтвердите написанием уравнений переноса метильных групп. Витамины: А, РР, В1, В2, В12, фолиевая кислота, В6 Ответ: для реакций трансметилирования нужны витамины В12 и фолиевая кислота. В реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата. 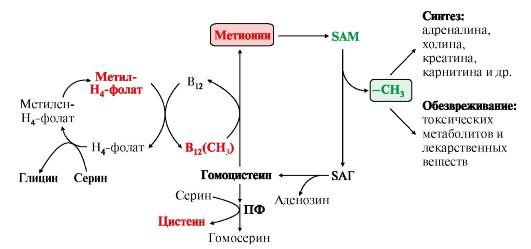 Реакции трансметилирования: Синтез фосфатидилхолина 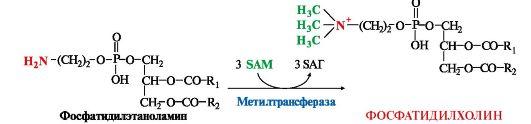 Синтез карнитина - переносчика ацильной группы в митохондрии - происходит путем метилирования γ-аминомасляной кислоты с участием SAM: 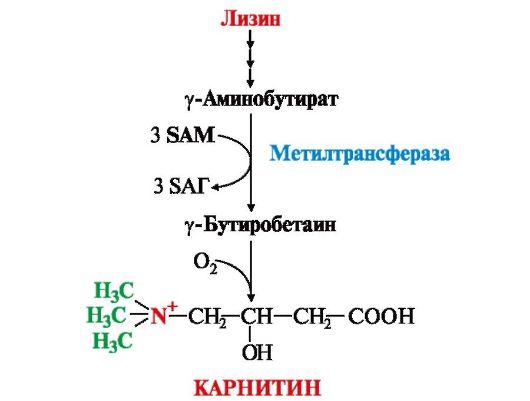 Синтез креатина происходит с использованием трех аминокислот:аргинина, глицина и метионина. Процесс начинается в почках, в реакцию вступают аргинин и глицин. Образующийся гуанидинацетат поступает затем в печень, где подвергается метилированию с участием SAM и превращается в креатин. Из печени креатин транспортируется в мышцы и головной мозг. Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует ферменткреатинкиназа 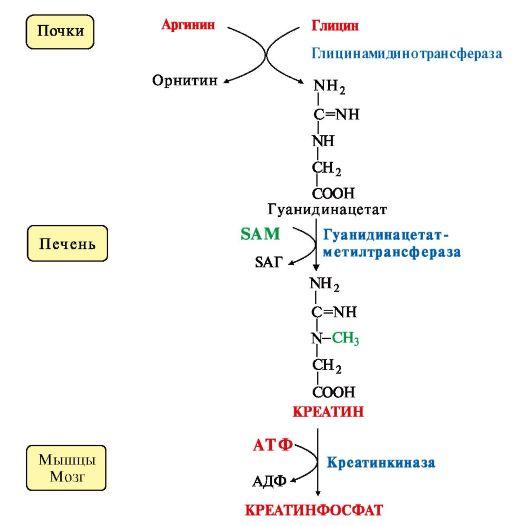 Схема синтеза и использования креатина 11.Напишите химическую формулу пептида вал-ала-гли-цис, определите его электрический заряд и направление движения в электрическом поле при рН 3. Установите, в какой среде находится изоэлектрическая точка данного пептида. Ответ обоснуйте. 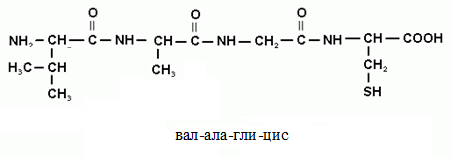 Данный пептид в нейтральной среде не имеет заряда, следовательно, находится в изоэлектрическом состоянии (ИЭТ в нейтральной среде). При рН= 3 (кислая среда, избыток протонов), будет протонироваться карбоксильная группа (Н+ + СОО- = СООН), пептид будет заряжаться положительно и двигаться при пропускании электрического тока к отрицательно заряженному электроду. т.е к катоду 47. Почему врач рекомендовал пациенту использовать жаропонижающие средства только тогда, когда температура тела повысится до 38ОС? Ферменты- это вещества белковой природы, их активность зависит от температуры. При увеличении температуры более 380С начинается тепловая денатурация белка. Денатурация – это необратимое изменение труктуры белка, при этом он теряет свои нативную конформацию и биологическую активность. 60. В клинической практике дикумарол используют для лечения больных с острым тромбофлебитом для профилактики внутрисосудистого тромбообразования. Объясните возможный механизм действия дикумарола. Какое отношение дикумарол имеет к витаминам? К каким именно? Дикумарол это антогонист витамина К, который участвует в свертывающей системе крови. Факторы свертывания крови (II, VII, IX, X) содержат в своем составе остатки γ-карбоксиглутаминовой кислоты, которые, посредством ионов Са++, обеспечивают связь этих ферментов с фосфолипидами клеточных мембран. В отсутствии ионов Са++ кровь не свертывается. γ-карбоксилирование глутаминовой кислоты катализируется карбоксилазой, коферментом которой является витамин К. В связи с этим при недостатке витамина К. Дикумарол нарушают γ-карбоксилирование выше названных факторов свертывания, что делает его возможным использование при остром тромбофлебите, разжижение крови. |
