|
|
книга цивадзе. 11 Общие сведения о комплексных соединениях 11 Состав комплексных соединений
В формуле комплекса на первое место обычно ставят комплексообразователь; за ним по порядку следуют лиганды — положительно заряженные, нейтральные и отрицательно заряженные; например, [Pt(NH3)2Cl2]. Лиганды, имеющие одинаковый заряд, располагают слева направо в порядке возрастания электроотрицательности их первых элементов, например
[Co(C5H5N)2(NH3)4]Cl3, или по алфавиту.
Названия отрицательно заряженных лигандов состоят из полного названия (или его корня) соответствующего аниона и окончания «-о», например I– — иодо, Н– — гидридо, СО32− — карбонато. Анионы углеводородов в качестве лигандов чаще всего называют так же, как соответствующие углеводородные радикалы, например C H5 5− — циклопентадиенил. Нейтральные лиганды называют так же, как соответствующие молекулы (без дополнительных приставок и окончаний); например, N2H4 — гидразин, С2Н4 — этилен, C5H5N — пиридин. Для некоторых нейтральных и отрицательно заряженных лигандов используют специальные названия: Н2О — аква, NH3 — аммин, СО — карбонил, NO — нитрозил, S2– — тио. Названия большинства положительно заряженных лигандов имеют окончание
«-ий»: N H2 5+ — гидразиний. Катионы водорода H обозначают словом
«гидро».
Количество одинаковых лигандов в комплексе указывают числовыми приставками, которые пишутся слитно с названиями лигандов, например Na2[Zn(OH)4] — тетрагидроксоцинкат натрия. Если использование приставок ди-, три-, тетра-, пента- и т. д. не отражает однозначно формулу соединения или если название лиганда уже содержит числовые приставки, применяют умножающие числовые приставки: бис-, трис-, тетракис-, пентакис- и другие, а название лиганда заключают в скобки: [Fe(C5H5)2] — бис(циклопентадиенил)железо.
Название нейтрального комплекса состоит из одного слова: сначала название лиганда (лигандов) с приставкой, обозначающей число лигандов, далее русское название комплексообразователя в именительном падеже (для многоядерных комплексов также с числовой приставкой): [Ni(CO)4] — тетракарбонилникель, [Al2Cl6] — гексахлородиалюминий. Название комплексного катиона составляют по тем же правилам, но дополнительно указывают степень окисления комплексообразователя, а название комплекса ставят в родительном падеже: [Ag(NH3)2]Cl — хлорид диамминсеребра(I). В названии комплексного аниона используют латинский корень названия элемента и добавляют суффикс «-ат»: Na[Ag(CN)2] — дицианоаргентат(I) натрия. Степень окисления комплексообразователя (если элемент проявляет в соединениях несколько степеней окисления) указывают римской цифрой в скобках после названия элемента. Если степень окисления комплексообразователя неизвестна, указывают заряд всего иона (арабской цифрой в скобках), например [Nb6Cl12] — катион додекахлорогексаниобия(1+).
Мостиковые лиганды обозначают греческой μ («мю») перед названием мостикового лиганда каждого вида. При перечислении лигандов в названии комплекса сначала называют все мостиковые (в порядке их усложнения), затем все немостиковые, а после этого — комплексообразователи с указанием их числа. Если в комплексе имеются одинаковые фрагменты, это также может быть отражено в названии. Например, комплексное соединение [(NH3)5Co(μ-NH2)Co(NH3)5]Cl5 можно назвать пентахлорид (μ-амидо)декаамминдикобальта(III) или хлорид (μ-амидо)бис{пентаамминкобальта(III)}.
Вопросы
11.4. Назовите следующие комплексы: а) [Co(CO)4]; б) [Fe(C5H5)2];
в) [Cu(H2O)4]2; г) [Zn(OH)4]2–; д) [Cr(H2O)5OH]2. 11.5. Напишите формулы следующих комплексных соединений: а) тетрафтороборат калия; б) тетрагидридоборат алюминия; в) хлорид диамм инсеребра(I); г) дицианоаргентат(I) натрия.11.3. Классификация комплексных соединений
Многообразие комплексных соединений не позволяет создать единую классификацию. Наиболее простая классификация — по заряду комплекса (нейтральные, анионные и катионные комплексы). Поскольку в водном растворе ионные связи легко разрываются и комплексные соединения необратимо диссоциируют (распадаются на отдельные внутри- и внешнесферные ионы), можно выделить комплексные кислоты, основания и соли. При классификации по типу лигандов все комплексы можно разделить на соединения с неорганическими и органическими лигандами, а далее рассматривать по отдельности комплексы с каждым типом лигандов.
11.3.1. Комплексы с неорганическими лигандами
Аквакомплексы содержат в качестве лигандов молекулы воды. Такие комплексы существуют в водных растворах и во многих кристаллогидратах. Так, при растворении в воде белого сульфата меди CuSO4 образуется голубой раствор, поскольку в воде сразу образуется комплексный катион тетрааквамеди(II) [Cu(H2O)4]2. При выпаривании этого раствора кристаллизуется голубой пентагидрат сульфата меди CuSO4 ⋅ 5H2O (медный купорос), который содержит аквакатионы меди [Cu(H2O)4]2. При прокаливании пентагидрита CuSO4 ⋅ 5H2O он постепенно теряет воду и при 200 °С снова превращается в белый безводный сульфат меди CuSO4.
В растворе аквакомплексы могут вступать в реакцию протолиза; большинство аквакомплексов — слабые кислоты (т. е. они отщепляют H, который, присоединяясь к несвязанным молекулам воды, образует катионы, прежде всего H3O), например:
[Cr(H2O)6]3 + H2O H3O + [Cr(H2O)5OH]2
Вслед за первым протоном комплексный катион может потерять и следующие протоны, однако по мере отщепления протонов из внутренней сферы кислотные свойства комплекса резко ослабевают. Чем выше степень окисления комплексообразователя, тем сильнее кислотные свойства его аквакомплекса. Например, катион гексаакважелеза(II) [Fe(H2O)6]2 проявляет очень слабые кислотные свойства, а катион гексаакважелеза(III) [Fe(H2O)6]3 — сильная кислота, даже сильнее уксусной и ортофосфорной кислот.
В гидроксокомплексах лигандами служат гидроксид-ионы. В растворе гидроксокомплексы обычно бывают устойчивы только в присутствии избытка гидроксид-ионов. При разбавлении раствора гидроксокомплексы легко разрушаются, отщепляя гидроксид-ионы:
[Zn(OH)4]2– + H2O [Zn(H2O)(OH)3]– + OH– [Zn(H2O)(OH)3]– + H2O [Zn(H2O)2(OH)2]↓ + OH– Известны и более устойчивые гидроксокомплексы, например хорошо растворимые в воде Na2[Sn(OH)6] и Na2[Pb(OH)6], малорастворимые Na[Sb(OH)6] и Ag2[Pt(OH)6]. Гидроксокомплексы легко разрушить действием любых кислот (даже самых слабых), например водным раствором диоксида углерода CO2:
[Pb(OH)4]2– + 4H3O = Pb2 + 8H2O
[Al(OH)4]– + 3CO2 = Al(OH)3↓ + 3HCO3−
Химия растворов гидроксокомплексов очень сложная. Так, в водном раств оре гидроксокомплекса алюминия можно обнаружить ионы:
[Al(OH)4]–, [Al(H2O)2(OH)4]–, [Al(H2O)4(OH)2], [Al2(H2O)8(OH)2]4 и многие другие. В многоядерных гидроксокомплексах алюминия и некоторых других металлов комплексообразователи могут быть связаны через мостиковые гидроксолиганды.
Аммины — соединения в составе внутренней сферы которых сожержатся молекулы аммиака; аммиакаты часто содержат не только внутри-, но и внешнесферные молекулы аммиака. У многих переходных элементов аммины более устойчивы, чем аквакомплексы, и легко образуются в водном растворе.
[Cu(H2O)4]2 + 4NH3 = [Cu(NH3)4]2 + 4H2O
Часто сначала осаждается малорастворимый гидроксид или осно[вная соль, которая затем переходит в растворимый аммиакат:
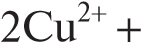 2NH3 ⋅ H2O + SO = Cu2(SO4)(OH)2↓ + 2NH 2NH3 ⋅ H2O + SO = Cu2(SO4)(OH)2↓ + 2NH
Cu2(SO4)(OH)2 + 6NH3 ⋅ H2O + 2NH = 2[Cu(NH3) SO SO
Аммиачные комплексы разрушаются при нагревании, а также под действием кислот, вызывающих протонирование лиганда, например:
[Cu(NH3)4]2 + 4H3O = Cu2 + 4NH + 4H2O
Ацидокомплексы содержат в качестве лигандов анионы кислот. Это самый многочисленный класс комплексов с неорганическими лигандами. Многие элементы образуют комплексы с галогенид-ионами:
B(OH)3 + 4KF = 3KOH + K[BF4]
CuCl + Cl– = [CuCl2]–
В зависимости от числа анионных лигандов во внутренней сфере ацидокомплексы могут иметь разную окраску, например бромокомплексы меди: светло-зеленый [Cu(H2O)3Br], темно-зеленый [Cu(H2O)2Br2], коричневый [Cu(H2O)Br3]–, темно-вишневый [CuBr4]2–.
Один и тот же лиганд, например тиоцианат-ион NCS–, с разными металлами также образует комплексы разного цвета: синий тетракис(тио циа нато)кобальтат(II) [Co(NCS)4]2–, зеленоватый тетракис(тиоцианато)феррат(II) [Fe(NCS)4]2–; красные [Fe(H2O)x(NCS)6–x]x–3 (самый устойчивый из акватиоцитатных комплексов железа — трис(тиоцианато)триакважелезо [Fe(H2O)3(NCS)3]).
Очень прочные комплексы образует с металлами цианид-ион CN– (кислотный остаток циановодородной кислоты HCN). При этом окраска комплекса может изменяться в зависимости от степени окисления комплек со образователя: например, жёлтая кровяная соль K4[Fe(CN)6] ⋅ 3H2O (триг ид рат гексацианоферрата(II) калия) и красная кровяная соль K3[Fe(CN)6] (гексацианоферрат(III) калия).
Разрушение ацидокомплексов обычно происходит в результате обмена лигандов
[Fe(NCS)6]3– + 4F– + 2H2O = [Fe(H2O)2F4]– + 6NCS–
или связывания комплексообразователя
[HgI4]2– + S2– = HgS↓ + 4I–
Особую группу комплексов составляют анионгалогенаты, в которых галогены одновременно выполняют функцию и лигандов, и комплексообразователей. Степень окисления комплексообразователя может быть положительная — [IIIICl4]–, нулевая — [(I2)0(I3)2]2– или отрицательная — [I–I(I2)2]–. Изополигалогенаты построены из атомов одного элемента (обычно иода), гетерополигалогенаты — из атомов разных элементов (при этом комплексообразователем всегда служит менее электроотрицательный галоген).
Способы получения анионгалогенатных комплексов достаточно разнообразны.
KI + I2 = K[I(I)2]
CsCl + IBr = Cs[I(Br)(Cl)] 2RbCl + I2Cl6 = 2Rb[ICl4]
KI + 2Cl2 = K[ICl4]
Все анионгалогенаты легко разрушаются при нагревании:
Rb[IBr2](т) = RbBr(т) + IBr(г)
K[I(I)2](т) = KI(т) + I2(г)
Гидридокомплексы, содержащие анион водорода Н–, обычно образуют элементы группы IIIA (группа 13 в длиннопериодной таблице). Наиболее устойчивы гидридокомплексы бора и алюминия. Эти соединения — сильные восстановители; они реагируют с водой с выделением водорода:
Al[BH4]3 + 12H2O = Al(OH)3 + 3B(OH)3 + 12H2
Комплексные соединения, в которых лигандами служат молекулы монооксида углерода CO, называются карбонилами. Эти комплексы обычно содержат металл в нулевой или даже отрицательной степени окисления (например, [Cr(CO)6], [Mn(CO)5]–). Стехиометрия карбонилов подчиняется правилу эффективного атомного номера (так называемому правилу Сиджвика3):
Суммарное количество электронов атома или иона металла и электронов, предоставленных ему лигандами, равно числу электронов в атоме ближайшего благородного (инертного) газа.
Наиболее устойчивы комплексы, в которых реализуется 18-электронная оболочка из s-, p- и d-электронов комплексообразователя и электронных пар лигандов. При этом d-элементы с четным числом валентных электронов образуют одноядерные карбонилы, а с нечетным — двухъядерные (со связью металл—металл). Карбонилы обычно термически неустойчивы, поэтому их образование используют как промежуточный этап при получении особо чистых металлов, например:
Ni + 4CO = [Ni(CO)4] (1 атм, 60–80 °С или 100–200 атм, 200–250 °С)
[Ni(CO)4] = Ni + 4CO (1 атм, 200 °С, без доступа воздуха)
Вопросы
11.6. Проведите классификацию следующих комплексных соединений тремя способами: а) Na3[Cr(OH)6]; б) H[AuCl4]; в) [Cu(NH3)4](ОН)2. 11.7. Какие виды комплексных соединений термически наименее устойчивы?
11.3.2. Комплексы с органическими лигандами
Лиганды органической природы очень разнообразны, поэтому классификация комплексов с органическими лигандами весьма сложная.
В роли лигандов часто выступают соединения состава RnЭ, где R — углеводородный радикал, Э — атом элемента 15- или 16-й группы Периодической системы. Известны комплексы, например, с аминами, арсинами, фосфинами, стибинами, простыми эфирами, тиолами, селено- и теллуроуглеводородами.
Лиганды типа RnЭ Х (Э — элемент 14–16-й группы, R — углеводородный радикал, насыщенный или ароматический) — это альдегиды и кетоны, органические оксиды (Э = N, P, As, Sb; X = O; n = 3), сульфоксиды (Э = S; Х = О; n = 2) и их аналоги (Х = S, Se, Te). Можно отметить, что, несмотря на наличие двух атомов, способных быть донорами (связываться с комплексообразователем, предоставляя орбиталь с неподеленной парой
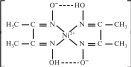
Рис. 11.4. Структурная формула комплекса никеля с диметилглиоксимом [Ni(dmg)2]. Диметилглиоксим часто обозначают gmg
электронов), фосфиноксиды монодентатны во всех комплексах, а сульфоксиды могут проявлять свойства бидентатных лигандов. Мочевина CO(NH2)2, тиомочевина CS(NH2)2 и их селенcодержащий аналог относятся к X-донорам. Однако известны комплексы, в которых эти лиганды образуют связи через атомы азота. Аналогичное поведение обнаружено и для других лигандов, содержащих двойная связь С Х: амидов, тиоамидов, семитиокарбазидов, селенокарбазидов и карбазонов.
В качестве органических лигандов совсем не редко встречаются и гетероциклические соединения, содержащие один или несколько гетероатомов. Донорными атомами в них обычно служат элементы 15- и 16-й групп Периодической системы.
Особый класс комплексных соединений с органическими лигандами — хелатные комплексы, в которых би- или полидентатные лиганды образуют с центральными ионом замкнутые циклы. Хелатные комплексы очень устойчивы. Один из примеров хелатного комплекса — розово-красный комплекс никеля с диметилглиоксимом C4N2H6(OH)2 (рис. 11.4). Этот комплекс используется при качественном и количественном анализе никеля в растворах. Впервые этот комплекс в аналитических целях применил русский ученый Чугаев4. Он установил, что комплексные соединения, содержащие циклические группировки, отличаются бо[льшей прочностью, чем комплексы, не содержащие циклов; при этом наиболее устойчивы комплексы с пяти- и шестичленными циклами.
Среди хелатных комплексных соединений особое место занимают комплексы с полигетеромакроциклическими лигандами, такими как порфин (рис. 11.5) и его производные — порфирины. Порфириновые комплексы входят в состав небелковой части молекулы гемоглобина (рис. 11.6), в молекулы хлорофилла и ряда ферментов.
Швейцарский химик Шварценбах5 в 1945 г. ввел термин «комплексоны» для обозначения полидентатных органических лигандов группы полиами-

Рис. 11.5. Структурная формула порфина
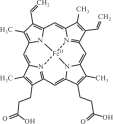
Рис. 11.6. Структурная формула гема (небелкового компонента гемоглобина)
нополикарбоновых кислот. Комплексные соединения этих лигандов называют комплексонатами. Самый известный комплексон — этилендиаминтетрауксусная кислота, сокращенно edtaH4 или ЭДТА (рис. 11.7):
(HOOCCH2)2N(C2H2)2N(CH2COOH)2
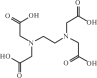
Рис. 11.7. Структурная формула этилендиаминтетрауксусной кислоты (ЭДТА)
Комплексонаты большинства металлов очень устойчивы, поскольку при образовании этих комплексов замыкаются два, три или более хелатных цикла (металлоцикла), как, например, в комплексе меди(II) с анионом этилендиаминтетраацетатом (рис. 11.8). Чаще всего ЭДТА используется в виде дигидрата динатриевой соли (комплексон III, трилон Б или ЭДТАNa2). ЭДТА позволяет определить более 60 элементов. В медицине ЭДТА используют для выведения из организма радиоактивных и токсичных металлов. Этот реактив нашел широкое применение в текстильной, кожевенной, бумажной и лакокрасочной промышленности, в металлургии, в цветной кинематографии, для смягчения воды и т. д.
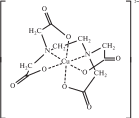
Рис. 11.8. Структурная формула комплекса меди(II) с анионом этилендиаминтетрауксусной кислоты
Ненасыщенные органические молекулы, например этилен, циклопентадиен, бензол и его производные, могут образовывать так называемые π-комплексы. В этих комплексах связь металла с органическим лигандом осуществляется при взаимодействии заполненных π-орбиталей лиганда с вакантными орбиталями металла (донорно-акцепторный механизм), при этом электроны с орбиталей металла попадают на низшие вакантные орбитали лиганда (дативный механизм). В π-комплексах металл может взаимодействовать со всеми атомами углерода π-электронной системы или только с некоторыми из них. Стехиометрия большинства π-комплексов подчиняется правилу Сиджвика. Химические свойства этих соединений зависят главным образом от природы лиганда и в меньшей степени от природы центрального атома металла, причем возможны реакции как с сохранением связи металл – лиганд (частичным или полным), так и с ее разрывом.
Самый известный π-комплекс — ферроцен [Fe(C5H5)2] (или, согласно правилам номенклатуры, бис(циклоп ентад иенил)железо). Циклопентадиен С5H6 содержит две двойные связи и проявляет слабые кислотные свойства. При взаимодействии циклопентадиена с металлическим натрием образуется ионное соединение циклопентадиенилнатрий:
2Na + 2С5H6 = 2Na(C5H5) + H2↑
При взаимодействии циклопентадиенилнатрия с катионами железа(II) в тетрагидрофуране выделяются оранжевые кристаллы бис(циклопент адиенил)железа:
FeCl2 + 2Na(C5H5) = [Fe(C5H5)2] + 2NaCl
Строение этого соединения напоминает сэндвич (бутерброд) (рис. 11.9). Комплекс диамагнитен, а комплексообразователь Fe(II) находится между циклическими анионами С Н5 5− на равном расстоянии от всех атомов углерода. В бис(циклопентадиенил)железе невозможно выделить отдельные ковалентные связи между комплексообразователем и атомами лиганда: центральный атом образует связь со всей π-электронной системой каждого из двух лигандов. В ферроцене функцию донора электронов выполняют два циклопентадиенил-иона — каждый предоставляет по три пары π-электронов. Акцепторами электронных пар служат sp3d2-гибридные орбитали железа(II). В этой сэндвичевой структуре шесть многоцентровых связей, которые дополнительно упрочняются по дативному механизму (посредством передачи лигандам электронных пар атома железа). Таким образом, для обозначения двухэлектронных связей валентные черточки теряют обычный смысл.
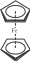
Рис. 11.9. Строение ферроцена
Вопросы
11.8. Для определения никеля Чугаев использовал аммиачный раствор диметилглиоксима (позже его назвали реактивом Чугаева). Какова здесь роль аммиака?
11.9. Какова дентатность лиганда ЭДТА?
|
|
|
 Скачать 1.93 Mb.
Скачать 1.93 Mb.