книга цивадзе. 11 Общие сведения о комплексных соединениях 11 Состав комплексных соединений
 Скачать 1.93 Mb. Скачать 1.93 Mb.
|
11.4. Химическая связь в комплексных соединениях11.4.1. Метод валентных связей Попытки объяснить образование новых более сложных соединений — комплексных соединений — взаимодействием некоторых вполне устойчивых молекул с различными атомами и ионами, например молекулы аммиака с катионом кобальта, молекулы монооксида углерода с атомами железа, кобальта, никеля и т. п., имеют давнюю историю. Для этого было предложено много теорий. В настоящее время общепринята точка зрения, что в специальной теории координационной связи нет необходимости. Однако применение к комплексным соединениям общих представлений о механизмах образования химической связи имеет некоторую специфику. Теория валентных связей была первой квантовомеханической теорией, использованной для приближенного объяснения образования связей в комплексных соединениях. Практическое применение этой теории было воплощено в методе валентных связей (ВС). В основе метода ВС лежит идея о донорно-акцепторном механизме образования ковалентных (координационных) связей между лигандом (донором электронной пары) и комплексообразователем (акцептором электронной пары). При перекрывании орбиталей лигандов, занятых неподеленными электронными парами, и свободных орбиталей комплексообразователя в межъядерном пространстве создается область повышенной электронной плотности. Электронные пары комплексообразователя при этом взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму. В отличие от соединений s- и р-элементов, где в гибридизации участвуют как связывающие, так и неподеленные электронные пары центрального атома, в комплексах d-элементов предполагается гибридизация только связывающих электронных пар, число которых соответствует координационному числу комплексообразователя. Кроме того, в соединениях s- и р-элементов неспаренных электронов всегда не так уж много, а комплексы d-элементов нередко содержат значительное число неспаренных электронов. Часто (но далеко не всегда) происходит объединение неспаренных электронов комплексообразователя в пары, при этом некоторые атомные орбитали, участвующие в гибридизации и образовании связей, остаются свободными. Строение комплексов (как и более простых соединений) зависит от типа гибридизации s-, p- и d-орбиталей центрального атома, участвующих в образовании связей. Электронные пары, которые заселяют гибридные орбитали комплексообразователя, стремятся занять в пространстве такое положение, при котором минимально их взаимное отталкивание. Таким образом, структура комплексных молекул и ионов в значительной степени зависит от типа гибридизации орбиталей центрального атома. При определении типа гибридизации орбиталей атома d-элемента нужно учитывать близость по энергии s-, p- и d-орбиталей одного слоя, а также d-оболочек предыдущего слоя: E(n–1)d ≈ Ens ≈ Enp ≈ End Таким образом, в гибридизации участвуют d-орбитали как последнего, так и предпоследнего слоев, поэтому геометрия (геометрическая конфигурация) комплексных частиц весьма разнообразна (табл. 11.1). Таблица 11.1 Геометрическая конфигурация комплексов
Координационные числа >6 встречаются достаточно редко. Координационные числа 8 и более (вплоть до 15) характерны для катионов лантаноидов, актиноидов и некоторых других элементов с большим радиусом. В ионных соединениях этих элементов координационный многогранник (полиэдр) — куб, а в комплексах — додекаэдр (d 4sp3гидридизация), квадратная антипризма (d 4sp3- или d5p3-гибридизация) и т. д. Примеры соединений с большими координационными числами — [Ln(H2O)9]3 (Ln — лантаноид); [MH9]2– (M = Tc, Re; КЧ = 9); [Ce(NO3)5]2– (КЧ = 10); [Ce(NO3)6]3– (КЧ = 12). В двух последних комплексах лиганды бидентатные. Рассмотрим образование некоторых комплексов с позиций теории валентных связей. Например, катион тетраамминцинка(II) [Zn(NH3)4]2 включает комплексообразователь цинк(II). Электронная оболочка этого условного иона имеет конфигурацию [Ar]3d104s04p0, которую можно изобразить следующим образом: 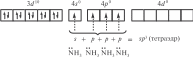 Вакантные 4s- и 4p-орбитали атома цинка(II) образуют четыре sp3гибридные орбитали, направленные к вершинам тетраэдра. Каждая молекула аммиака имеет на атоме азота неподеленную пару электронов. Орбитали атомов азота, которые содержат неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион. Таким образом, в ионе [Zn(NH3)4]2 нет неспаренных электронов — он диамагнитен. Марганец(II) в составе тетрахлороманганат(II)-иона [MnCl4]2– содержит пять неспаренных электронов на 3d-орбиталях, а также вакантные 4s- и 4p-орбитали. Вакантные sp3-гибридные орбитали марганца(II) перекрываются с p-орбиталями хлорид-ионов: 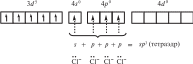 Тетраэдрический ион [MnCl4]2– парамагнитен (содержит пять неспаренных электронов). Во многих случаях метод валентных связей не позволяет предсказать тип гибридизации и геометрическую форму комплексной частицы без знания ее магнитных свойств. Например, правильно определить тип гибридизации атомных орбиталей комплексообразователя в соединениях [Ni(CO)4], [Ni(CN)4]2– и [NiBr4]2– можно, только зная, что первые две частицы диамагнитны, а третья парамагнитна. Для [Ni(CO)4] необходимо учесть отсутствие неспаренных электронов. Нейтральный атом никеля парамагнитен: 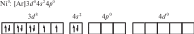 Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni0 в возбужденную диамагнитную частицу Ni*: 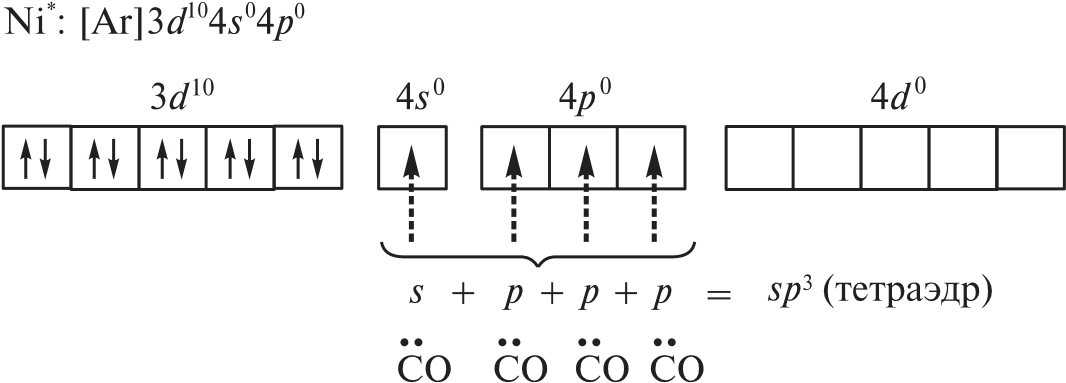 Освободившиеся вакантные орбитали подвергаются sp3-гибридизации, в результате образуется устойчивый тетраэдрический комплекс тетракарбонилникель (КЧ = 4). В парамагнитном [NiBr4]2– комплексообразователем служит никель(II) с электронной конфигурацией [Ar]3d 84s04p0, у которого для реализации КЧ = 4 достаточно вакантных орбиталей: 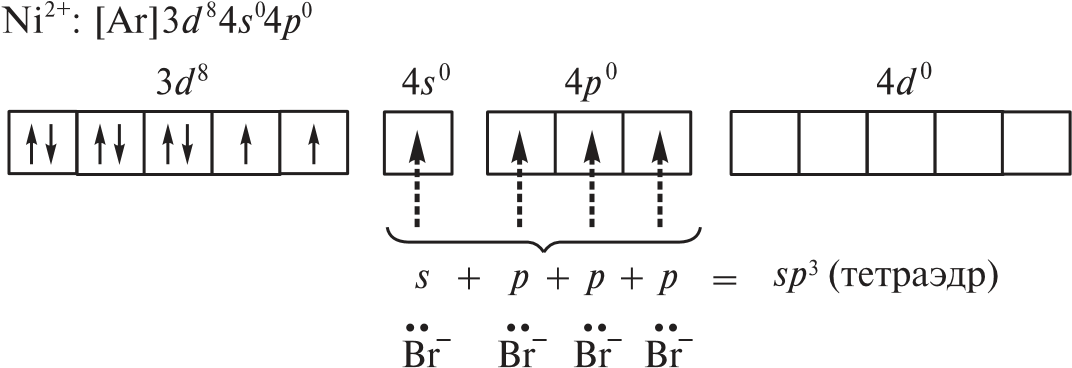 Таким образом, парамагнитный комплекс [NiBr4]2– также имеет тетраэдрическое строение, но гораздо менее устойчив, чем [Ni(CO)4]. При объединении двух электронов 3d-подуровня иона никеля(II) в пару и превращении одной из орбиталей этого подуровня в вакантную изменяется тип гибридизации и образуется устойчивый диамагнитный комплекс [Ni(CN)4]2– (КЧ = 4) — тип гибридизации dsp2, которому соответствует плоскоквадратная форма частицы. 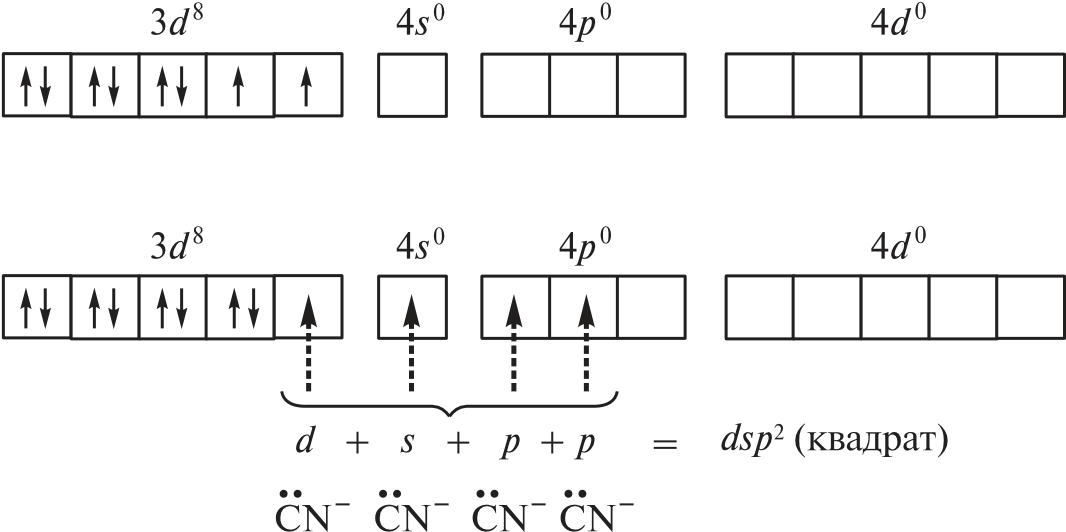  
Если синтез осуществляется в условиях избытка лиганда, координационное число никеля(II) равно пяти (dsp3-гибридизация) и формируется устойчивый диамагнитный комплекс [Ni(CN)5]3–, который имеет форму квадратной пирамиды. Октаэдрический комплекс никеля(II) [Ni(H2O)6]2 парамагнитен, но достаточно устойчив. В нем реализуется sp3d2-гибридизация атомных орбиталей никеля(II): 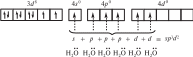 Если в гибридизации участвуют атомные орбитали внешнего d-подуровня комплексообразователя (например, при sp3d2- или sp3d-гибриди зации), комплекс называют внешнеорбитальным. Комплексы, при образовании которых в гибридизации участвуют атомные орбитали предпоследнего d-подуровня (тип гибридизации, например, d 2sp3 или dsp2), называют внутриорбитальными. Железо(II) образует и внешне-, и внутриорбитальные комплексы, например парамагнитный внешнеорбитальный гексафтороф еррат(II)-ион [FeF6]4– и диамагнитный внутриорбитальный гексациано феррат(II)-ион [Fe(CN)6]4–. 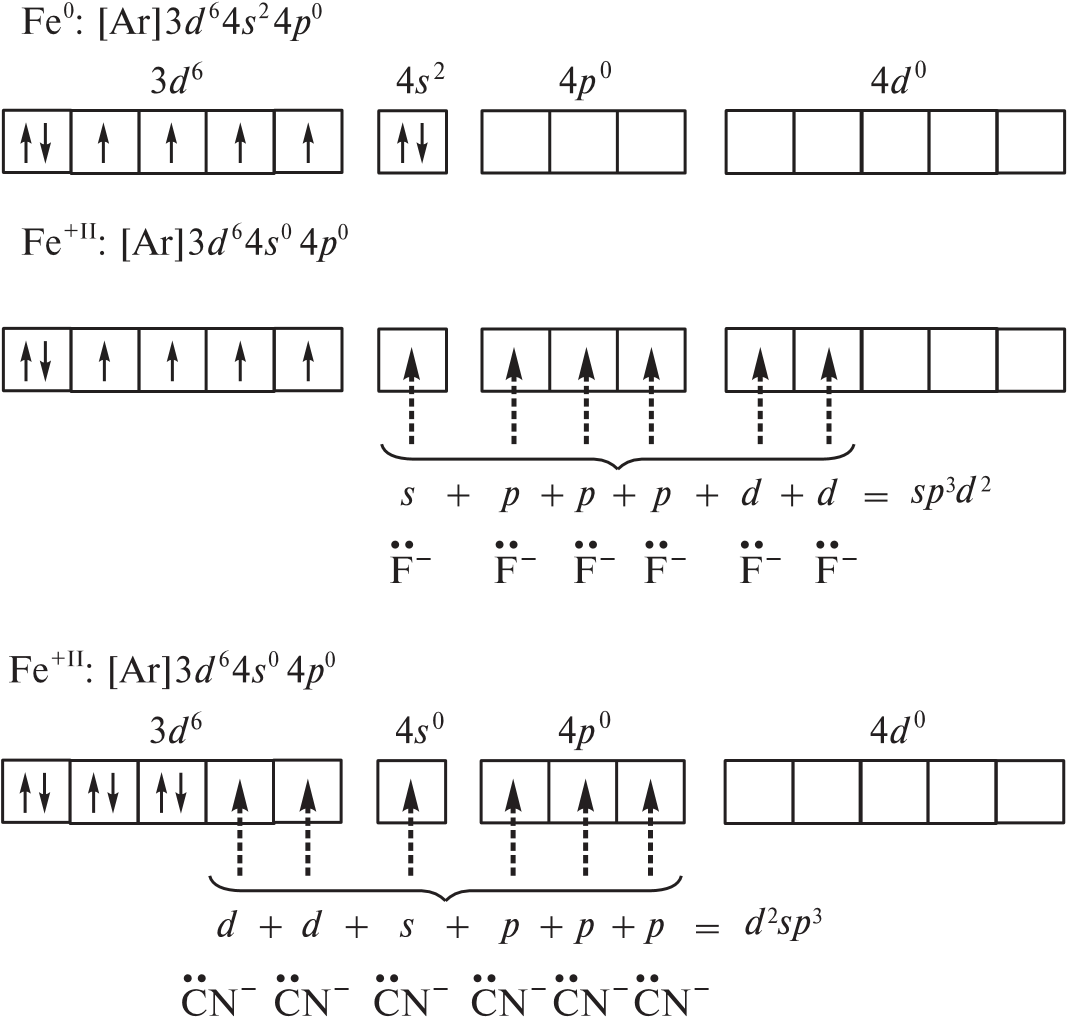 Фторид- и цианид-ионы как лиганды по-разному влияют на электроны валентных уровней атома железа. Теория валентных связей не учитывает природу лиганда, поэтому методом ВС невозможно предсказать строение таких комплексов. Таким образом, метод ВС необходимо дополнять данными о магнитных свойствах комплексного соединения и о влиянии лиганда. |
