|
|
вопросоыбиофизика. 13. Состав и структура биомембран. Модельные мембранные системы
13.Состав и структура биомембран. Модельные мембранные системы.
Наиболее важными мембранами в животных клетках являются плазматическая мембрана, внутренняя и внешняя ядерные мембраны, мембраны эндоплазматического ретикулума и аппарата Гольджи , внутренние и внешние митохондриальные мембраны. Лизосомы, пероксисомы, различные везикулы также отделены от цитоплазмы мембранами. Клетки растений содержат дополнительно мембраны хлоропластов, лейкопластов и вакуолей. Все мембраны полярны, т.е. существует различие в составах внутреннего и внешнего по отношению к цитоплазме слоев.
Структура:
Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с липидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран (см. с. 218).
Компоненты мембран удерживаются нековалентными связями (см. с. 12), вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру.
В то время как «дрейф» в плоскости мембраны происходит достаточно легко, переход белков с внешней стороны мембраны на внутреннюю («флип-флоп») невозможен, а переход липидов происходит крайне редко. Для «перескока» липидов необходимы специальные белки транслокаторы. Исключение составляет холестерин, который может легко переходить с одной стороны мембраны на другую.
Состав:
Исследования показали, что основными химическими компонентами мембран являются липиды (≈30%), белки (≈60%) и углеводы (≈10%). Минорными компонентами мембран являются нуклеиновые кислоты, полиамины, неорганические ионы.
Липиды, входящие в состав мембран, принадлежат к трем классам. Это фосфолипиды, гликолипиды и стероиды.
Фосфолипиды построены по единому плану, их молекула имеет полярную головку и два неполярных хвоста.
В состав головки фосфолипида обязательно входят:
а) остаток спирта (реже аминокислоты);
б) остаток фосфорной кислоты;
в) по вариантам либо: - глицерин (глицерофосфолипиды), - многоатомный спирт сфингозин (сфингофосфолипиды).
Неполярные хвосты всех молекул фосфолипидов образуются жирными кислотами, определяющими разнообразие их представительства. Глицерофосфолипиды мембран растительных клеток содержат в основном пальмитиновую (С16:1(9)), олеиновую (С18:1(9)), линолевую (С18:2(9,12)) жирные кислоты. Жирные кислоты с количеством атомов углерода более 20–24 в растительных клетках встречаются редко. Глицерофосфолипиды мембран животных клеток содержат пальмитиновую, олеиновую, стеариновую (С18:0) жирные кислоты, а также кислоты (арахидоновая и др.) с числом атомов углерода, превышающим 20. Обычно из двух жирных кислот, образующих гидрофобный хвост глицерофосфолипида, одна ненасыщенная. Она образует связь со вторым атомом углерода глицерина и одна из ее двойных связей обязательно находится на уровне 9-го атома углерода, считая от головки.
Остаток спирта (аминокислоты) головки глицерофосфолипида связан сложноэфирной связью с фосфорной кислотой. Глицерофосфолипид, лишенный спирта (аминокислоты), называется фосфатидной кислотой, которая является промежуточным продуктом в биосинтезе фосфолипидов и в свободном виде практически не встречается.
В зависимости от того, какой именно спирт (аминокислота) входит в состав головки молекулы, различают несколько классов глицерофосфолипидов. Самые распространенные:
- фосфатидилхолин, содержащий спирт холин;
- фосфатидилэтаноламин, содержащий спирт этаноламин;
- фосфатидилинозитол, содержащий циклический спирт инозитол;
- фосфатидилсерин, содержащий остаток гидроксиаминокислоты, – серина.
Модельные мембранные системы
Для изучения свойств индивидуальных липидов, липидных смесей и реконструированных липидно-белковых систем были созданы многочисленные модельные мембранные системы. Их можно разделить на три типа:
1) монослои;
2) плоские бислой;
3) липосомы и везикулы.
Каждая их этих систем и многие их разновидности имеют свои достоинства и недостатки, однако получаемая с их помощью информация оказалась весьма ценной при разработке концепций, связанных с изучением биологических мембран.
1. Модель – монослой липидов на границе раздела вода – воздух или вода – масло. Гидрофильные головки находятся в воде, а гидрофобные хвосты – в воздухе или в масле. Если постепенно уменьшать площадь, занимающую монослоем, то удается получить монослои, в 2 молекулы расположены так же плотно, как и в одном из монослоев мембраны. При изменении состояния липидных молекул (под действием температуры, лекарственных препаратов) меняется площадь, занимаемая молекулами. Поэтому в биологических и медицинских исследованиях широко используются монослои синтетических липидов, изолированных из различных природных мембран.
2. Бислойная липидная мембрана – создана Мюллером в 1962г. Заполнили отверстие в тефлоновой перегородке, разделяющей 2 водных раствора, фосфолипидном, растворенным в гептане. После того, как растворитель и излишки липида растекаются по тефлону, в отверстии образуется бислой толщиной несколько мм. и диаметром приблизительно 1мм: Расположив по обе стороны мембраны 2 электрода, можно измерить сопротивление мембраны или генерируемый на ней потенциал. Если по разные стороны перегородки поместить различные по химическому составу растворы, то можно изучить проницаемость мембраны для различных агентов, а так же лекарственных препаратов.
3. Липосомы – это мельчайшие пузырьки (везикулы), состоящие из билипидной мембраны и полученные обработкой ультразвуком смеси воды и фосфолипидов малые одноламелярные везикулы. Липосомы фактически являются биологической мембранной, полностью лишенной белковых молекул:
В медицине липосомы используют для доставки лекарственных веществ в однораздельные органы и ткани, приготавливая их в среде, содержащей нужное вещество. Липосомы не токсичны, полностью усваиваются в организме и являются надежной липидной микрокапсулой для направленной доставки лекарств. Они встраиваются именно в те органы которые нуждаются в лечении, что позволяет проводить целенаправленную терапию на клеточном уровне, например путем вкл. в липосому специф. антител к мембранным белкам клеток-мишеней. Без таких мер липосомы концентрируются в печени и селезенке. Используя это их свойство можно без потерь доставлять липосомы в печень и селезенку, откуда лек. в-ва будут транспортироваться. Липосомы обладают очень малой проницаемостью для ионов и большинства полярных молекул.
Большие многослойные липосомы – липиды растворяют в органическом растворителе (бензол, хлороформ) и полученный раствор упаривают в вакууме в роторном испарителе. Липиды остаются на стенках колбы в виде пленки. В колбу с пленкой + водный буферный раствор и встряхивают его. Полученные липосомы выдерживают в водной среде в течение нескольких часов для установления равновесия.
14.Особенности фазовых переходов в мембранных системах.Подвижность мембранных белков.
Физико-химические свойства мембран сильно зависят от фазового состояния липидов, которое меняется при достижении критических температурных значений фазового перехода. Температура фазового перехода увеличивается с увеличением длины цепи и уменьшается с увеличением числа двойных связей жирнокислотных остатков. Обычно в естественных условиях большинство природных липидов, содержащих ненасыщенные связи, находится в "жидком" состоянии. Точка фазового перехода для них лежит в области отрицательных температур. В гелеподобном состоянии углеводородные цепи находятся в транс-конформации, а в жидкоподобном - они разупорядочены. При плавлении углеводородная цепь частично искривляется с образованием петли, или кинка. Увеличение числа кинков способствует разупорядоченности углеводородной зоны. Кинк может смешаться вдоль углеводородной цепи за счет синхронного поворота на 120° соответствующей последовательности С - С-связей. Подобное перемещение кинка является своеобразной диффузией свободного объема, внутри которого может происходить перенос малых молекул через углеводородную зону.
Другой тип движения молекул липидов в мембранных системах - это трансмембранное движение (флип-флоп-переход). Оно осуществляется в мембранах с относительно малой скоростью вследствие высокого барьера для пересечения полярной головкой молекулы липида углеводородной зоны мембран (t = 1000 c). В мембранах электрических органов угря 3-7 мин, в мембранах эритроцитов – 20-30 мин. Отмечено, что при добавлении к мембранам клиновидных молекул, индуцирующих появление искривленных структур, а также при нарушении равновесного распределения молекул между слоями (например, при действии фосфолипаз) скорость флип-флоп-перехода резко возрастает. Очевидно, что сохранение ассиметричного распределения молекулярных компонентов возможно только при относительно медленной скорости флип-флоп переходов в этих системах.
(следующее под вопросом)
Согласно жидкостно-мозаичной модели, предложенной Nicholson–Singer, плазматическая мембрана — жидкая динамическая система с мозаичным расположением белков и липидов (рис. 2-1). В плоскости мембраны белки обладают латеральной подвижностью. Интегральные белки перераспределяются в мембранах в результате взаимодействия с периферическими белками, элементами цитоскелета, молекулами в мембране соседней клетки и компонентами внеклеточного матрикса. Подвижность интегральных белков в мембране ограничена вследствие их взаимодействия с периферическими белками и гидрофобного связывания с липидами. Основные функции плазматической мембраны: избирательная проницаемость, межклеточные взаимодействия, эндоцитоз, экзоцитоз.
Интегральные мембранные белки
Интегральные мембранные белки прочно встроены в липидный бислой. Их гидрофильные аминокислоты взаимодействуют с фосфатными группами фосфолипидов, а гидрофобные — с цепями жирных кислот. Примеры интегральных мембранных белков — белки ионных каналов и рецепторные белки (мембранные рецепторы). Молекула белка, проходящая через всю толщу мембраны и выступающая из неё как на наружной, так и на внутренней поверхности, — трансмембранный белок. Кэппинг — скопление интегральных белков в одном участке мембраны.
Периферические мембранные белки
Периферические мембранные белки (фибриллярные и глобулярные) находятся на одной из поверхностей клеточной мембраны (наружной или внутренней) и нековалентно связаны с интегральными мембранными белками. Примерами периферических мембранных белков, связанных с наружной поверхностью мембраны, могут служить рецепторные и адгезионные белки. Примеры периферических мембранных белков, связанных с внутренней поверхностью мембраны, — белки, ассоциированные с цитоскелетом (например, дистрогликаны, белок полосы 4.1, протеинкиназа С), белки системы вторых посредников.
15.Пассивный и активный транспорт веществ через мембрану. Транспорт через мембраны с участием переносчиков.
Пассивный транспорт включает простую и облегченную диффузию - процессы, которые не требуют затраты энергии. Диффузия – транспорт молекул и ионов через мембрану из области с высокой в область с низкой их концентрацией, те. вещества поступают по градиенту концентрации. Диффузия воды через полупроницаемые мембраны называется осмосом. Вода способна проходить также через мембранные поры, образованные белками, и переносить молекулы и ионы растворенных в ней веществ. Механизмом простой диффузии осуществляется перенос мелких молекул (например, О2, Н2О, СО2); этот процесс малоспецифичен и протекает со скоростью, пропорциональной градиенту концентрации транспортируемых молекул по обеим сторонам мембраны.
Облегченная диффузия осуществляется через каналы и (или) белки-переносчики, которые обладают специфичностью в отношении транспортируемых молекул. В качестве ионных каналов выступают трансмембранные белки, образующие мелкие водные поры, через которые по электрохимическому градиенту транспортируются мелкие водорастворимые молекулы и ионы. Белки-переносчики также являются трансмембранными белками, которые претерпевают обратимые изменения конформации, обеспечивающие транспорт специфических молекул через плазмолемму. Они функционируют в механизмах как пассивного, так и активного транспорта.
Активный транспорт является энергоемким процессом, благодаря которому перенос молекул осуществляется с помощью белков-переносчиков против электрохимического градиента. Примером механизма, обеспечивающего противоположно направленный активный транспорт ионов, служит натриево-калиевый насос (представленный белком-переносчиком Nа+-К+-АТФазой), благодаря которому ионы Na+ выводятся из цитоплазмы, а ионы К+ одновременно переносятся в нее. Концентрация К+ внутри клетки в 10-20 раз выше, чем снаружи, а концентрация Na наоборот. Такая разница в концентрациях ионов обеспечивается работой (Na*-K*> насоса. Для поддержания данной концентрации происходит перенос трех ионов Na из клетки на каждые два иона К* в клетку. В этом процессе принимает участие белок в мембране, выполняющий функцию фермента, расщепляющего АТФ, с высвобождением энергии, необходимой для работы насоса.
Участие специфических мембранных белков в пассивном и активном транспорте свидетельствует о высокой специфичности этого процесса. Этот механизм обеспечивает поддержание постоянства объема клетки (путем регуляции осмотического давления), а также мембранного потенциала. Активный транспорт глюкозы в клетку осуществляется белком-переносчиком и сочетается с однонаправленным переносом иона Nа+.
Облегченный транспорт ионов опосредуется особыми трансмембранными белками - ионными каналами, обеспечивающими избирательный перенос определенных ионов. Эти каналы состоят из собственно транспортной системы и воротного механизма, который открывает канал на некоторое время в ответ на изменение мембранного потенциала, (б) механическое воздействие (например, в волосковых клетках внутреннего уха), связывание лиганда (сигнальной молекулы или иона).
Мембранный транспорт веществ различается также по направлению их перемещения и количеству переносимых данным переносчиком веществ:
Унипорт - транспорт одного вещества в одном направлении в зависимости от градиента
Симпорт - транспорт двух веществ в одном направлении через один переносчик.
Антипорт - перемещение двух веществ в разных направлениях через один переносчик.
Унипорт осуществляет, например, потенциал-зависимый натриевый канал, через который в клетку во время генерации потенциала действия перемещаются ионы натрия.
Симпорт осуществляет переносчик глюкозы, расположенный на внешней (обращенной в просвет кишечника) стороне клеток кишечного эпителия. Этот белок захватывает одновременно молекулу глюкозы и ион натрия и, меняя конформацию, переносит оба вещества внутрь клетки. При этом используется энергия электрохимического градиента, который, в свою очередью создается за счет гидролиза АТФ натрий-калиевой АТФ-азой.
Антипорт осуществляет, например, натрий–калиевая АТФаза (или натрий–зависимая АТФаза). Она переносит в клетку ионы калия. а из клетки - ионы натрия. Первоначально этот переносчик присоединяет с внутренней стороны мембраны три иона Na+. Эти ионы изменяют конформацию активного центра АТФазы. После такой активации АТФаза способна гидролизовать одну молекулу АТФ, причем фосфат-ион фиксируется на поверхности переносчика с внутренней стороны мембраны.
Выделившаяся энергия расходуется на изменение конформации АТФазы, после чего три иона Na+и ион (фосфат) оказываются на внешней стороне мембраны. Здесь ионы Na+отщепляются, а замещается на два иона K+. Затем конформация переносчика изменяется на первоначальную, и ионы K+ оказываются на внутренней стороне мембраны. Здесь ионы K+ отщепляются, и переносчик вновь готов к работ.
16.Транспорт электролитов. Движущие силы переноса ионов при пассивном транспорте.
Транспорт электролитов - диффузия электрически заряженных частиц (ионов). Липидный бислой мембраны непроницаем для ионов. Они могут проникнуть через плазматическую мембрану только посредством специальных структур - ионных каналов, которые образованы интегральными белками.
Движущей силой диффузии электролитов является разность концентрации ионов внутри и вне клетки и разность электрических потенциалов, создаваемых этими ионами по обе стороны мембраны. Следовательно, диффузия электролитов определяется градиентом электрохимического потенциала (электрохимический градиент).
Зависимость потока ионов J от электрохимического градиента определяется уравнением Теорелла:

где U - подвижность ионов, C - концентрация ионов, dμ/dx - электрохимический градиент.
Уравнение Нернста-Планка с учётом двух градиентов, которые обуславливают диффузию ионов:

Ионные каналы мембраны представляют собой интегральные белки мембраны.Многие ионные каналы характеризуются высокой специфичностью. Существуют натриевые, калиевые, кальциевые и хлорные каналы. Каждый из них имеет селективный фильтр, который способен пропускать только определённые ионы. Проницаемость ионных каналов может изменяться благодаря наличию ворот, определенных групп атомов в составе белков, формирующих канал. Конформационные изменения ворот переводят канал из открытого состояния в закрытое и наоборот. Механизмы регуляции положения ворот могут отличаться в различных каналах. Некоторые из них открываются при изменениях электрического потенциала мембраны. Другие открываются под действием специфических химических веществ, выполняющих сигнальные функции.
Мембранным транспортом называют переход ионов и молекул вещества через мембрану из среды в клетку и в обратном направлении.
В зависимости от характера связи транспорта иона или молекулы с переносом др. ионов и молекул выделяют :
1) унипорт – транспорт независимо от транспорта др. соединений;
2) котранспорт – согласованный (взаимозависимый) транспорт через мембрану; к нему относят симпорт (одновременный и однонаправленный перенос двух различных веществ) и антипорт (одновременный транспорт через мембрану в противоположных направлениях).
В зависимости от изменения свободной энергии системы выделяют два типа транспорта:
Пассивный транспорт – перенос неэлектролитов и ионов через мембрану по градиенту хим. или электрохим. потенциала, сопровождающийся уменьшением свободной энергии(простую диффузию).
Активный транспорт – перенос неэлектролитов и ионов против градиента хим. или электрохим. потенциала, сопряженный с энергетическими затратами (перенос через мембрану аминокислот и моносахаридов).
Движущей силой пассивного потока ионов через мембрану служит градиент электрохимического потенциала. Электрохимический потенциал иона для условий, при которых активность иона соответствует его концентрации (с), равен:
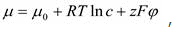
где - электрический потенциал, z – валентность иона, F - число Фарадея, 0 - стандартный химический потенциал.
Электрохимический потенциал – это мера работы, необходимой для переноса 1 моля из раствора с данной концентрацией и данным электрическим потенциалом в бесконечно удаленную точку в вакууме. Эта работа складывается из затрат на преодоление сил химического взаимодействия (0 + RTlnc) и на перенос зарядов в электрическом поле (zF).
17.Активный транспорт. Участие АТФаз в активном транспорте
веществ через мембраны. Ионные каналы. Ионная
селективность мембран.
Активный транспорт — энергозависимый трансмембранный перенос против электрохимического градиента. Различают первичный и вторичный активный транспорт. Первичный активный транспорт осуществляют насосы (различные АТФазы), вторичный — симпортёры (сочетанный однонаправленный транспорт) и антипортёры (встречный разнонаправленный транспорт).
Первичный активный транспорт. Движущая сила трансмембранного переноса возникает при ферментативном гидролизе макроэргических связей АТФ. Родовой термин для таких АТФаз (например, Na+,K+-, H+,K+-, Ca2+‑АТФазы) — насосы.
Вторичный активный транспорт. Движущая сила для трансмембранного переноса одного вещества (или ионов) против электрохимического градиента возникает за счёт потенциальной энергии, запасённой за счёт сочетанного переноса ионов (как правило, Na+) по электрохимическому градиенту. В большинстве случаев поступление Na+ в цитозоль из межклеточного пространства и обеспечивает вторичный активный транспорт разных ионов и веществ. Известно 2 типа вторичного активного переноса — симпорт и антипорт (рис. 2–6).
Первичный активный транспорт обеспечивают следующие насосы — натрий, калиевые АТФазы, протонные и калиевые АТФазы, Са2+-транспортирующие АТФазы, митохондриальные АТФазы, лизосомальные протонные насосы и др.
Натрий, калиевая АТФаза (рис. 2–11) регулирует трансмембранные потоки основных катионов (Na+, K+) и опосредованно — воды (что поддерживает постоянный объём клетки), обеспечивает Na+–связанный трансмембранный перенос (симпорт и антипорт) множества органических и неорганических молекул, участвует в создании МП покоя и генерации ПД нервных и мышечных элементов.
Протонная и калиевая АТФаза (H+,K+‑насос). При помощи этого фермента париетальные клетки желёз слизистой оболочки желудка участвуют в образовании соляной кислоты (электронейтральный обмен 2 внеклеточных ионов K+ на 2 внутриклеточных иона H+ при гидролизе одной молекулы АТФ).
H+,K+‑АТФаза — гетеродимер (2 высокомолекулярных ‑СЕ и 2 меньшей мол. массы и сильно гликозилированной ‑СЕ).
‑СЕ — главный Аг, к которому при некоторых заболеваниях (например, при витамин B12–анемиях и атрофическом гастрите) в крови циркулируют АТ.
Са2+-транспортирующие АТФазы (Са2+‑АТФазы) выкачивают ионы кальция из цитоплазмы в обмен на протоны против значительного электрохимического градиента Са2+.
Са2+‑АТФазы плазмолеммы переносят ионы кальция из цитоплазмы во внеклеточное пространство в обмен на протоны (1 H+ в обмен на 1 Ca2+ при гидролизе 1 молекулы АТФ).
Са2+‑АТФазы саркоплазматического ретикулума. Как и Са2+‑АТФазы плазмолеммы, Са2+-транспортирующие АТФазы саркоплазматического ретикулума откачивают ионы кальция из цитоплазмы (2 H+ в обмен на 2 Ca2+ при гидролизе 1 молекулы АТФ), но не во внеклеточное пространство, а во внутриклеточные депо кальция (в замкнутые межмембранные объёмы гладкой эндоплазматической сети, именуемой в скелетных МВ и кардиомиоцитах — саркоплазматический ретикулум). Недостаточность Са2+‑АТФазы саркоплазматического ретикулума проявляется симптомами мышечной усталости (миопатия) при физической нагрузке.
Митохондриальная АТФаза типа F (F0F1) — АТФ–синтаза внутренней мембраны митохондрий — катализируют конечный этап синтеза АТФ (рис. 2–12). Кристы митохондрий содержат АТФ-синтазу, сопрягающую окисление в цикле Кребса и фосфорилирование АДФ до АТФ. АТФ синтезируется при обратном токе протонов в матрикс через канал в АТФ-синтезирующем комплексе.
Ионные каналы.
Ионные каналы — порообразующие белки, поддерживающие разность потенциалов, которая существует между внешней и внутренней сторонами клеточной мембраны. Относятся к транспортным белкам. С их помощью ионы перемещаются согласно их электрохимическим градиентам сквозь мембрану. Такие комплексы представляют собой набор идентичных или гомологичных белков, плотно упакованных в липидном бислое мембраны вокруг водной поры. Каналы расположены в плазмалемме и некоторых внутренних мембранах клетки.
Свойства ионных каналов:
1. Селективность — это избирательно повышенная проницаемость ионного канала для определённых ионов и пониженная для других. Такая избирательность определяется селективным фильтром — самым узким местом канальной поры. Когда размер иона достигает критического значения, его проницаемость падает до нуля. Фильтр, кроме узких размеров, может иметь также локальный электрический заряд.
2. Управляемая проницаемость — это способность открываться или закрываться при определённых управляющих воздействиях на канал.
3. Инактивация — это способность ионного канала через некоторое время после своего открытия автоматически понижать свою проницаемость даже в том случае, когда открывший их активирующий фактор продолжает действовать.
4. Блокировка — это способность ионного канала под действием веществ-блокаторов фиксировать какое-то одно своё состояние и не реагировать на обычные управляющие воздействия. Блокировку вызывают вещества-блокаторы.
5. Пластичность — это способность ионного канала изменять свои свойства. Наиболее распространённый механизм, обеспечивающий пластичность — это фосфорилирование аминокислот канальных белков с внутренней стороны мембраны ферментами-протеинкиназами.
Ионная селективность мембран.
Селективность — это избирательно повышенная проницаемость ионного канала для определённых ионов и пониженная для других. Такая избирательность определяется селективным фильтром — самым узким местом канальной поры. Когда размер иона достигает критического значения, его проницаемость падает до нуля. Фильтр, кроме узких размеров, может иметь также локальный электрический заряд.
Теория ионообменной селективности Эйзенмана:
Сродство иона к участкам связывания в ионных каналах определяется значением свободной энергии перехода иона из раствора в канал, которое зависит от следующих факторов:
1). Проникновение иона в пору облегчается тем, что возрастание свободной энергии, обусловленное потерей гидратной оболочки (500-700 кДж/моль), компенсируется понижением энергии при взаимодействии с дипольными группами канала.
2). Проникновение в канал облегчается кулоновским взаимодействием транспортируемого катиона с фиксированным анионным центром в просвете канала. Наличие дипольных групп в канале и фиксированных зарядов приводит к тому, что энергия перехода иона из раствора в канал не превышает 30,5 кДж/моль.
Переход иона из раствора в полость канала можно формально рассматривать как перенос иона из среды с диэлектрической проницаемостью εSв среду с диэлектрической проницаемостью εPи последующее приведение иона в контакт с фиксированным отрицательным зарядом. Поэтому изменение свободной энергии при переходе одновалентного иона из среды в полость канала записывается в виде РИС 10
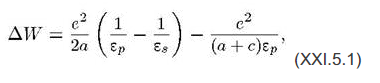
де е^2/(a+c) εP - энергия кулоновского взаимодействия иона радиуса а с фиксированным в стенке канала анионом радиуса с; => зависимость дельтаW от ионного радиуса немонотонна и весьма чувствительна к размеру фиксированного аниона. Соответственно лучше всего связываются в канале ионы, для которых изменение свободной энергии минимально.
Порядок расположения катионов щелочных металлов в рядах селективности меняется в зависимости от предполагаемого радиуса анионного центра. Для самых больших анионных радиусов энергия кулоновского взаимодействия мала и определяющим фактором является взаимодействие катиона с водой. В этом случае сродство катиона к участкам связывания в мембране возрастает с увеличением ионного радиуса в ряду связывания: Cs > Rb > К > Na > Li.
Для самых малых анионных радиусов, наоборот, преобладает притяжение катиона к фиксированному отрицательному заряду аниона и тогда в ряде связывания катионы меньшего радиуса связываются прочнее, чем крупные: Li > Na > К > Rb > Cs.
В случае проникновения через канал органических катионов важен не только их размер, но и способность образовывать водородные связи. Так, из гидроксиламина, гидразина и метиламина — метиламин
практически не проходит через Na+-канал, так как не образует водородных связей с атомами кислорода в выстилающих группировках канала.
18.Электропроводность клеток и тканей. Электропроводность клеток и тканей для постоянного и переменного токов.
Электропроводность клеток и тканей для постоянного тока
Электропроводность L – это величина, обратная сопротивлению проводника (R):
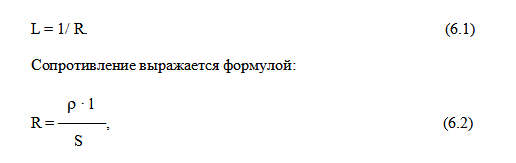
где: ρ – удельное сопротивление; l – длина проводника; S – площадь его поперечного сечения. Сопротивление – это коэффициент пропорциональности между разностью потенциалов (или напряжением) V и силой тока I:

При пропускании постоянного тока через живые ткани было установлено, что сила тока не остается постоянной, хотя напряжение при этом не изменяется. Сила тока после наложения разности потенциалов непрерывно снижается и через некоторое время устанавливается на постоянном уровне. При этом сила тока может снижаться в сотни и тысячи раз по сравнению с исходным значением. Такое изменение силы тока является отклонением от закона Ома (рис. 6.1).
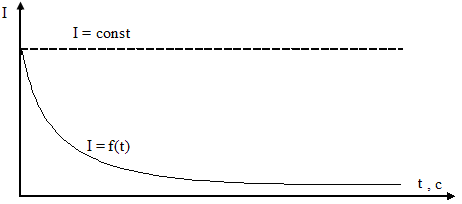
Рис.6.1. Зависимость изменения силы тока в зависимости от времени для живых систем.
Снижение силы тока обусловлено явлением поляризации. При прохождении постоянного тока через биологическую систему в ней возникает нарастающая до некоторого предела электродвижущая сила (ЭДС) противоположного направления. Эта сила называется ЭДС поляризации, которая снижает приложенную к объекту эффективную ЭДС. Это приводит к уменьшению силы тока. ЭДС поляризации Р(t) является функцией времени. В данном случае закон Ома для биологических систем записывается в виде:

Возникновение ЭДС поляризации связано со способностью живых клеток накапливать заряды при прохождении через них постоянного тока, то есть – с электрической емкостью биологических объектов.
Биологические объекты обладают свободными и связанными зарядами. Свободные заряды – это электроны и ионы. Под действием электрического поля они перемещаются от одного электрода к другому. В живых клетках ионы могут перемещаться в ограниченных пределах – от одной клеточной мембраны до другой. Связанные заряды – это заряды, способные под действием поля перемещаться в очень незначительных пределах, намного меньших, чем свободные заряды. При перемещении заряды способны создавать токи смещения.
Процесс перемещения связанных зарядов под действием электрического поля и образование вследствие этого ЭДС, направленной против внешнего поля, называется поляризацией.
Электропроводность клеток и тканей для переменного тока
Биологические системы способны накапливать электрические заряды при прохождении через них переменного тока, поэтому для описания их свойств наряду с сопротивлением используют понятия электрической емкости (С):
С = Δq/Δφ, (6.9)
где: Δq – изменение заряда; Δφ – изменение потенциала.
Электрическая емкость объекта при равных условиях его геометрии определяется диэлектрической проницаемостью, которая описывает все явления поляризации в биообъекте:
ε · S
С = ————, (6.10)
4 π · d
где: С – электрическая емкость; S – площадь поверхности (или пластин конденсатора); d – расстояние между поверхностями (или пластинами); ε – диэлектрическая проницаемость.
Емкость биообъекта определяется поляризационной емкостью, которая возникает в момент прохождения электрического тока. Она отражает отношение изменения заряда объекта к изменению его потенциала при прохождении через биообъект переменного тока. Изменение заряда за время t определяется по формуле:
Δq = о∫t I · dt; (6.11)
изменение потенциала:
Δφ = R · (IO – It); (6.12)
о∫t I · dt
тогда поляризационная емкость СР = —————, (6.13)
R · (IO – It)
где: IO и It – начальное и конечное значение силы тока; I – мгновенный ток; R – сопротивление.
К поляризационной емкости биообъекта присоединяется большая по величине статическая емкость мембраны (около 1 мкф/см2). Величина поляризационной емкости (уравнение 6.13) зависит от времени действия внешнего поля и может при низкой частоте превышать величину статической емкости.
При высокой частоте тока (более 10 кГц) статическая емкость на несколько порядков превышает поляризационную емкость. Поскольку данные емкостные части систем соединены последовательно, то при высокой частоте общая величина емкости определяется меньшей составляющей, то есть поляризационной емкостью. Поскольку биообъекты обладают проводимостью и емкостью, они характеризуются “активным” и “реактивным” сопротивлением. “Реактивное” емкостное сопротивление RX определяется по формуле:
RX = 1/ω · C, (6.14)
где: ω – частота тока. Суммарное сопротивление биообъектов называют импеданс.
Электрическая модель биообъекта может быть представлена в виде эквивалентных схем с последовательным и параллельным сопротивлением С и R (рис.6.4):
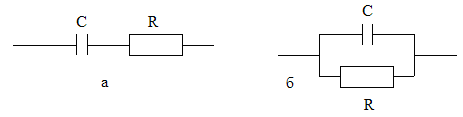
Рис.6.4. Последовательное (а) и параллельное (б) соединение емкостного и обычного сопротивления.
Для последовательного соединения С и R импеданс определяют по формуле:
Z = R – i · 1/ω · C или по формуле: Z2 = R2 + 1/(ω2 · C2); (6.15)
для параллельного – по формуле:
1/Z = 1/R + i · ω · C,
где: Z – импеданс; i – мнимая единица, то есть (-1)1/2. Импеданс биообъектов зависит от частоты тока: при увеличении частоты реактивная составляющая импеданса уменьшается. Такая зависимость является одной из причин дисперсии импеданса.
При изучении частотных зависимостей сопротивления и емкости биообъектов было обнаружено три области дисперсии (рис.6.5).
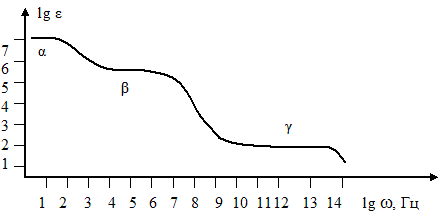
Рис.6.5. Три области дисперсии импеданса.
1.α – Дисперсия занимает область низких частот звукового диапазона, примерно до 1 кГц. В этой области уменьшение диэлектрической проницаемости биосистем обусловлено уменьшением эффекта поляризации поверхности клеток, поскольку электрический ток с частотой до 1 кГц протекает только по межклеточным структурам. Сопротивление самих клеток для токов такой частоты очень велико.
Явления поляризации, происходящие на биологических поверхностях, аналогичны явлениям поляризации на электродах. В обоих случаях поляризация возникает за счет перераспределения ионов в двойном электрическом слое. В таком случае поверхностная поляризация сводится к электрической поляризации.
По мере увеличения частоты тока эффект поверхностной поляризации уменьшается. Это проявляется как снижение диэлектрической проницаемости и сопротивления клеток.
2.β – Дисперсия занимает область частот 1,0 – 104 кГц. В данной области электрические свойства биообъектов наиболее полно описываются с помощью мактроструктурной поляризации. Она вызвана наличием не только клеточной мембраны, но и мембранными структурами в цитоплазме клетки.
Если в данном случае применить электрохимическую теорию, то сущность состоит в перераспределении ионов на границе макроструктурного объема. В данном случае протекает электролитическая поляризация границы раздела фаз.
На достаточно высоких частотах, порядка нескольких мегагерц, поляризация границ раздела, то есть мембран, будет отсутствовать.
3.γ – Дисперсия наблюдается на частотах свыше 103 мГц. Уменьшение диэлектрической проницаемости в данном диапазоне обусловлено ослаблением эффекта поляризации, вызванной диполями воды. Величина γ – дисперсии будет зависеть от содержания свободной воды в исследуемой ткани.
В области сверхвысоких частот (> 104 мГц) эффект поляризации, обусловленной диполями воды, будет отсутствовать. Диэлектрическая проницаемость будет иметь небольшие значения, которые определяются ионной и электронной поляризацией с самым небольшим временем релаксации.
На три основные дисперсионные явления (α –, β –, γ –), обусловленные поверхностной поляризацией, макроструктурной и дипольной поляризацией воды, накладываются дополнительные эффекты:
1.Поляризация белков и других органических молекул, обладающих дипольными моментами. Дисперсия данного вида поляризации происходит при частотах в несколько мегагерц.
2.Поляризация гидратных оболочек макромолекул. Дисперсия наблюдается в диапазоне частот 10,0 – 100,0 мГц.
3.Поляризация связанных полярных групп макромолекул. Область дисперсии данного вида поляризации наблюдается в диапазоне 100,0 – 1000,0 мГц. |
|
|
 Скачать 66.56 Kb.
Скачать 66.56 Kb.