физика 16-19. 16. Спектры излучения атомов
 Скачать 105.11 Kb. Скачать 105.11 Kb.
|
|
16.Спектры излучения атомов Спектр излучения атома представляет собой набор спектральных линий. Спектральная линия появляется в результате монохроматического светового излучения при переходе электрона с одного электронного подуровня на другой подуровень разных уровней. Это излучение характеризуется длиной волны К, частотой v или волновым числом со. Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга: ,где R = 109 677 см−1 — постоянная Ридберга для водорода, — основной уровень серии. Спектральные линии возникающие при переходах на основной энергетический уровень называются резонансными, все остальные — субординатными. Серия Лаймана —Данная серия образуется при переходах электронов с возбуждённых энергетических уровней на первый в спектре излучения и с первого уровня на все остальные при поглощении. Переход со второго энергетического уровня на первый обозначается греческой буквой α, с 3-го на 1-й — β и т. д. Для обозначения самой серии используется латинская буква L. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона со второго уровня на первый — Lα (произносится Лайман альфа). Формула Ридберга для серии Лаймана выглядит следующим образом: Где n — главное квантовое число — натуральное число большее либо равное 2. Се́рия Ба́льмера — спектральная серия, наблюдающаяся для атомов водорода. Образование серии Бальмера Данная серия образуется при переходах электронов с возбужденных энергетических уровней c главным квантовым числом n>2 на второй уровень (n=2) в спектре излучения и со второго уровня на все вышележащие уровни при поглощении. Переход с третьего энергетического уровня на второй обозначается греческой буквой α, с 4-го на 2-й — β и т. д.. Для обозначения самой серии используется латинская буква H. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона с третьего уровня на второй — Hα (произносится Бальмер альфа). Формула Бальмера Для описания длин волн λ четырех видимых линий спектра водорода И. Бальмер предложил формулу где n = 3, 4, 5, 6; b = 3645,6 Å. R ≈ 1,0974·107 м−1 — постоянная Ридберга, Се́рия Паше́на (Серия Ритца — Пашена) — спектральная серия в спектре атома водорода. Данная серия образуется при переходах электронов с возбужденных энергетических уровней на третий в спектре излучения и с третьего уровня на все вышележащие уровни при поглощении. Переход с четвёртого энергетического уровня на третий обозначается греческой буквой α, с 5-го на 3-й — β и т. д. Для обозначения самой серии используется латинская буква P. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона с четвёртого уровня на третий — Pα (произносится Пашен альфа). Формула Ридберга для серии Пашена выглядит следующим образом: Все линии серии Пашена расположены в инфракрасном диапазоне. Постоянная Ридберга — величина, введённая Ридбергом, входящая в уравнение для уровней энергии и спектральных линий. 17 Планетарная модель атома, или модель Резерфорда – Он предложил планетарную модель атома состоящую из тяжелого ядра вокруг которого по орбиталям подобно планетам солнечной системы движутся электроны.Планетарная модель противоречила факту устойчивого сущ. атомов т.к. на ускоренное движение электрона расходуется энергия электростатич. взаимод. Электрона с зарядом, электрон должен двигаться по спирали и упасть на ядро, что равносильно ликвидации атома. Постулаты Модель атома Бора Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн. Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам, для которых момент импульса квантуется: , где — натуральные числа, а — постоянная Планка. Пребывание электрона на орбите определяет энергию этих стационарных состояний. При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии , где — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается. Правило квантования момента импульса: Далее исходя из соображений классической физики о круговом движении электрона вокруг неподвижного ядра по стационарной орбите под действием кулоновской силы притяжения, Бором были получены выражения для радиусов стационарных орбит и энергии электрона на этих орбитах: Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]: 18. Корпускуля́рно-волново́й дуали́зм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций. Дальнейшим развитием принципа корпускулярно-волнового дуализма стала концепция квантованных полей в квантовой теории поля. Как классический пример, свет можно трактовать как поток корпускул (фотонов), которые во многих физических эффектах проявляют свойства электромагнитных волн. Свет демонстрирует свойства волны в явлениях дифракции и интерференции при масштабах, сравнимых с длиной световой волны. Например, даже одиночные фотоны, проходящие через двойную щель, создают на экране интерференционную картину, определяемую уравнениями Максвелла[1]. Тем не менее, эксперимент показывает, что фотон не есть короткий импульс электромагнитного излучения, например, он не может быть разделён на несколько пучков оптическими делителями лучей, что наглядно показал эксперимент, проведённый французскими физиками Гранжье, Роже и Аспэ в 1986 году[2]. Корпускулярные свойства света проявляются при фотоэффекте и в эффекте Комптона. Фотон ведет себя и как частица, которая излучается или поглощается целиком объектами, размеры которых много меньше его длины волны (например, атомными ядрами), или вообще могут считаться точечными (например, электрон). В настоящий момент концепция корпускулярно-волнового дуализма представляет лишь исторический интерес, так как служила только интерпретацией, способом описать поведение квантовых объектов, подбирая ему аналогии из классической физики. На деле квантовые объекты не являются ни классическими волнами, ни классическими частицами, приобретая свойства первых или вторых лишь в некотором приближении. Методологически более корректной является формулировка квантовой теории через интегралы по траекториям (пропагаторная), свободная от использования классических понятий. Дифракция электронов — процесс рассеяния электронов на совокупности частиц вещества, при котором электрон проявляет свойства, аналогичные свойствам волны. При выполнении некоторых условий, пропуская пучок электронов через материал можно зафиксировать дифракционную картину, соответствующую структуре материала. Процесс дифракции электронов получил широкое применение в аналитических исследованиях кристаллических структур металлов, сплавов, полупроводниковых материалов. Опыт Томсона–Тартаковского по дифракции электронов на тонкой поликристаллической пленке Другой опыт, подтвердивший волновые свойства материальных частиц, был проведен в 1928 году Джорджем Паджетом Томсоном (1892–1975), а также независимо за год до него Петром Савичем Тартаковским (1895–1940). В нем использовалась еще одна техника, развитая прежде в рентгеноструктурном анализе, а именно, метод Дебая–Шерера. В этом методе используется уже поликристаллическая пластинка L, через которую пропускают электронный пучок высокой энергии и затем наблюдают дифракционную картину на стоящей за поликристаллом фотопластинке P (см. рис. ниже). В отличие от монокристалла, использовавшегося в эксперименте Дэвиссона–Джермера, поликристалл состоит из маленьких кристалликов, внутри которых имеет место строгий порядок; сами же кристаллики расположены беспорядочно друг по отношению к другу. 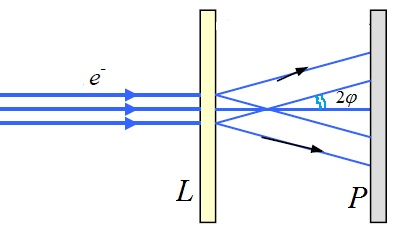 Если бы не было дифракционных эффектов, кристаллики рассеивали бы свет во всех стороны. Однако, условие Брэгга–Вульфа (см. предыдущий вопрос) говорит, что отражение электронного пучка от грани кристаллика происходит тогда, когда угол гол, на который в результате рассеивается падающий пучок, составляет При этом дифракционная картина имеет вид концентрических окружностей (см. рис.). Данное явление было хорошо изучено в случае рентгеновского излучения, а Томсон и Тартаковский исследовали случай пучка электронов. Томсон использовал электроны гораздо более высоких энергий, чем Дэвиссон и Джермер, чтобы на пластинке уместилось хотя бы несколько дифракционных кругов и чтобы заметная часть пучка прошла через поликристалл (для электронов низких энергий он становится практически непрозрачным). Действительно, даже для электронов с энергией, равной десяткам кЭв, поликристаллическая пластинка подбиралась очень тонкой — всего лишь десятые и сотые доли микрометра! Это в десятки-сотни раз меньше длины волны видимого света. Монохроматический пучок таких электронов обладал длиной волны менее ангстрема, благодаря чему наблюдалась желаемая дифракция. Далее, аналогично опыту Дэвиссона–Джермера, исследовалась зависимость длины волны электрона от их кинетической энергии. Кроме того, полученное из измерения радиусов дифракционных колец расстояние между кристаллическими плоскостями частиц поликристалла сравнивалось с результатами опытов с рентгеновскими лучами. Результаты совпали, что говорило в пользу единства свойств пучка электронов и электромагнитной волны высокой частоты. 19 Принцип неопределённости Гейзенбе́рга (или Га́йзенберга) в квантовой механике — фундаментальное неравенство (соотношение неопределённостей), устанавливающее предел точности одновременного определения пары характеризующих квантовую систему физических наблюдаемых (см. физическая величина), описываемых некоммутирующими операторами (например, координаты и импульса, тока и напряжения, электрического и магнитного поля). Соотношение неопределенностей[* 1] задаёт нижний предел для произведения среднеквадратичных отклонений пары квантовых наблюдаемых. Принцип неопределённости, открытый Вернером Гейзенбергом в 1927 г., является одним из краеугольных камней квантовой механики. |
