2Билет Плазмиды — внехромосомные мобильные генетические структур. 2Билет Плазмиды
 Скачать 421.5 Kb. Скачать 421.5 Kb.
|
|
2) Типы генов (все типы генов, Особенно про то, откуда и как нам взять встраиваемый ген) Селективные и репортерные гены Ввести рекомбинантный ген в клетку можно 2 способами: используя вектора или путем прямого введения. Требования к векторной ДНК, ее состав Вектор - молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена. Таким образом, вектор должен быть небольшим, способным поддерживаться в клетке-хозяине (реплицироваться), многократно копироваться (ампфлицироваться), экспрессировать соответствующий ген (содержать соответствующие регуляторные последовательности), должен иметь маркерный ген, позволяющий различать гибридные клетки для эффективной селекции их; должен быть способен передаваться в клетку соответствующего организма. Регуляторные последовательности, отвечающие за стабильную экспрессию гена, будут рассмотрены позднее. Можно выделить 2 группы маркерных генов, позволяющие отличить трансформированные клетки: 1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток. 2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. Чаще всего в качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT). К настоящему времени из этого арсенала наиболее часто используют гены GUS и GFP и, в меньшей степени, LUC и CAT. Используемый в настоящее время как репортерный ген GUS является модифицированным геном из Escherichia coli, кодирующим β-глюкуронидазу с молекулярной массой 68 кД. GUS активен в широком диапазоне условий среды с оптимумом при рН 5-8 и 37°С. Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (например, в синий цвет). Фермент достаточно стабилен: он устойчив к нагреванию (время полужизни при 55°С составляет около 2 ч) и к действию детергентов. В процессе замораживания-оттаивания потери активности GUS не происходит. В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность. В живых клетках белок GUS также весьма стабилен и активен от нескольких часов до нескольких суток. GFP (green fluorescent protein - зеленый флюоресцентный белок, или белок зеленой флюоресценции) был обнаружен Shimomura с соавт. в 1962 г. у люминесцирующей медузы Aequorea victoria. Ген GFP был клонирован в 1992 г. Prasher и соавт., и уже через несколько лет началось активное использование этого гена как репортерного в работах с самыми разными про- и эукариотическими организмами. В настоящее время ген GFP применяется в сотнях работ во всем мире, и число их стремительно нарастает. Столь быстрый рост вызван особыми свойствами белка GFP, а именно его способностью флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ. Эта флюоресценция обусловлена непосредственно белком, для ее проявления не требуется субстратов или кофакторов. Благодаря этому свойству ген GFP является очень перспективным репортерным геном, позволяющим проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами. Многочисленные производные GFP получили общее название AFP (autofluorescent proteins - автофлюоресцентные белки). Из морской анемоны Discosoma sp. недавно выделен еще один белок DsRed, флуоресцирующий в красном свете. Еще несколько аналогичных флюоресцирующих белков было выделено в самое последнее время учеными Российской академии наук из различных коралловых полипов порядка Anthozoa. Он может быть денатурирован очень высокой температурой, крайними значениями рН или сильными восстановителями типа Na2SO4. При возвращении к физиологическим условиям GFP в значительной степени восстанавливает способность к флюоресценции. В составе химерных белков, созданных генноинженерными методами, GFP обычно сохраняет свою функциональную активность. В живых клетках белок GFP также очень стабилен. CAT – гены отвечают за синтез хлорамфениколацетилтрансферазы (выделены из Escherihia coli). Этот фермент катализирует реакцию переноса ацетильной группы от ацетил-КоА к хлорамфениколу. Определяется гистохимически, по изменению окраски ткани при добавлении соответствующего субстрата. LUC – ген кодирует фермент люциферазу (клонирована из бактерий и светлячка). Она вызывает свечение трансформированных клеток. Бактериальный фермент состоит из двух субъединиц. Для определения активности ферментов необходимо специальное оборудование - флуориметр и цифровая видеокамера с амплификатором светового сигнала. Фермент теряет активность при действии детергентов и повышенной температуры. Замена селективных генов на репортерные при отборе трансгенных растений часто весьма желательна, так как возможность потенциального риска для окружающей среды и здоровья человека при использовании репортерных генов практически исключена. Однако область применения репортерных генов шире, чем просто контроль трансгеноза. Другое, и, очевидно, более важное назначение репортерных генов состоит в том, чтобы выявлять (по возможности количественно) временные и пространственные особенности экспрессии данного конкретного гена, будь то собственного или чужеродного. Присоединение репортерного гена к одной лишь промоторной области позволяет исследовать в "чистом виде" ее роль в регуляции экспрессии изучаемого гена на уровне транскрипции. Замена белок-кодирующей области гена на репортерную при сохранении участка, кодирующего 5'-концевую не транслируемую последовательность мРНК, позволяет оценить роль этой последовательности в процессах транспорта мРНК из ядра в цитоплазму и инициации трансляции. Билет 7(это не точно) генетическая инженерия - источник днк для клонирования (Помню что спрашивала как выделить ген из днк. Ген который собираемся клонировать) 1. Фрагменты генетического материала различных организмов. 2. Ферментативный синтез генов на основе выделенной из клетки матричной РНК (мРНК). Пробные копии применяются для экспрессии в бактериях важных с медицинской точки зрения белков человека и животных (инсулин, ренин, гормон роста и др.). Фрагменты генома нельзя использовать, так как у эукариот отдельные части некоторых структурных генов разобщены: кодирующие последовательности (экзоны) чередуются с не кодирующими вставочными последовательностями (интроны). Ген целиком транскрибируется с образованием первичного транскрипта РНК, затем транскрипты интронов выщепляются, а последовательности соответствующие энзонам, сшиваются с образованием мРНК. Этот процесс созревания РНК называется сплайсингом. Прокариоты не способны к нему. 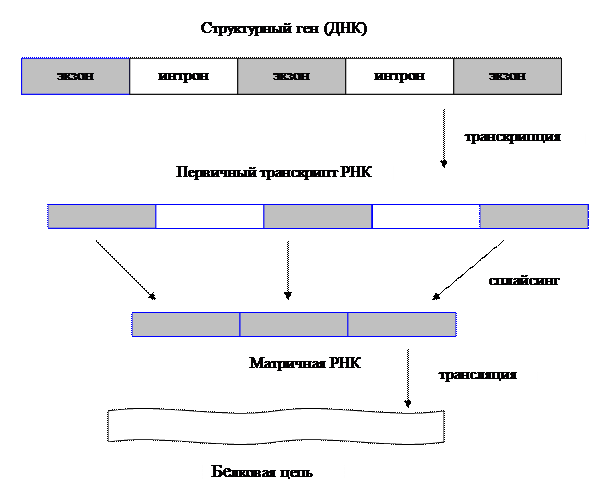 Рис. 1. Схема экспрессии у эукариот Это наиболее популярный метод синтеза генов. Обратная транскриптаза (ревертаза) катализирует синтез нити ДНК, комплементарной мРНК. Полученную одноцепочечную ДНК, называемую комплементарной ДНК или кДНК, используют в качестве матрицы для синтеза второй нити ДНК с применением ДНК-полимеразы или ревертазы. Преимущество рассматриваемого метода состоит в том, что ген получается без интронов и других нетранскрибируемых последовательностей. Помимо этого, легче создать условия, когда клетка аккумулирует нужный вид мРНК, чем отбирать ген из смеси фрагментов ДНК. Большим успехом в применении метода является получение в 1979 г. гена гормона роста человека (соматотропина). 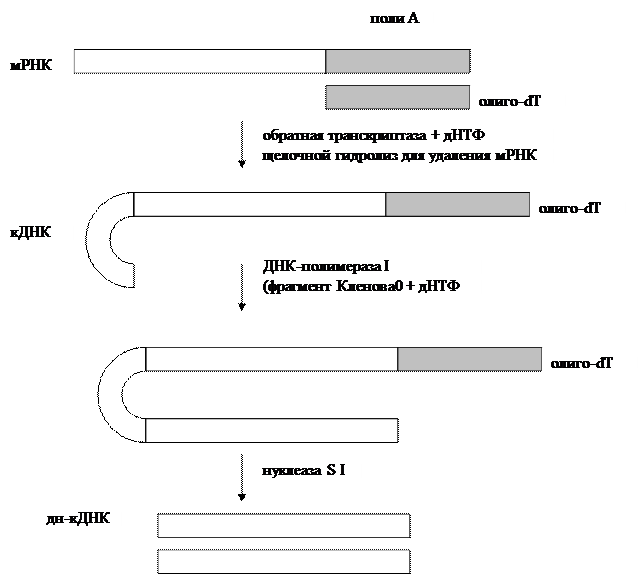 Рис. 2. Синтез двунитевой копии ДНК по матрице зрелой информационной РНК. Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А)-содержащих мРНК используют олигo-dT, а для молекул РНК, не имеющих З'-поли (А) концов, — химически синтезированные олигонуклеотиды, комплементарные З'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера. Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E. coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований. Репликацию ДНК осуществляет фермент ДНК-полимераза. Этот фермент способен наращивать ДНК только на 3΄– конце. Вы помните, что молекула ДНК антипараллельна, разные ее концы называются 3΄-конец и 5΄ - конец. При синтезе новых копий на каждой нити одна новая нить удлиняется в направлении от 5΄ к 3΄ , а другая – в направлении от 3΄ к 5-концу. Однако 5΄ конец ДНК-полимераза наращивать не может. Поэтому синтез одной нити ДНК, той, которая растет в "удобном" для фермента направлении, идет непрерывно (она называется лидирующая или ведущая нить), а синтез другой нити осуществляется короткими фрагментами (они называются фрагментами Оказаки в честь ученого, который их описал). Потом эти фрагменты сшиваются, и такая нить называется запаздывающей, в целом репликация этой нити идет медленней. Структура, которая образуется во время репликации, называется репликативной вилкой. 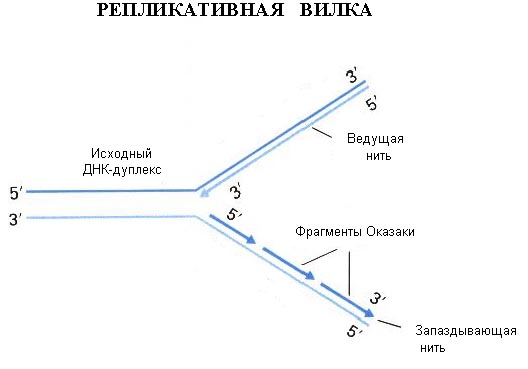 Если мы посмотрим в реплицирующуюся ДНК бактерии, а это можно наблюдать в электронном микроскопе, мы увидим, что у нее вначале образуется "глазок", затем он расширяется, в конце концов вся кольцевая молекула ДНК оказывается реплицированной. Процесс репликации происходит с большой точностью, но не абсолютной. Бактериальная ДНК-полимераза делает ошибки, то есть вставляет не тот нуклеотид, который был в матричной молекуле ДНК, примерно с частотой 10-6. У эукариот ферменты работают точнее, так как они более сложно устроены, уровень ошибок при репликации ДНК у человека оценивается как 10-7 – 10 -8 . Точность репликации может быть разной на разных участках геном, есть участки с повышенной частотой мутаций и есть участки более консервативные, где мутации происходят редко. И в этом следует различать два разных процесса: процесс появления мутации ДНК и процесс фиксации мутации. Ведь если мутации ведут к летальному исходу, они не проявятся в следующих поколениях, а если ошибка не смертельна, она закрепится в следующих поколениях, и мы сможем ее проявление наблюдать и изучить. Еще одной особенностью репликации ДНК является то, что ДНК-полимераза не может начать процесс синтеза сама, ей нужна «затравка». Обычно в качестве такой затравки используется фрагмент РНК. Если речь идет о геноме бактерии, то там есть специальная точка называемая origin (исток, начало) репликации, в этой точке находится последовательность, которая распознается ферментом, синтезирующим РНК. Он относится к классу РНК-полимераз, и в данном случае называется праймазой. РНК-полимеразы не нуждаются в затравках, и этот фермент синтезирует короткий фрагмент РНК – ту самую «затравку», с которой начинается синтез ДНК. 2.применение метода пцр ПЦР используется во многих областях для проведения анализов и в научных экспериментах. Криминалистика Самым уникальным является определение генотипа Установление отцовства  Рис. 3: Результаты электрофореза ДНК-фрагментов, амплифицированных с помощью ПЦР. (1) Отец. (2) Ребенок. (3) Мать. Ребенок унаследовал некоторые особенности генетического отпечатка обоих родителей, что дало новый, уникальный отпечаток. Хотя «генетические отпечатки пальцев» уникальны (за исключением случая однояйцевых близнецов), родственные связи все же можно установить, сделав несколько таких отпечатков (рис. 3). Тот же метод можно применить, слегка модифицировав его, для установления эволюционногородства среди организмов. Медицинская диагностика ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных и вирусныхзаболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют (определяют последовательность его нуклеотидов) для определениямутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы до того, как проявятсясимптомызаболевания. Результат ПЦР-диагностики обычно готов через 1,5-2 суток после забора материала ПЦР имеет неоценимое значение в диагностике ИППП, генитального кандидоза, вирусного гепатита, туберкулеза. Персонализированная медицина Иногда лекарства оказываются токсичными или аллергенными для некоторых пациентов. Причины этого — отчасти в индивидуальных различиях в восприимчивости и метаболизмелекарств и их производных. Эти различия детерминируются на генетическом уровне. Например, у одного пациента определенныйцитохром(белок печени, отвечающий за метаболизм чужеродных веществ) может быть более активен, у другого — менее. Для того, чтобы определить, какой разновидностью цитохрома обладает данный пациент, предложено проводить ПЦР-анализ перед применением лекарства.Такой анализ называют предварительнымгенотипированием(англ.prospective genotyping). Клонирование геновКлонирование генов(не путать склонированиеморганизмов) — это процесс выделения генов и, в результатегенноинженерных манипуляций, получения большого количества продукта данного гена. ПЦР используется для того, чтобы амплифицировать ген, который затем вставляется ввектор — фрагмент ДНК, переносящий чужеродный ген в тот же самый или другой, удобный для выращивания, организм. В качестве векторов используют, например, плазмидыили вирусную ДНК. Вставку генов в чужеродный организм обычно используют для получения продукта этого гена — РНК или, чаще всего, белка. Таким образом в промышленных количествах получают многие белки для использования в сельском хозяйстве, медицине и др. 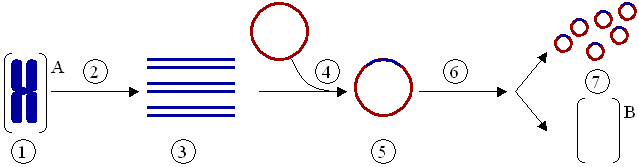 Рис. 4: Клонирование гена с использованием плазмиды. . (1) Хромосомная ДНК организма A. (2) ПЦР. (3) Множество копий гена организма А. (4) Вставка гена в плазмиду. (5) Плазмида с геном организма А. (6) Введение плазмиды в организм В. (7) Умножение количества копий гена организма А в организме В. Секвенирование ДНК В методе секвенирования с использованием меченых флуоресцентной меткой или радиоактивным изотопомдидезоксинуклеотидов ПЦР является неотъемлемой частью, так как именно в ходе полимеризации в цепь ДНК встраиваются производные нуклеотидов, меченые флуоресцентной или радиоактивной меткой. Это останавливает реакцию, позволяя определить положения специфических нуклеотидов после разделения синтезированных цепочек в геле. МутагенезВ настоящее время ПЦР стала основным методом проведения мутагенеза (внесения изменений в нуклеотидную последовательность ДНК). Использование ПЦР позволило упростить и ускорить процедуру проведения мутагенеза, а также сделать её более надёжной и воспроизводимой. Билет 8 генетическая инженерия Технология внедрения ДНК в векторы 2. Сущность амплификации, методы ее проведения. Hot start PCR. Амплификация в молекулярной биологии – увеличение числа копий ДНК. В клетке амплификация происходит в результате репликации ДНК. В искусственных условиях увеличения числа копий ДНК добиваются с помощью полимеразной цепной реакции (рис. 2). Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается. В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Таким образом, происходит накопление ампликонов в растворе по формуле 2n, где n – число циклов амплификации. Если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30–40 циклов в растворе накапливается около 108 молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле после соответствующего окрашивания. 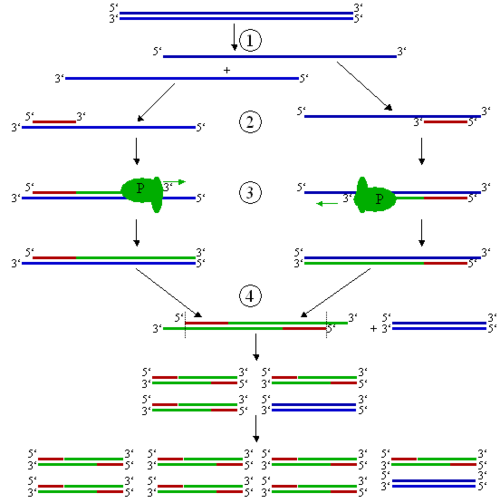 Рис. 2. Схематическое изображение первого цикла ПЦР. (1) - Денатурация при 94–96 °C; (2) - Отжиг при 68 °C ; (3) - Элонгация при 72 °C (P-полимераза); (4) - Закончен первый цикл. Двунитевые фрагменты ДНК, равные по длине расстоянию между двумя праймерами, начинают накапливаться после третьего цикла. В ходе первого цикла ПЦР цепи ДНК служат матрицами для второго цикла амплификации, в котором происходит образование искомого специфического фрагмента нуклеиновой кислоты генома вируса, бактерий или человека. В последующих циклах амплификации ампликоны служат матрицей для синтеза все новых и новых цепей. Таким образом, происходит накопление ампликонов в реакционном растворе в геометрической прогрессии. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя. |
