6. Патофизиология сердечнососудистой системы. Аритмии. Сердечная недостаточность
 Скачать 200.83 Kb. Скачать 200.83 Kb.
|
|
ТЕМА 6. Патофизиология сердечно-сосудистой системы. Аритмии. Сердечная недостаточность ЭТИОЛОГИЯ И ОСНОВНЫЕ МЕХАНИЗМЫ НАРУШЕНИЙ РИТМА СЕРДЦА (АРИТМИИ) Аритмия (а — отрицаниечего-либо,греч. rhytmos — теку) — типовая форма патологии сердца, характеризующаяся нарушением частоты и периодичности генерации импульсов возбуждения и (или) последовательности возбуждения предсердий и желудочков. Возникновение аритмий чаще всего ассоциируется с наличием органического заболевания сердца различной этиологии — ишемии, воспаления, дегенеративных изменений, токсического поражения. Однако их регистрируют также у лиц с практически здоровым сердцем, у которых с помощью современных методов исследования не выявляют какой-либопатологии. Установлено, что возникновение аритмий учащается параллельно увеличению возраста пациентов. В связи с этим в общей популяции определяется наличие взаимосвязи между распространенностью ишемической болезни сердца и частотой обнаружения нарушений ритма сердца. Наиболее часто аритмии сердца наблюдаются при коронарной недостаточности. Так, в остром периоде инфаркта миокарда аритмии регистрируются у95–100% пациентов. ЭТИОЛОГИЯ НАРУШЕНИЙ СЕРДЕЧНОГО РИТМА Аритмии являются следствием нарушения автоматизма, возбудимости или проводимости миокарда, а также их комбинаций. Причины аритмий можно условно подразделить на четыре группы: 1)нарушения нейрогуморальной регуляции электрофизиологических процессов в миокарде; 2)органические поражения миокарда, его аномалии, врожденные или наследственные дефекты с повреждением мембран и клеточных структур; 3)сочетание нарушений нейрогуморальной регуляции ритма и органической патологии сердца; 4)аритмии, обусловленные действием токсических веществ и лекарственными средствами (в том числе антиаритмическими). Одной из основных причин нарушений сердечного ритма является изменение физиологического соотношения между тонической активностью симпатического и парасимпатического отделов вегетативной нервной системы. В эксперименте на животных практически любую из известных форм аритмий — от синусовой тахикардии до фибрилляции желудочков — можно вызвать, воздействуя на некоторые отделы головного мозга: кору, лимбические структуры, гипоталамо-гипофизарнуюсистему, с которой тесно связаны находящиеся в ретикулярной формации продолговатого мозга центры симпатической и парасимпатической регуляции сердечной деятельности. Одним из наиболее ярких примеров нарушения ритма, обусловленного дисбалансом симпатического и парасимпатического звеньев вегетативной нервной системы, является снижение электрической стабильности сердца при психоэмоциональном стрессе. При тиреотоксикозе наблюдаются нарушения сердечного ритма, обусловленные повышением адренореактивности сердца. Одной из частых «эндокринных» причин возникновения аритмии является избыточное образование минералокортикоидов в коре надпочечников. Механизм арит- могенного эффекта минералокортикоидов (прежде всего наиболее активного из них — альдостерона) связан с дисбалансом Na+/K+ в организме. Альдостерон, действуя на почечные канальцы, стимулирует реабсорбцию Na+ из первичной мочи и усиление экскреции К+, в результате чего возникает гипокалиемия, которая способствует нарушению процессов реполяризации мембран кардиомиоцитов и возникновению аритмии. Органические поражения миокарда, обусловливающие возникновение аритмий, — это инфаркт миокарда, кардиосклероз, миокардиты, кардиомиопатия и др. Мочегонные препараты (например, фуросемид), усиливая экскрецию К+, способствуют возникновению гипокалиемии. Сердечные гликозиды (например, строфантин), угнетаяNa+/K+-АТФ-азумембран кардиомиоцитов, снижают активность этого фермента, что сопровождается уменьшением содержания К+ и увеличением концентрации Na+ в саркоплазме кардиомиоцитов. Снижение внутриклеточной концентрации К+ приводит к замедлению процессов реполяризации мембран кардиомиоцитов, что способствует возникновению аритмии. ПАТОГЕНЕЗ НАРУШЕНИЙ СЕРДЕЧНОГО РИТМА ПАТОГЕНЕЗ НАРУШЕНИЙ СЕРДЕЧНОГО РИТМА Согласно современным представлениям, в основе возникновения аритмий лежит нарушение образования или проведения импульса (потенциала действия). Однако чаще всего аритмии возникают при участии обоих механизмов (рис. 1). Патогенез нарушений ритма сердца
Рис. 1. Патогенез сердечных аритмий Нарушения образования импульса. Нарушение образования им- пульса может быть обусловлено нарушением автоматизма и повышением возбудимости кардиомиоцитов. Автоматизм (автоматия) — способность кардиомиоцитов спонтанно генерировать потенциал действия. Способностью к автоматизму обладают все атипичные кардиомиоциты (клетки проводящей системы сердца), но не обладают рабочие кардиомиоциты (клетки сократительного миокарда). Возбудимость — свойство клеток возбудимых тканей воспринимать действие раздражителя и реагировать на него реакцией возбуждения. Возбудимость сердечной мышцы выражается в способности генерировать потенциал действия в ответ на раздражение. В норме автоматизм проявляет только синоатриальный узел (СА-узел, узелКиса–Флека),являющийся номотопным (т. е. нормально расположенным) водителем ритма. Частота генерации импульсов клетками СА-узла в покое у взрослого человека составляет60–90в мин.СА-узел называется истинным водителем ритма, или пейсмекером1-гопорядка (от англ. pacemaker — водитель ритма). Остальные структуры проводящей системы сердца (атриовентрикулярный узел, пучок Гиса, ножки пучка Гиса, волокна Пуркинье) также способны спонтанно генерировать импульсы, однако собственная частота разрядов клеток этих отделов мала. Она тем ниже, чем дальше от пейсмекера1-гопорядка расположены клетки (градиент автоматии). Благодаря этому в нормальных условиях потенциал действия в этих клетках проводящей системы сердца возникает в результате прихода возбуждения от более часто разряжающихся верхних отделов (клетки САузла), и их собственный автоматизм «не успевает» проявиться. Таким образом, нижележащие структуры проводящей системы сердца проявляют автоматизм лишь при нарушении поступления импульсов от СА-узлаи поэтому называются латентными (скрытыми, потенциальными) водителями ритма. Изменение нормального автоматизма. Как известно, в основе процесса автоматизма лежит медленная спонтанная диастолическая деполяризация (рис. 2), постепенно уменьшающая мембранный потенциал до критического уровня (порог возбуждения), с которого начинается быстрая деполяризация мембраны (фаза 0 потенциала действия). 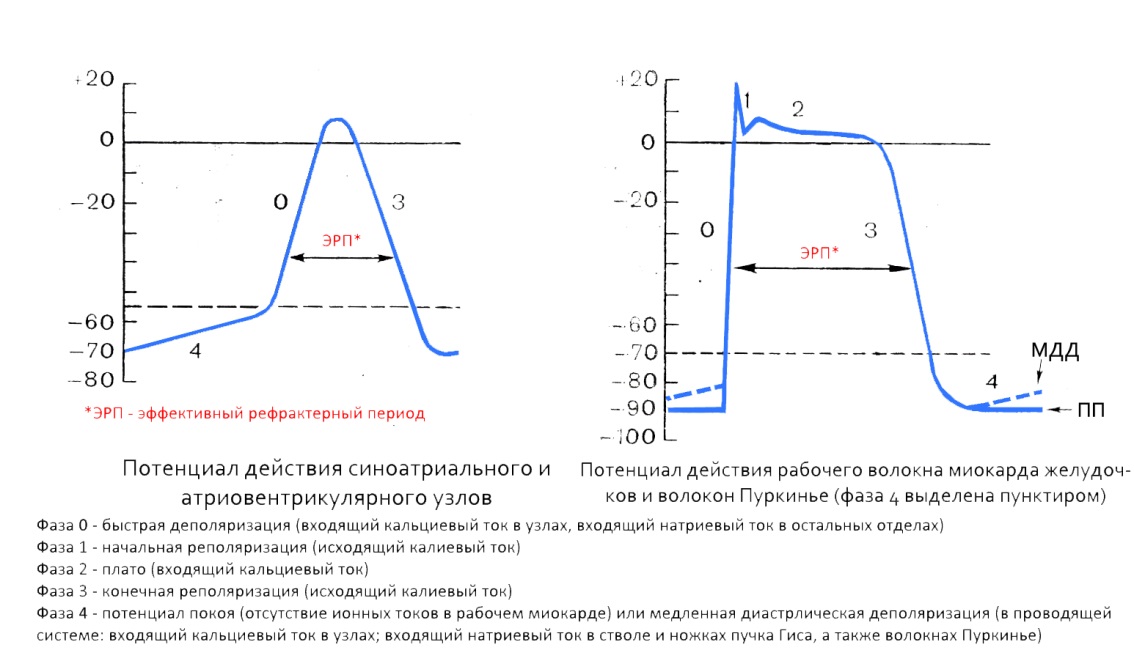 Изменения нормального автоматизма сердца приводят к возникновению синусовых аритмий. На продолжительность спонтанной диастолической деполяризации и, следовательно, частоту генерации импульсов клетками СА-узлаоказывают влияние следующие механизмы: 1.Скорость спонтанной диастолической деполяризации (наиболее важный). При ее возрастании порог возбуждения достигается быстрее ипроисходит учащение синусового ритма (тахикардия). Замедление спонтанной диастолической деполяризации ведет к замедлению синусового ритма (брадикардия). 2.Величина потенциала покоя клеток СА-узла. Если величина потенциала покоя становится более отрицательной (например, в результате гиперполяризации мембраны при действии ацетилхолина), то требуется больше времени для достижения порога возбуждения (при условии, что скорость спонтанной диастолической деполяризации остается неизменной) — возникает брадикардия. Если потенциал покоя клеток СА-узластановится менее отрицательным, то, соответственно, требуется меньше времени для достижения порога возбуждения — развивается тахикардия. 3.Изменение порога возбуждения. Более отрицательное значение величины порога возбуждения клетокСА-узласпособствует учащению синусового ритма, а менее отрицательное значение — его урежению. Возможны и различные комбинации трех основных электрофизиологических механизмов, регулирующих автоматизм СА-узла. Аномальный автоматизм Аномальный автоматизм. В норме ритм сердечных сокращений задают клеткиСА-узла,все остальные клетки проводящей системы сердца разряжаются, как и рабочий миокард, под действием распространяющегося возбуждения. Потенциал действия в них возникает под влиянием токов от возбужденных участков миокарда до того, как в результате их собственной медленной спонтанной диастолической деполяризации их мембранный потенциал достигнет порога возбуждения. Аномальный автоматизм — это появление пейсмекерной активности в клетках сердца, не являющихся в норме водителями сердечного ритма (т. е. они становятся водителями ритма сердца вместо клетокСА-узла). Если по той или иной причине возбуждение СА-узлане возникает либо не может перейти на предсердие вследствие нарушения проводимости, роль водителя ритма берет на себя атриовентрикулярный узел(АВ-узел,узелАшоффа–Тавары)— пейсмекер2-гопорядка (частота генерации импульсов40–60в мин). Если проведение возбуждения от предсердий к желудочкам полностью нарушено, то желудочки сокращаются в ритме пейсмекера3-гопорядка (частота генерации импульсов менее 40 в мин), расположенного в проводящей системе желудочков. СА-узелназываютномотопным (нормально расположенным) водителем ритма, а очаги возбуждения в остальных отделах проводящей системы сердца —гетеротопными (ненормально расположенными).Эктопический водитель ритма — источник сердечных импульсов, расположенный в любом месте миокарда помимоСА-узла. Сокращение сердца, вызванное импульсом из гетеротопного очага возбуждения, называют замещающим, а последовательность сокращений — замещающим ритмом (например,АВ-ритм).Такие ритмы выполняют защитную функцию, поддерживая относительно высокую частоту сердечных сокращений (ЧСС) при выраженном замедлении импульсации изСА-узла. Гетеротопные очаги возбуждения могут определять ЧСС в случае, если их скорость генерации импульсов (соответственно, частота) будет больше, чем у СА-узла.Например, на фоне высокой концентрации катехоламинов может усиливаться автоматизм клеток нижележащих отделов проводящей системы сердца, и, если частота их деполяризации оказывается больше частоты генерации импульсов клеткамиСА-узла,это приводит к появлениюэктопического ритма (например, экстрасистолия). Такие эктопические ритмы могут возникать при ишемии миокарда, гипоксии, при электролитных нарушениях и т. д. При поражении миокарда (например, ишемии и др.) рабочие кардиомиоциты могут приобретать патологическую способность к автоматизму. Если скорость спонтанной диастолической деполяризации таких кардиомиоцитов превышает частоту генерации импульсов клетками СА-узла,то эти клетки устанавливают собственную ЧСС, становясьэктопическим водителем ритма. Триггерная активность. Повышение возбудимости кардиомиоцитов наиболее часто обусловливает возникновение аритмий по механизму триггерной активности (наведенной, пусковой, от англ. trigger — спусковой крючок). Электрофизиологической основой триггерной активности (триггерного автоматизма) являются ранние и поздние постдеполяризации. Ранняя постдеполяризация — это преждевременная деполяризация кардиомиоцитов, которая появляется в фазу реполяризации потенциала действия, когда потенциал мембраны еще не достиг величины потенциала покоя (рис. 3). Условиями возникновения ранних постдеполяризаций являются удлинение фазы реполяризации потенциала действия и брадикардия. При замедлении реполяризации и, соответственно, увеличении общей продолжительности потенциала действия может возникнуть преждевременная спонтанная деполяризация в тот момент, когда процесс реполяризации еще не завершился. При уменьшении частоты основного ритма сердца (брадикардии) происходит постепенное возрастание амплитуды ранних надпороговых колебаний мембранного потенциала, что при достижении величины порога возбуждения может вызывать образование нового потенциала действия еще до завершения исходного. Этот преждевременный потенциал действия рассматривается как триггерный (наведенный), поскольку он обязан своим возникновением ранней постдеполяризации, исходящей от основного потенциала действия. В свою очередь, второй (наведенный) потенциал действия за счет своей ранней постдеполяризации может вызвать третий, тоже триггерный потенциал действия и т. д. Если источник триггерной активности находится в желудочках, то может развиться желудочковая экстрасистолия или полиморфная (пароксизмальная) желудочковая тахикардия (желудочковая тахикардия типа «пируэт» — torsade de pointes). Электрокардиографическая картина полиморфной желудочковой тахикардии представлена на рис. 4 — желудочковые комплексы как бы вьются вокруг изоэлектрической оси (здесь и далее ЭКГ приведены во II стандартном отведении, скорость записи — 25 мм/с). Возникновению ранних постдеполяризаций способствуют: гиперкатехоламинемия, гипокалиемия, ацидоз, ишемия. Поздняя постдеполяризация — это преждевременная деполяризация кардиомиоцитов, которая появляется сразу после завершения фазы реполяризации, т. е. когда электрический заряд мембраны соответствует потенциалу покоя. Подпороговые колебания мембранного потенциала, которые в норме могут присутствовать, но никогда себя не проявляют, при патологических состояниях, сопровождающихся увеличением внутриклеточной концентрации Са2+ в кардиомиоцитах, могут возрастать по амплитуде, достигая порога возбуждения. Повышение внутриклеточной концентрации Са2+вызывает активацию неселективных ионных каналов, обеспечивающих усиленное поступление катионов (главным образом Na+) из внеклеточной среды в кардиомиоцит. В результате отрицательный заряд внутренней поверхности мембраны уменьшается, достигая величины порога возбуждения, и возникает серия преждевременных потенциалов действия. Поздние постдеполяризации часто появляются при инфаркте миокарда, могут возникнуть под действием сердечных гликозидов, катехоламинов. Нарушения проведения импульса Нарушения проведения импульса. Проводимость — способность кардиомиоцитов проводить импульсы возбуждения. Существует три основных типа нарушений проводимости: замедление или блокада проведения, повторный вход импульса (механизм re-entry),сверхнормальное проведение. Замедление или блокада проведения импульса. Распространение импульса возбуждения блокируется, если он достигает участка миокарда, неспособного к возбуждению. Чаще всего проведение импульса нарушается, если он достигает кардиомиоцитов, находящихся в рефрактерной фазе. В этом случае говорят о функциональной блокаде. Распространение следующего импульса возбуждения может не нарушаться. Блокада, вызванная барьером в виде рубцовой ткани, замещающей кардиомиоциты, называется фиксированной блокадой проведения импульса. Причиной замедления проведения импульса возбуждения или его блокады нередко бывает снижение количества потенциалзависимых Na+-каналовклеток, которым в норме присуще свойство быстрой деполяризации (например, рабочие кардиомиоциты, волокна Пуркинье). Существует прямая зависимость между количеством потенциалзависимыхNa+-каналови величиной потенциала покоя. Так, при уменьшении мембранного потенциала покоя рабочего кардиомиоцита до уровня–50мВ (в норме–90мВ) инактивируется около половины всехNa+-каналов.В этом случае возбуждение и проведение импульса становятся невозможными (например, в зоне ишемии миокарда). Вопределенных случаях даже при значительном уменьшении потенциала покоя проведение импульса возбуждения, правда, существенно за- медленное, сохраняется. Такое проведение осуществляется медленными Са2+-каналамии медленнымиNa+-каналами,которые устойчивы к снижению потенциала покоя (рис. 5). Врабочих кардиомиоцитах существуют только быстрыеNa+-каналы,но в условиях ишемии миокарда одна половина этих каналов инактивируется, а другая половина может превратиться в аномальные «медленные» Na+-каналы.Таким образом, «быстрые» клетки превращаются в «медленные» кардиомиоциты, при прохождении через которые импульс возбуждения может замедлить свое распространение или блокироваться. Повторный вход импульса (механизм re-entry).Этим термином обозначают явление, при котором электрический импульс, совершая движение по замкнутому кругу (петле, кольцу) в миокарде, возвращается к месту своего возникновения (circus movement). Различают macro re-entry (макрориентри) иmicro re-entry(микрориентри). При таком делении учитывают размеры круга (петли), в котором осуществляется повторный вход импульса. В норме импульсы из СА-узластрого упорядоченно распространяются по сердцу, вызывая деполяризацию всех волокон миокарда, после чего затухают. Каждый участок миокарда и проводящей системы деполяризуются под действием одного импульса только один раз (в силу рефрактерности кардиомиоцитов). Для развития механизма re-entryнеобходимы следующие условия: –существование 2 каналов проведения импульса, разделенных между собой функционально или анатомически; –односторонняя блокада проведения импульса; –наличие потенциально замкнутой петли движения импульса (например, в местах разветвления волокон проводящей системы, зонах контактов окончаний волокон Пуркинье с кардиомиоцитами); –замедление проведения импульса по цепи re-entry(замедление скорости проведения импульса, так что ни в одной точке петли волна возбуждения не встречается с зоной рефрактерности). Соблюдение этих условий возможно в том случае, если соседние клетки миокарда будут различаться по скорости проведения импульсов ипродолжительности рефрактерного периода (например, функционально гетерогенный участок при ишемии миокарда). На рис. 6 показано распространение волны возбуждения в норме. Импульс достигает точки х и далее следует по двум параллельным путям (α и β) в нижележащие отделы проводящей системы. Скорость проведения импульса по цепи re-entry(замедление скорости проведения импульса, так что ни в одной точке петли волна возбуждения не встречается с зоной рефрактерности). Соблюдение этих условий возможно в том случае, если соседние клетки миокарда будут различаться по скорости проведения импульсов и продолжительности рефрактерного периода. АРИТМИИ В РЕЗУЛЬТАТЕ НАРУШЕНИЯ АВТОМАТИЗМА АРИТМИИ В РЕЗУЛЬТАТЕ НАРУШЕНИЯ АВТОМАТИЗМА В зависимости от места генерации аномального импульса возбуждения выделяют две группы аритмий: 1.Номотопные аритмии (возникают в СА-узле): – cинусовая тахикардия; – cинусовая брадикардия; – cинусовая аритмия; – синдром слабости СА-узла. 2.Гетеротопные аритмии (возникают вне СА-узла): – предсердный медленный ритм; – атриовентрикулярный (узловой) ритм; – миграция водителя ритма; – идиовентрикулярный (желудочковый) ритм; – диссоциация с интерференцией. НОМОТОПНЫЕ АРИТМИИ Синусовая тахикардия — это увеличение в покое частоты генерации импульсов возбуждения в СА-узле выше нормы (более 90 импульсов в мин) с одинаковыми интервалами между ними Электрофизиологический механизм: ускорение спонтанной диастолической деполяризации мембраны клеток СА-узла. Причины: –усиление влияния на сердце симпатико-адреналовойсистемы (стресс, физические нагрузки, острая кровопотеря, гипертермия, лихорадка, гипоксемия, гипогликемия и др.); –снижение влияния на сердце парасимпатической нервной системы. Повреждение центральных нервных образований (подкорковых ядер, ретикулярной формации, ядер продолговатого мозга), проводящих путей, парасимпатических ганглиев и нервных стволов, рецепторов кардиомиоцитов; –прямое действие повреждающих факторов различной природы (физических, химических, биологических) на клетки СА-узла(например, механическая травма, токсический миокардит, инфаркт миокарда и др.). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
