16 вопрос. Альдегиды, строение, гомологический ряд, номенклатура, изомерия, химические свойства
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Альдегиды, строение, гомологический ряд, номенклатура, изомерия, химические свойства Решение: Альдегиды – это органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. Структурная формула альдегидов: 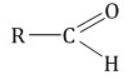 Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь. Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу. 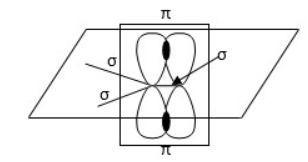 π-Связь С-О, образованная перекрыванием негибридизированной р-орбитали атома углерода и р-орбитали атома кислорода, располагается перпендикулярно этой плоскости и легко смещается к более электроотрицательному атому кислорода. 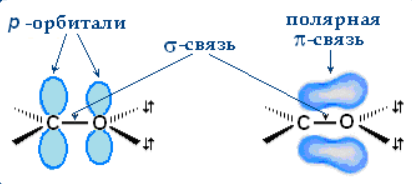 Атом углерода связан с атомом кислорода двойной связью С=О (одна σ-связь и одна π-связь).Электроны кратной связи С=О, особенно более подвижные π-электроны, смещены к более электроотрицательному атому кислорода, что приводит к появлению частичного отрицательного заряда (δ-) Карбонильный углерод приобретает положительный заряд (δ+). 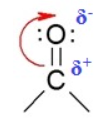 Таким образом, группа >C=O сильно поляризована, что обусловливает большую реакционную способность альдегидов. Альдегиды классифицируются по следующим признакам:
Гомологический ряд предельных алифатических альдегидов По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ». Также сохранились исторические тривиальные названия  Изомерия альдегидов Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия. Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода. 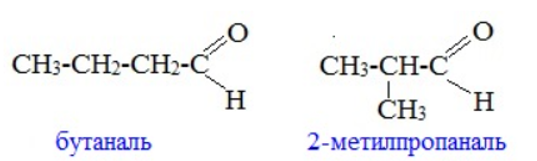 Межклассовая изомерия с кетонами, начиная с С3  с циклическими оксидами (с С2)  с непредельными спиртами и простыми эфирами (с С3)  пространственная изомерия: оптическая (если углеводородный радикал содержит асимметрический углеродный атом, как, например, в глицериновом альдегиде CHO-C*H (OH) -CH2OH)  и цис-транс-изомерия (например, в кротоновом альдегиде CH3-CH=CH-CHO).  Химические свойства альдегидов и кетонов 1. Реакции присоединения В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам. 1.1. Гидрирование Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты. 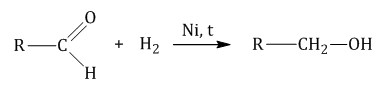 1.2. Присоединение воды Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе: 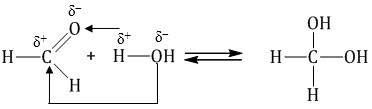 Эта реакция возможна только для формальдегида и уксусного альдегида. 1.3. Присоединение спиртов При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали. В качестве катализаторов процесса используют кислоты или основания. Полуацетали существует только при низкой температуре. 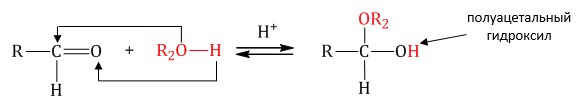 Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты, где происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя: 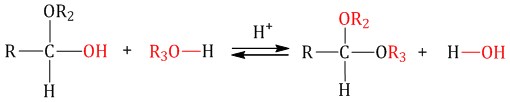 Так например уксусный альдегид образует 1-этоксиэтанол (полуацеталь) и 1,1 – диэтоксиэтан (ацеталь) 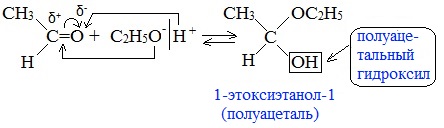 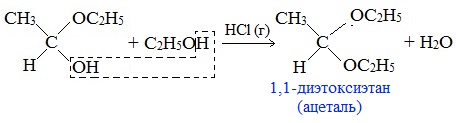 Ацетали обладают приятным цветочным ароматом. Именно образованием ацеталей обусловлен букет выдержанных вин. Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол. 1.4. Присоединение циановодородной (синильной) кислоты Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу Присоединение идет в соответствии с распределением электронной плотности в молекулах: 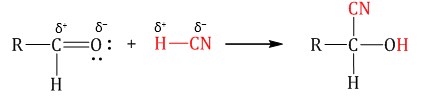 Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид, поэтому подобные реакции используют для удлинения углеродной цепи. А также для получения α-гидроксикислот R-CH (COOH) OH: 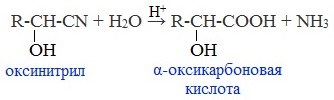 Циангидрин CH3— CH(CN) — OH— яд! Он содержится в ядрах косточек вишен, слив, персика. Циангидрины используют как промежуточные соединения в синтезах окси- и аминокислот. Некоторые циангидрины встречаются в растениях. Употребление таких растений в пищу может привести к тяжелым отравлениям вследствие высвобождения синильной кислоты в организме. 1.5. Присоединение гидросульфита натрия NaHSO3с образованием гидросульфитных производных альдегидов Качественная реакция на альдегидную группу! Альдегиды при встряхивании с концентрированным раствором гидросульфита натрия образуют кристаллические соединения: 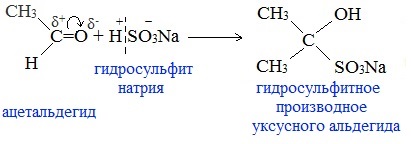 С помощью этой реакции выделяют альдегиды из смесей с другими веществами и для получения их в чистом виде. 1.6. Взаимодействие с магнийорганическими соединениями. альдегиды реагируют с алкил- и арилмагнийгалогенидами (реактивы Гриньяра) с образованием продуктов присоединения по карбонильной группе, которые гидролизуются в присутствии разбавленных минеральных кислот до спиртов: 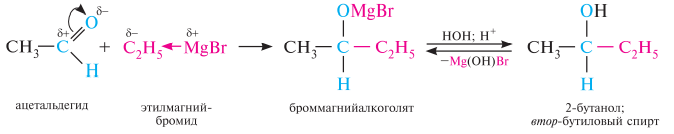 Реакции присоединения-отщепления альдегиды взаимодействуют с азотистыми основаниями (H2N —X, где х = —H, —Аlk, —Аr, —ОН, —NH2 и др.) с образованием неустойчивых продуктов нуклеофильного присоединения, которые стабилизируются путем отщепления молекулы воды. Эта группа реакций получила название «реакций присоединения-отщепления». Взаимодействие с аммиаком. Альдегиды, присоединяя молекулу аммиака, образуют альдимины. в процессе реакции вначале образуется неустойчивый аминоспирт, от которого затем отщепляется молекула воды 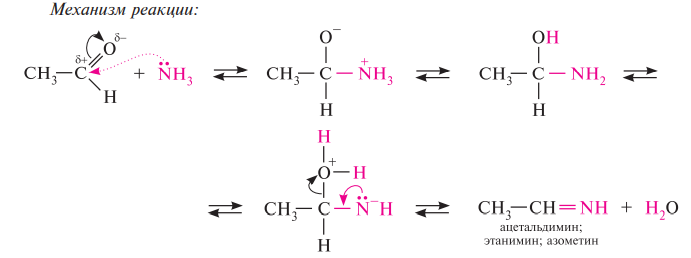 Альдимины — неустойчивые соединения, они самопроизвольно циклотримеризуются с образованием альдегидаммиака: 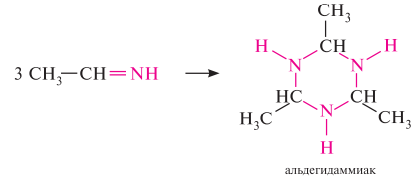 Взаимодействие с первичными аминами. альдегиды и кетоны реагируют с первичными аминами с образованием N-замещенных иминов (азометинов) 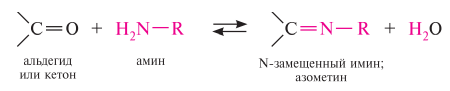 Взаимодействие с гидроксиламином. Продукты конденсации альдегидов с гидроксиламином называют альдоксимами 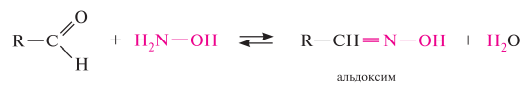 Взаимодействие с гидразином и его производными. Альдегиды и кетоны реагируют с гидразином и его производными — фенилгидразином 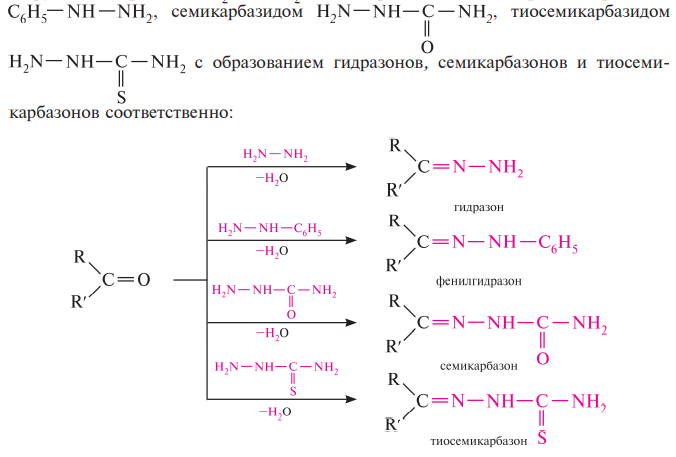 Где R= -CH3; -С2Н5 ; R1=R (кетон) или R1=Н (альдегид) Альдольная конденсация. альдегиды, содержащие атомы водорода у -углеродного атома, в присутствии основания способны вступать в реакцию альдольной конденсации. взаимодействие осуществляется при участии подвижного -атома водорода одной молекулы и карбонильной группы другой молекулы альдегида и приводит к образованию соединения со спиртовой и альдегидной группой (альдоль). Переход от предельных альдегидов через стадию образования альдоля с последующей внутримолекулярной дегидратацией к ,-непредельным альдегидам называют кротоновой конденсацией. 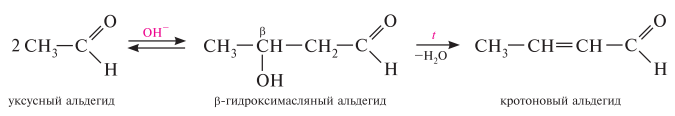 Сложноэфирная конденсация (реакция Тищенко). При нагревании альдегидов с алюминия этилатом образуются сложные эфиры карбоновых кислот: 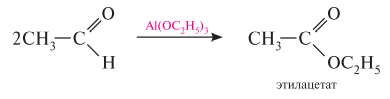 реакция галогенирования. альдегиды как CH-кислоты легко вступают в реакции с галогенами с образованием -галогенозамещенных продуктов: 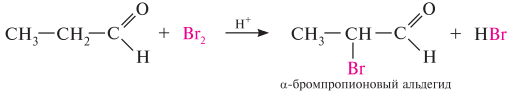 галоформная реакция характерна для метилкетонов и ацетальдегида. 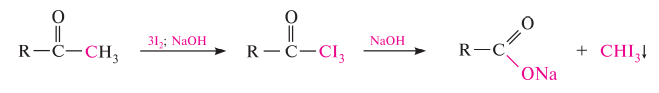 7. Окисление альдегидов 7.1. Окисление гидроксидом меди (II) Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды. 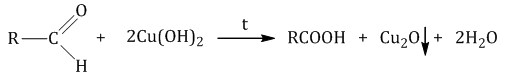 7.2. Окисление аммиачным раствором оксида серебра Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»). 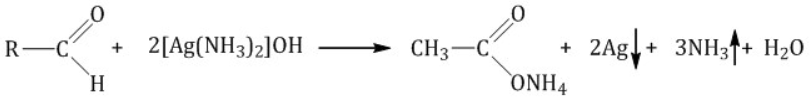 Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты. 7.3 Окисление перманганатом калия Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании:   Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой кислоты. Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому что соответствующая ему муравьиная кислота неустойчива к действию сильных окислителей 7.4. Горение (полное окисление) Альдегиды и кетоны сгорают до углекислого газа и воды: 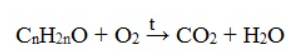 8. Конденсация с фенолами Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:  Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды: 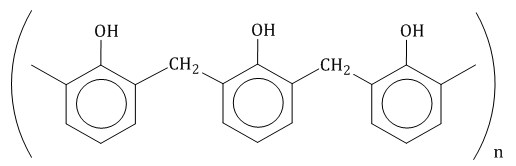 Фенол и формальдегид вступают в реакцию поликонденсации. Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.). 9. Полимеризация альдегидов Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация. Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ: 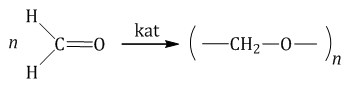 | ||||||||||||||||||