|
|
Пять нерешенных проблем науки. Артур уиггинс, чарльз уинн пять нерешенных проблем науки рисунки Сидни Харриса
Модельные организмы
Излюбленный объект исследования среди эукариот — Sacchammycesaccharomycescerevisae (S. cerevisae), больше известный как пивные дрожжи. Пожалуй, это более всего изученный на молекулярном и клеточном уровнях эукариотный организм. S. cerevisaeпредставляет собой всего лишь одноклеточный грибок, но многие процессы в его клеточном ядре сходны с теми же процессами у млекопитающих. Действительно, исследование дрожжей помогло выявить многие молекулы и химические реакции, задействованные в процессах, ход которых нарушается при раке. S. cerevisaeустроены сложнее бактерии, чье ДНК, содержащее около 12 млн нуклеотидных пар азотистых основания, имеет 6 тыс. генов. И Е. coli, и S. cerevisaeсчитаются модельными организмами, которые должны:
быстро развиваться, имея короткий срок жизни;
обладать малыми размерами, будучи взрослыми;
быть всегда под рукой;
быть простыми в обращении;
выполнять свои биологические функции сходным с более сложными организмами, вроде человека, образом.
Усердно изучаются и другие модельные организмы. Caenorhabditiselegans— прозрачный круглый червь, вырастающий в длину не более 1 мм, вполовину величины вот этого знака
. С. elegansдостигает взрослого состояния за три дня, живет в почве по всему свету и питается микробами вроде тех, что обитают в перегное. Этот маленький червь представляет собой многоклеточную (959 клеток) эукариоту с 19 099 генами в состоящей из 97 млн пар азотистых оснований ДНК. Он развивается из одной клетки в организм с нервной системой и «мозгом». С. elegansспособен к обучению, вырабатывает яйцеклетки и сперматозоиды, постепенно стареет и умирает. Сидни Бреннер, молекулярный биолог из Великобритании, говорит, что С. elegansоправдывает свое название, ибо на самом деле «фотогеничен», как видно на рис. 4.5. Бреннер, Джон Салстон и Роберт Хорвиц разделили Нобелевскую премию 2002 года по физиологии и медицине как раз за работу с червем С. elegans.
Другой модельный организм, Drosophilamelanogaster, знаком многим из нас. В 1906 году гарвардский профессор эмбриологии Уильям Эрнест Касл привлек к участию в одном проекте аспиранта [Крейга Вудворта].
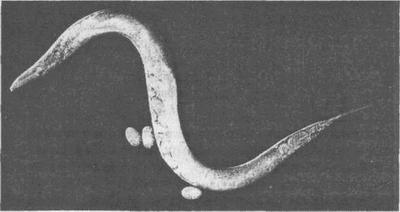
Рис. 4.5. С. elegans
Он попросил его не убирать несколько перезрелых виноградин, а затем посмотреть, что получится. Получились D. melanogaster — плодовые мушки — организм, изучаемый ныне в лабораториях по всему миру. Благодаря своим идеальным свойствам модельного организма плодовые мушки широко используются в исследованиях по генетике и биологии развития.
Жизненный цикл плодовой мушки составляет 16 дней, а новое поколение она дает каждые 12 часов. Эти существа плодовиты, непритязательны и, по словам генетика из Беркли Герри Рубин, имеют столь много общего с человеком, что их называют крохотными людьми с крыльями. Дрозофила располагает 13 600 генами на ДНК из 165 млн нуклеотидных пар азотистых оснований. Весь этот молекулярный аппарат умещается в тельце длиной 3 мм, величиной примерно с букву V в имени Venter (о самом Вентере чуть позже).
Musmesculus(мышь), давний любимец медиков, занимающихся изучением болезней и лекарств, тоже соответствует всем требованиям, предъявляемым к модельным организмам. К тому же геном мыши весьма схож с геномом человека.
Генетические сравнительные исследования уже многое прояснили в отношении строения и функционирования человеческого тела. Дальнейшие исследования принесут дополнительные сведения.
Другие создания, вроде полосатой перцины, иглобрюха [родственного горчице сорняка из семейства крестоцветных], резушки Таля (Arabidopsisthaliana) и палочки Пфайфера (Haemophilusinfluenzae), выступают в роли модельных организмов и изучены в разной степени. Модельные организмы и приспособления, требуемые для их изучения, вызывают в памяти ситуации из классической описательной биологии с образами бесчисленных исследователей, склонившихся над микроскопом или щурящихся сквозь стекла очков во время поездок по экзотическим местам, где можно увидеть организмы в их естественной среде обитания (вспомним Чарльза Дарвина на Галапагосских островах).
Физика — биология — химия
Несмотря на значимость модельных организмов для биологов, поле деятельности современной биологии значительно расширилось во многом благодаря нахлынувшим туда представителям других отраслей знаний, чья деятельность преобразила сам подход к изучению биологии.
Чтобы понять, как произошло это преображение, взглянем иначе и шире на центральное учение молекулярной биологии. Описательная биология сосредоточивалась на видимых признаках, но находила мало объяснений, связанных с этими признаками молекулярных механизмов. Затем пришел черед химии, занимавшейся химическими реакциями внутри живых существ, прояснявшими биологические процессы. Но главная трудность состояла в том, что управляющие живыми системами молекулы были слишком малы, чтобы их можно было для разглядывать в микроскоп.
Следующими нахлынули физики, посредством рентгеновской кристаллографии выявившие двойную спираль ДНК (вспомним биолога Джеймса Уотсона и физика Фрэнсиса Крика, воспользовавшихся данными рентгеновского кристаллографа Розалинды Франклин). Итак, хорошие вести заключались в создании представления об общем строении ДНК, а плохие — в невозможности разглядеть подробности ее строения из-за малых размеров. ДНК содержит такое огромное количество парных оснований нуклеотидов, что их определение и выписывание оказалось сложной задачей.



Рис. 4.6. Общая картина биологии
Итак, положение биологии в 1980-е годы было следующим: молекулярная биология сосредоточилась на работе с крайне малыми объектами; классическая описательная биология ограничилась наблюдением той части биосферы, которая была доступна зрению, пусть и сквозь окуляр микроскопа. Многие детали на стыке микро- и макроскопических областей биологии оказались совершенно необъяснимыми (рис. 4.6).
Переход от большого масштаба к малому происходил медленно. Изучение молекул с химической точки зрения кое-что проясняло, но продвижение шло черепашьим шагом, а черепаха, увы, не модельный организм.
В середине 1980-х годов некоторых биологов осенило: почему бы не изучить весь состав ДНК живого организма, так называемый геном? Более того, посредством отдельных модельных организмов прийти к конечной цели — геному человека. Это привело к очередному наплыву в биологию приборостроителей, программистов, предпринимателей и появлению одного неуемного исследователя — Дж. Крейга Вентера.
Составление карты генома человека. Великие задачи требуют величественных орудий
Прежде чем описывать все перипетии, увенчавшиеся в итоге составлением карты генома модельных организмов и человека, вникнем в подробности того, как устанавливается последовательность оснований плотно упакованной молекулы ДНК. Оказывается, геном человека состоит из 3 млрд. парных оснований нуклеотидов. Если считать их по одному в секунду, на это уйдет почти 100 лет. Очевидно, для их определения потребовался более быстрый способ, для чего понадобилось усовершенствовать несколько методов.
Электрофорез. В 1937 году шведский биохимик Арне Тиселиус (Тизелиус) разработал метод разделения заряженных частиц во взвеси на основе их массы и заряда (рис. 4.7). Заряженная частица в электрическом поле под действием его силы ускоренно движется в сторону противоположно заряженного электрода. Погруженная в среду (гель) частица тормозится под действием силы трения. При равенстве электрической силы и силы трения частица движется с постоянной скоростью, именуемой конечной.
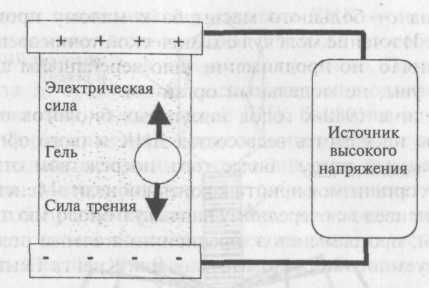
Рис. 4.7. Установка для электрофореза
Данный подход знаком парашютистам, которые благодаря уравновешиванию их веса с силой трения опускаются на землю с постоянной, а не с возрастающей скоростью.
Для выделения частиц в геле Тиселиус применил красители. Данный подход он впервые опробовал при разделении белков в растворе — а в 1948 году был удостоен за свою работу Нобелевской премии по химии. С тех пор его метод использовался в опытах с множеством частиц при движении в различных средах. А для их выделения существуют несколько различных приемов.
Рестрикционные ферменты. Создание рестрикционных ферментов началось весьма необычно: в опытах с бактериофагами. Бактериофаги (или фаги) представляют собой вирусы, атакующие клетки бактерий, внедряя свои ДНК в клетку-хозяина, который затем плодит данный вирус. Фагов независимо друг от друга открыли в 1917 году бактериологи Фредерик Туорт из Великобритании и Феликс д'Эрелль из Франции. Опыты на бактериофагах получали все больший размах благодаря их возможности убивать опасные для человека бактерии. Однако интерес к ним упал после открытия пенициллина и других химических антибиотиков.
Бактериофаги столь многочисленны (по оценкам, их количество составляет 1030), что их общая биомасса значительно превышает общий вес населения Земли. Они почти целиком состоят из белков и ДНК (рис. 4.8). Будучи вирусами, они не могут жить без хозяина. Ввиду простоты своего устройства они оказываются идеальными испытуемыми для получения сведений о жизнедеятельности и их самих, и их хозяев.
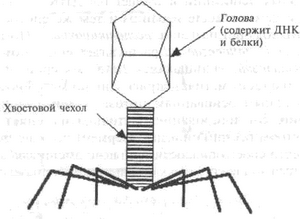
Хвостовые нити Рис. 4.8. Бактериофаг
Хамилтон Смит, микробиолог из университета Джонса Хопкинса8 в конце 1960-х работал с HaemophilusinfluenzaeRdи фагом Р22. Случайно бактерии и фаги стали выращивать вместе. Смит заметил, как активность ДНК у фага все время падала, что указывало на расщепление ДНК фага чем-то внутри бактерии. Смит со своими сотрудниками выделил и очистил ответственный за расщепление фермент и установил его механизм: белковый фермент внутри Н. influenzaeрасщепляет ДНК фага, выявляя определенную цепь из шести парных оснований и расщепляя ДНК — неизменно в одном и том же месте и одним и тем же способом.
Такой фермент получил название рестрикционного. Помимо этого фермента Н. influenzaeRdрасполагает еще одним ферментом, метилазой, защищающей ДНК бактерии от подобной участи. Фермент метилаза присоединяет метиловую группу к нуклеотидным основаниям цитозина или аденина в ДНК бактерии. Метилирование настолько изменяет молекулу ДНК, чтобы рестрикционный фермент все еще мог распознать место своего подсоединения, не вмешиваясь при этом в обычный ход воспроизводства или метаболизма самой бактерии.
С тех пор удалось открыть тысячи ферментов, расщепляющих ДНК на определенных участках. Отрыты были и ферменты, скрепляющие вместе куски ДНК. В итоге всех этих открытий молекулярные биологи располагают ныне набором белковых ферментов, позволяющих им разрезать или склеивать ДНК в заданных местах.
Сенгеровский метод обрыва цепи [замещающим нуклеотид] дидезокси[рибонуклеозидтрифосфатом] для секвенирования ДНК. В 1977 году биохимик из Великобритании Фред Сенгер разработал способ расщепления ДНК на участки, соответствующие любой длине исходной ДНК. Этот метод использовал замещающую нуклеотид молекулу. Заместитель не образует связи со следующим нуклеотидом в последовательности, необходимой для создания всей ДНК, так что цепь обрывается на нем.
Приведем пример. На рис. 4.9 верхняя молекула имеет атом кислорода, связанный с атомом водорода в положении 3' (атомы углерода в кольце нумеруются цифрами 1', 2', 3', 4' и 5'), тогда как у атома водорода в положении 4' атом кислорода отсутствует (отсюда приставка дезокси-). У нижней молекулы атом водорода отсутствует на позициях 3' и 4', поэтому ее название начинается с приставки дидезокси-. Из-за такой разницы в строении, когда при сборке молекулы ДНК в нее встраивается дидезоксидное основание, она уже не связывается с другим нуклеотидным основанием (в позиции 5'), и цепь ДНК обрывается в этом месте.
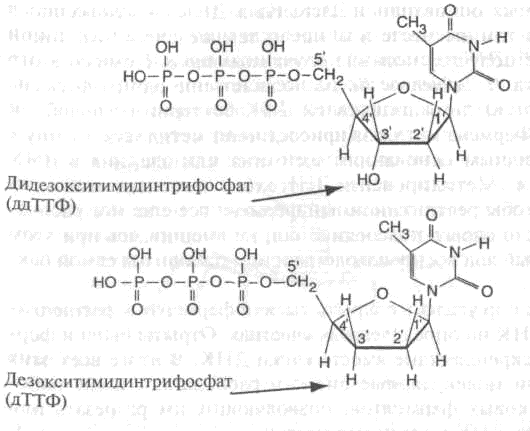
Рис. 4.9. Дезокситимидинтрифосфат (дТТФ) и дидезокситимидинтрифосфат (ддТТФ)
То же происходит с другими основаниями ДНК (аденином, гуанином и цитозином). В итоге можно получать ДНК различной длины (на изображениях молекул пустые углы на кольцах соответствуют атомам углерода).
Сенгеровский метод обрыва цепи дидезоксидными основаниями для секвенирования ДНК начинается с того, что посредством рестрикционных ферментов расщепляют подвергаемую секвенированию ДНК на меньшие участки, а ДНК нагревают до полного разделения обеих ее нитей. Затем к этим однонитевым участкам ДНК добавляют трифосфаты с дидезоксидным основанием, после чего вводится белковый фермент ДНК полимераза, который приступает к сборке копий исходной ДНК. Из-за дидезоксидных оснований собранные молекулы представляют собой не копии исходной ДНК, а смесь из полученных прежде участков ДНК. Предварительно дидезоксидные основания помечаются (маркируются) либо радиоактивным изотопом фосфора, либо чувствительным к ультрафиолетовому свету красителем, так что конец каждой оборванной цепи становится видимым.
Затем эту смесь цепей ДНК помещают в лунки пластины геля и дают электрическое напряжение. Более короткие участки испытывают меньшее сопротивление среды (обычно желе из водоросли агароза, схожее с желатином «Джелло» 9 вещество, с той лишь разницей, что молекулы там образуют дополнительные связи, делая гель прочным) и поэтому движутся быстрее. Часто в качестве образца в одну из лунок помещают цепи известной длины. После достижения наиболее короткими цепями края пластины геля напряжение снимают. По радиоактивным или флуоресцентным маркерам определяют нуклеотидное основание в конце каждой молекулярной цепи. Поскольку электрофорез распределяет молекулы в соответствии с возрастанием длины цепи, при просмотре виден порядок расположения парных оснований нуклеотидов в исходной ДНК.
Данный метод широко применялся до середины 1980-х годов, и работа над диссертацией у многих аспирантов заканчивались участием в многолетнем проекте по секвенированию определенной части ДНК одного из модельных организмов. Приходилось брать пробы у организма, очищать, смешивать с химическими реактивами, выращивать, помещать в гель и проводить исследование, после чего собирать и толковать данные. Работа была тяжелой и продвигалась медленно. Обычно в ходе написания диссертации удавалось выстроить участок в 40 тыс. парных оснований ДНК.
Секвенирование генома человека
Озвучивая мнения многих влиятельных биологов, в номере Scienceза 7 марта 1986 года Ренато Дульбекко, глава Института биологических исследований им. Солка10, призвал к претворению в жизнь грандиозной программы по расшифровке генома человека. Он доказывал, что столь огромные усилия необходимы для понимания роли генов в развитии рака. Некоторые биологи, вроде Уолтера Гилберта (известного гипотезой РНК-мира), с радостью восприняли это предложение. Гилберт сказал: «Полный геном человека — Грааль генетики человека» (подробнее об этом сравнении далее).
Другие выразили озабоченность, что подобный гигантский проект исказит биологию до неузнаваемости. Расшифровка 3 млрд. пар азотистых оснований с помощью имеющихся на тот час средств потребует 15-летней непрерывной работы 10 тыс. аспирантов и обойдется примерно в 3 млрд. долларов. При таких затратах человеческих и денежных ресурсов ничего не останется на все остальные биологические проекты.
Луч надежды блеснул с появлением автоматизированных устройств секвенирования. Центр исследования человеческого генома [ныне Национальный институт генома человека], подразделение [сети институтов, объединенных общим названием] Национального института здоровья (НИЗ), официально приступил к работе в октябре 1990 года под руководством Джеймса Уотсона — да, самого Джеймса Уотсона. Данный проект задумывался как международный: большинство работ поручалось различным государственным лабораториям и университетам в США, и около трети приходилось на долю Великобритании, Франции, Германии и Японии.
Все усилия были сосредоточены на создании устройств автоматизированного секвенирования, что привело к наплыву в биологию приборостроителей. В конце 1986 года биохимик, доктор медицины Лерой Худ и биохимик-технолог Майкл Ханкапиллер создали компанию AppliedBiosystemsInc. (ABI) и разработали устройство, способное секвенировать в день 12 тыс. парных оснований нуклеотидов. В начале 1987 года лаборатория молекулярной биологии, возглавляемая Дж. Крейгом Вентером, испытала секвенатор ABI 375A Sequencer вместе с рабочей станцией по катализу АВ1 800 Catalyst для приготовления проб. Лаборатория Вентера занималась секвенированием двух участков, которые, как считалось, содержали гены, ответственные за крайне важные наследственные заболевания. Несмотря на отменную работу самих устройств, гены, поиском которых занимался Вентер, найдены не были. К тому же программное обеспечение выявило значительное число ошибочных результатов, так что многое пришлось сверять вручную.
Вентеру слишком уж не терпелось пролистать длинные последовательности из генетических букв в поисках немногих нужных генов или участков генома, где закодированы белки. И его осенило, как нарастить усилия. Чтобы отыскать активные гены в определенной клетке, он сначала извлекал из клетки РНК. Раз РНК строится прежде всего на основе ДНК, она содержит последовательность парных оснований нуклеотидов, относящуюся к активным частям (генам) исходной ДНК. Затем исследователи преобразовывали РНК в более устойчивую ДНК (именуемую комплиментарной ДНК — кДНК) и для хранения присоединяли ее к хромосоме какой-нибудь бактерии, используя прием резания и склеивания с помощью рестрикционных ферментов. Комплиментарной ДНК пользуются в биологических лабораториях по всему миру, так что недостатка в ней нет. Следующий шаг связан с секвенированием кДНК и сравнением ее с другими секвенированными генами. Данный подход, названный экспрессируемыми ярлыками11, был не нов для Вентера. О нем впервые написал химик-биолог Пол Шиммел в 1983 году, а известный генетик Сидни Бреннер и другие ученые широко использовали в конце 1980-х. Но благодаря АВ1 Sequencer и электронно-вычислительным рабочим станциям по возможностям секвенирования лаборатории Вентера не было равных.
В июне 1991 года Вентер написал, что при секвенировании посредством экспрессируемых ярлыков он определил около 330 активных генов в человеческом мозге. Одним словом, Вентер определил и расшифровал более 10% известных миру человеческих генов — и все это за несколько месяцев. Со свойственной ему прямотой Вентер заявил, что «усовершенствования в технике секвенирования ДНК теперь сделали, по существу, доступным полное обследование хромосомного набора организма по экспрессируемому гену».
Следующая статья Вентера, опубликованная в журнале Nature, еще больше подогрела недовольство некоторых биологов. В этой статье он сообщал об очередных 2375 человеческих генах, выявленных в мозге, что в 2 раза превышало число генов, расшифрованных к тому времени остальным научным сообществом. Ученые опасались, что секвенирование кДНК начнут финансировать вентеровским методом экспрессируемых ярлыков как более дешевой альтернативы расшифровке всего человеческого генома. Данный подход избегал бы искусных приемов экспрессии генов вроде lac-оператора, поскольку места соединения активаторов и репрессоров не будут секвенироваться.
Угроза патентования
Причиной дополнительных беспокойств стало патентование метода экспрессируемых ярлыков. Служба передачи технологии НИЗ подала заявку на патентование первых 330 генов еще до первой публикации Вентера в Scienceи присовокупила к патентованию еще 2421 ген до появления статьи в Nature. Поднялся шум, не утихающий доныне. Французский министр по науке Юбер Курьян сказал, что «нельзя предоставлять патент на то, что является нашим общим достоянием». Джеймс Уотсон, глава международного консорциума HumanGenomeProject, заявил, что метод экспрессируемых ярлыков «доступен обезьянам».
Однако глава НИЗ Бернадин Хили посчитала, что патентная заявка была законной, и отмела обвинения ученых, представив их «бурей в стакане воды». Она наказала Уотсону не нападать на Вентера публично и попросила Вентера советоваться с ней по поводу исследований генома человека. Уотсон уволился в апреле 1992 года, заявив о «непримиримости» своей позиции. Тем временем Вентер попросил 10 млн долларов для расширения своей работы по секвенированию, но ему было решительно отказано на основе данного его же коллегами в НИЗ заключения. Вентер уволился из НИЗ в июле 1992 года и основал Институт исследований генома (TIGR). Начав с 30 секвенаторов ABI 373A, 17 рабочих станций ABI Catalist и ЭВМ SPARCenter 2000 фирмы Sun, оснащенной соответствующими программными средствами базы данных, Вентер начал наращивать секвенирование на основе «экспрессируемых ярлыков» последовательности генов у модельных организмов. При стоимости одного устройства 100 тыс. долларов для финансирования такого предприятия нужны были толстосумы.
Финансирование обеспечил наплыв в биологию предпринимателей, Уоллис Стайнберг, глава компании HealthCareInvestitionCorporation, и изобретатель зубной щетки Рич вложили в проект 70 млн долларов. Таким образом, Вентер мог спокойно претворять в жизнь свои идеи. Была создана как дочернее предприятие компания HumanGenomeSciences(HGS) для коммерческого использования результатов исследований генома человека. Вентер был доволен и заявил: «Каждый ученый мечтает о благодетеле, согласившемся вложить средства в его идеи, чаяния и способности». Единственное условие — предоставление полученных данных в распоряжение компании на 6—12 месяцев, прежде чем их можно будет обнародовать. Его научные коллеги восторгались значительно меньше. Некоторые даже окрестили его Дартом Вентером [намекая на Дарта Вейдера из фильма «Звездные войны», рыцаря, переметнувшегося на сторону зла].
Тем временем НИЗ назначил нового руководителя Центра по исследованию генома человека. Известный генетик из Мичиганского университета Фрэнсис Коллинз стал вторым руководителем центра. В ходе работы этот финансируемый государством консорциум обнародовал ряд выдающихся результатов. В 1996 году усилиями более чем сотни лабораторий Европы, США, Канады и Японии удалось завершить составление генома пивных дрожжей. Этот эукариотный одноклеточный организм содержит в своей ДНК 6 тыс. генов, собранных из 12 млн пар оснований нуклеотидов. К середине отпущенного на проект генома человека срока было расшифровано менее 3% генома, а затраты консорциума уже превысили оговоренные суммы. Коллинз призвал к ускорению работ и выдвижению свежих идей, но это мало помогло делу.
Секвенирование дроблением
Когда международный консорциум пытался ускорить свою работу, лаборатория Вентера TIGR решила прибегнуть к новой тактике: секвенированию дроблением. Сотрудник Университета Джонса Хопкинса и Нобелевский лауреат Хамилтон Смит, открывший 20 лет назад рестрикционные ферменты (рестриктазы), выдвинул поразительную идею: сначала ультразвуком посечь ДНК на тысячи кусочков произвольной величины, а затем на устройствах-роботах ABI произвести отдельно секвенирование всех кусочков. Заложить полученные данные в ЭВМ, и пусть специальные программы отыскивают перекрывающиеся участки, чтобы тем самым можно было «сшить» математически кусочки, создавая одну непрерывную ДНК. Данный прием оказался результативным при моделировании, и Вентер не побоялся рискнуть. TIGR расшифровала весь геном бактерии Haemophilusinfluenzaeза 13 месяцев, затратив в два раза меньше средств по сравнению с проектом генома человека. Вскоре TIGR завершила составление последовательности нуклеотидов Mycoplasmagenitalium, мельчайшего из известных самостоятельных живых организмов, а также генома нескольких архей. После предоставления для всеобщего пользования своих ценных сведений Вентер вырос в глазах своих ученых собратьев.
Метод секвенирования дроблением работал в ситуациях с бактериями, но оказался не слишком скор, чтобы можно было вовремя завершить проект генома человека. В конце 1997 года отношения между лабораторией Вентера TIGR и ее дочерним предприятием HGS полностью расстроились. Несмотря на задолженность HGS его лаборатории 38 млн долларов, Вентер освободил HGS от данного обязательства и получил возможность более быстрого предоставления сведений о секвенировании, поскольку отпадала необходимость давать их на просмотр HGS.
Вентер между тем вынашивал еще более грандиозные замыслы, связанные с именем Майка Ханкапиллера. После создания вместе с Лероем Худом первого устройства по секвенированию, ABI 373A, Ханкапиллер не только внес несколько усовершенствований, но и значительно изменил сам процесс. Вместо пропускания отрезков ДНК вдоль пластины геля посредством электрофореза для их разделения Ханкапиллер разработал способ, при котором ДНК пропускалась сквозь тонкие, заполненные жидкостью капиллярные трубки. Наличие многих трубок при одном прогоне, как и другие усовершенствования в новом устройстве, ABI PRISM 3700, дало восьмикратное повышение скорости по сравнению с существующими устройствами. После показа опытного образца Ханкапиллер предложил Вентеру объединиться с ним для расшифровки всего генома человека. После некоторых раздумий Вентер согласился. Нужно было кое-что доделать, ведь методы, столь хорошо показавшие себя при работе с бактериями, нельзя использовать для изучения тысячекратно более сложного гена человека.
Вентер любил испытывать себя. После переговоров, больше напоминавших предостережение, с руководителем проекта генома человека Коллинзом Вентер объявил о создании новой компании и ее главной цели: расшифровке всего генома человека всего за три года, что существенно опережало сроки проекта генома человека. Его новое детище носило название «Силер» (от лат. celeris— быстрый). Девизом компании стали слова «Поспешай, открытия не ждут».
Вентеру опять все удалось. Научный мир был посрамлен, но теперь успехи Вентера вынуждали критиков проявлять осторожность: может, ему и впрямь удастся задуманное. Вентер понимал, что рискует. У него был лишь проверенный опытный образец устройства секвенирования, но отсутствовало программное обеспечение, поскольку старые методы не годились для нового генома. Следующим ходом Вентера было решение допустить в биологию программистов ЭВМ, которых называл учеными по алгоритмам. «Сшивание» перекрывающихся последовательностей пар оснований нуклеотидов для получения всего генома представлялось трудной вычислительной задачей, но значительные средства, вкладывавшиеся Вентером в новейшее вычислительное оборудование и специалистов, окупились сторицей. К 1998 году его сотрудники создали казавшуюся работоспособной программу.
Для опытной проверки Вентер провел секвенирование излюбленного в биологии модельного организма — Drosophilamelanogaster, плодовой мушки. Состоящую из 165 млн пар нуклеотидных оснований, 13 600 генов ДНК установили менее чем за четыре месяца, как раз вовремя, чтобы записать ее на диски CD-ROM, которыми снабдили все места на одном научном совещании за день до выхода статьи о геноме в журнале Science.
Международный консорциум «Проект генома человека» не сидел сложа руки. С получением дополнительных средств, особенно от британского благотворительного фонда Уэллкома (Wellcome Trust) 12, удалось обзавестись новыми устройствами секвенирования (от ABI и конкурентов Майкла Ханкапиллера) и нарастить свои усилия, сжав тем самым сроки. Гонка продолжалась.
Соревнующиеся стороны временами вступали в переговоры, но напряжение в отношениях нагнетали средства массовой информации, особенно если учесть резкость Вентера и непреклонную учтивость Коллинза. С приближением окончания гонки слухи о непростых отношениях между двумя коллективами достигли Белого дома. На одном из совещаний президент Билл Клинтон передал записку своему советнику по науке Нилу Лейну с лаконичным приказом: «Разберись — сделай так, чтобы эти ребята работали вместе». Улаживать все выпало [главе Службы биологических и экологических исследований] Аристиду Патриносу, руководителю проекта генома человека от Министерства энергетики США. Весной 2000 года он пригласил Коллинза и Вентера к себе домой в Роквилл, штат Мэриленд, на дружеское чаепитие. Там они пришли к соглашению, что сообщение о расшифровке генома человека будет обнародовано ими совместно 26 июня 2000 года. В разговоре по спутниковой связи с премьер-министром Великобритании Тони Блэром президент Клинтон сказал: «Современная наука подтвердила то, что мы впервые узнали из верований предков. Самое важное свидетельство жизни на этой земле — это наша человеческая общность».
План на вторую половину игры
Несмотря на поднятую СМИ шумиху, гонка по расшифровке генома человека в действительности начиналась заново. Поясним, в чем здесь суть. ДНК содержит схему работы всего организма. Но прежде чем организм начнет справлять свои надобности, схему необходимо переписать на РНК, которая в свою очередь передается белкам, а те затем приступают к сборке каждой отдельной клетки и выполнению своих обязанностей.
Белки представляют собой молекулы, которые, по сути, и обеспечивают жизнедеятельность клеток. Геном указывает РНК, какие белки следует собирать, но прежде чем они начнут выполнять свои многочисленные обязанности, происходят изменения (белки скручиваются, взаимодействуют, присоединяют к себе группы Сахаров или метила и т. д.), в итоге проявляя некие видимые признаки. Теперь понятно, почему хромает сравнение человеческого генома с чашей Грааля. Знание последовательности нуклеотидов в геноме ничего не дает. Недостаточно знание только схемы.
Более приемлемо такое сравнение.
В отдаленном будущем один археолог находит в огромной пещере эскадрилью сверхзвуковых транспортных самолетов, заправленных горючим и готовых к вылету. Летчики-испытатели поднимают их в воздух, и оказывается, что они полностью работоспособны, однако отсутствуют руководства по их эксплуатации, устройству и сборке. Инженеры приступают к их изучению, разбирают, пытаясь восстановить, как их собирали. Достигнуты некоторые успехи, но самолеты слишком сложны, и инженеры не в состоянии понять многих их функций.
Значительно позже рядом другой археолог находит большое собрание бумаг, написанных на давно исчезнувшем языке. Все несказанно рады, так как теперь удастся разгадать тайны самолетов. После расшифровки оказывается, что найдены бумаги не с планами по строительству сверхзвуковых транспортных самолетов, а лишь с перечнем частей, необходимых для создания орудий по сборке самолетов. Для начала неплохо, но придется приложить еще немало усилий, прежде чем удастся разобраться в проекте и понять все тонкости работы древнего сверхзвукового транспортного самолета.
Приведем слова Дж. Крейга Вентера: «Секвенирование — лишь только начало». Рассказывая о своей десятилетней работе в НИЗ по изучению белка на поверхности клеток сердца, чувствительного к адреналину и приводящего в действие реакцию «выживания», Вентер отметил: «То, что потребовало от меня десяти лет работы, теперь я могу сделать за 15 секунд на ЭВМ».
Протеомика: следующий рубеж
Для ответа на вопрос о молекулярной основе жизни сначала надо уяснить, что же мы ищем, а затем найти возможность осуществить этот поиск. Вот что сталкивает людей, взявшихся решать данную задачу: подробная последовательность нуклеотидных оснований в человеческом геноме определяет порядок сборки РНК аминокислот для получения заданной белковой молекулы. (Прежде исходили из простой зависимости между генами и белковыми молекулами: один ген, одна молекула. Но все оказалось значительно сложнее. Между заданной ДНК и конечными белками, определяющими работу клетки, случаются отклонения. Один ген может в итоге создать много различных белков.) Человеческий геном состоит примерно из 30 тыс. генов, что составляет лишь 2% общего числа пар нуклеотидных оснований. Остальные 98% генома часто неверно называют бросовыми из-за нашего неведения об их возможном предназначении. Полный состав человеческих белков, закодированных в геноме — протеом, — значительно превышает 100 тыс., возможно, приближается к миллиону. Белки — это ключ к устройству и работе клетки. Белки определяют классические биологические признаки.
Протеомика сосредоточена на уяснении того, как разветвленная сеть белков управляет клетками и тканями. Следующая нерешенная, требующая огромных усилий задача связана с картированием протеома.
План действий здесь таков:
Определение полного состава белков в клетке, ткани или организме.
Выяснение взаимодействия этих белков с другими, образующими разветвленную сеть белками.
Выявление точной трехмерной картины каждого белка, что позволит ученым находить связывающие участки (например, такие, где белки наиболее восприимчивы к действию лекарств).
На пути претворения данного плана в жизнь встречается много трудностей. Прежде всего, нет единого человеческого протеома. Клетки мозга образуют одно множество белков, клетки ногтей — другое, клетки крови — третье и т. д. А собираемые белки сильно зависят от различных факторов, таких как болезнь, потребленные накануне продукты и умственное или даже душевное состояние. Каждое состояние организма порождает различный протеом. Кроме того, белки представляют собой крайне сложные образования. Они по-разному укладываются, не всегда предсказуемым образом (можете использовать мощь своего компьютера для расчета возможных укладок белков, обратившись на узел folding.stanford.edu/ См: Список идей, 8. Укладка белков).
Что касается опытов, большие установки автоматизировали процесс капиллярного электрофореза, обеспечивая быстрое секвенирование ДНК. При составлении карты протеома сегодня используют несколько различных методов, но ни одному из них не удалось потеснить секвенаторов ДНК. Продолжается разработка программного обеспечения. Возникающие трудности были подытожены в 2001 году на конференции по протеомике «Проект протеома человека»: «Гены стали доступнее».
Началась вторая половина гонки. В январе 2002 года две группы ученых сообщили о составлении карт по белковому взаимодействию для Saccharomycescerevisae, пивных дрожжей. Кроме того, 5 апреля 2002 года пришло сообщение о получении предварительной карты генома риса от двух групп ученых — из Пекинского института геномики (для индийской разновидности риса) и всемирно известной сельскохозяйственной компании [из Швейцарии] Syngenta(для японской разновидности риса). Гены зерновых имеют значительное сходство.
Отдельные группы ученых, входящие в состав международного консорциума «Международный проект по дешифровке генома риса» (IRGSP), взялись за изучение риса. Рис содержит 430 млн пар нуклеотидных оснований, тогда как у кукурузы это число составляет 3 млрд., а у пшеницы — 16 млрд. И генов у всех них больше, чем у человека, и этим, возможно, объясняется наша зависть. Выяснение того, как различия в геноме ведут к различиям признаков организмов, и вызывает интерес ко второй половине этой гонки.
Нынешнее положение еще можно сравнить с видением сосуда, который мы рассчитываем заполнить, уяснив до конца, как взаимодействуют молекулы ДНК, РНК и белка. Он может представляться нам либо наполовину полным, либо наполовину пустым.
Последствия и бедствия
В отличие от других нерешенных проблем, протеом ближе к цели. Взять нас с вами. Человеческий геном поможет каждому из нас, ибо есть вещи, которые мы наверняка согласимся уяснить и поправить. Решение воспользоваться знанием выходит далеко за рамки чистой науки, которой движет любопытство. Однако человеку свойственно искать практические выгоды. Пришельцы, совершившие переворот в биологии, были движимы не одним только любопытством. Те, кто субсидировал частные лаборатории по дешифровке генома, сообразовывались не только с человеческим благом, но и с сулимой выгодой. Как только становится возможным влиять на условия человеческого существования, выступают иные соображения — нравственные.
Использование знаний о человеческом геноме несет и добро, и зло. Возможно, памятуя о Манхэттенском проекте, первый глава Национального центра по изучению генома человека Джеймс Уотсон 5% средств центра направлял на изучение нравственных, правовых и социальных последствий проекта. Он писал: «Нам более не надо живых укоров, вопросов и ответов, как наука, оказавшись в нечистоплотных руках, способна принести неисчислимые бедствия».
Вопросы применения генетических знаний на практике выходят за рамки нашей книги, но все же вкратце обрисуем несколько таких приложений в надежде прояснить состояние соответствующей отрасли знания, чтобы в итоге принимались взвешенные с нравственной точки зрения решения о претворении их в жизнь.
Биочип. Посредством метода фотолитографии, сходного с тем, что используется при производстве кристаллов (чипов) для ЭВМ, сотни тысяч биологически активных молекул — ДНК, РНК, белков — укладываются столбиками и рядами на стеклянный или кремниевый кристалл. Для проверки биологические молекулы метят флуоресцентным красителем, затем намывают на кристалл. Нанесенные на кристалл молекулы ДНК или белка, по словам изобретателя Стива Фодора, действуют «подобно тонким полоскам молекулярной "липучки"». Проверяемые молекулы комплиментарны к молекулам на кристалле и прилепятся к ним, после чего при лазерном сканировании предстанут в виде светящейся точки. Выходные данные сканирования затем выводятся на экран, обрабатываются ЭВМ и, наконец, используются для выявления мутаций, получения сведений о ходе болезни или лечения, для определения, какие гены взаимодействуют друг с другом при росте клетки, и изучения многих иных сторон генетики.
Сельскохозяйственное применение. Посредством рестрикционных ферментов можно изменять ДНК растений для получения нужных признаков: высокой урожайности, более питательной пищи для людей и животных, повышенного содержания витаминов и минералов, большей устойчивости к заболеваниям, гербицидам для облегчения борьбы с сорняками, роста устойчивости к насекомым-вредителям, способности связывать азот для уменьшения количества вносимых удобрений и повышения удойности коров на молочных фермах.
Генетический контроль у человека. Поскольку наследственные признаки у человека целиком зависят от генов, мы можем отбирать их для потомства и предсказывать вероятность генетических заболеваний у людей. Такая возможность сопряжена с далеко идущими этическими последствиями.
Изучение стволовых клеток. После оплодотворения яйцеклетки зародыш содержит всю генетическую информацию о дальнейшем развитии организма. Клетки, способные развиться в любую клетку организма, именуются зародышевыми стволовыми клетками. По мере роста организма клетки специализируются, утрачивая гибкость стволовых клеток. Стволовые клетки с заложенным в них потенциалом можно выращивать и использовать для таких крайне важных целей, как восстановление поврежденных сердечных мышц или тканей позвоночника. Однако методы выращивания подобных клеток сопряжены с этическими вопросами, до конца еще не решенными. Иной подход — дождаться более зрелого возраста и выращивать специализированные клетки взрослых, которые столь же полезны.
Клонирование. Поначалу клонирование заключалось в замене ядра яйцеклетки ядром другой клетки с последующим внедрением новой яйцеклетки в матку суррогатной матери, которая в итоге даст потомство, чьи генетические свойства будут одинаковыми со свойствами пересаженного ядра. После овладения данным методом успешные опыты были проведены на мышах, свиньях, коровах, а наибольшую известность получила ныне погибшая овца Долли.
Итак, можно ли клонировать человека? Исходя из современной биологической практики это вполне возможно, и некоторые, правда неподтвержденные, заявления уже последовали со стороны секты раэлитов13. Нужно ли это делать — другой вопрос, относящийся к нравственной и правовой сферам. Не менее важна возможность использования рестрикционных ферментов для вырезания и вклеивания человеческой ДНК в ДНК животных с последующим клонированием животных, превращая их в фабрики по производству лекарственных белков, редких гормонов или даже целых органов для пересадки людям при повреждении или заболевании их собственных органов.
Небольшая подборка использования геномики (а значит, и протеомики) дает представление о нравственной стороне геномики и протеомики (более подробно см.: Список идей, 9. Генетические технологии).
Решение головоломки: почему, как, кто и где, когда?
Почему. Протеомика дает возможность создавать новые, более действенные лекарства и диагностические средства. Однако число пар азотистых оснований, генов и белков, с которыми приходится иметь дело, ставит трудную задачу перед теми, кто исследует, создает и испытывает подобные средства.
Вы только взгляните на эти числа: 3 млрд. пар нуклеотидных оснований, 30 тыс. генов, сотни тысяч белков присутствуют в человеческом организме. Они усложняют и без того трудную задачу, требуя методов по обработке огромных объемов данных. Новая отрасль — биоинформатика вызвала большой наплыв ученых — специалистов по составлению алгоритмов — в качестве равноправных биологов, давая возможность обеспечить их орудиями сбора, упорядочивания и толкования биологически значимых данных. Хотя биоинформатика и может оказаться ключевой в решении общей задачи, не исключено, что объем задачи указывает на ее неразрешимость. Сложность взаимодействий белков делает всю биологическую систему объектом, где крайне малые изменения на входе, легко вызываемые великим множеством обычных в таком деле возмущающих факторов, неизбежно приводят к совершенно неожиданным последствиям (подобный вопрос встает в гл. 5 о предсказании погоды).
Некоторым образом данная проблема перекликается с проблемой в физике, где отдельные частицы образуют совокупности, поведение которых предсказывается на основе вероятностных методов. Данный подход, именуемый статистической механикой, доказал свою действенность. В физике частицы одинаковы и по численности значительно превосходят биологические молекулы, так что законы больших чисел обеспечивают сходство. Биологические системы имеют дело с неодинаковыми единицами, и их число существенно меньше, например, количества атомов в содержащемся в комнате воздухе. Поэтому выгоды, получаемые от использования статистики, нельзя применить к решению этой задачи. Возможно, будет создан новый вид статистической математики. И биоинформатика, похоже, та область, где это может произойти.
Кто и где. Другая возможность состоит в том, что биологии поможет очередной наплыв ученых из других отраслей знаний, или же координаторы более обширных проектов вроде Ф. Коллинза, либо неуемные одиночки вроде Дж. Крей-га Вентера. Помимо Celeraв список компаний, включившихся ныне в исследования по протеомике, входят Cellzomeиз Германии, Hybrigenicsиз Франции и MDSProteomicsиз Канады.
Когда. По мнению профессора фармацевтической химии Олме Берлингейма из Калифорнийского университета в Сан-Франциско, «мы сейчас имеем возможность значительно быстрее определять состав белка в человеческом организме. Работа должна завершиться за пару лет».
Ученые при определении белков, входящих в те или иные клетки или ткани, обычно прибегают к двум основным способам: двухмерному гель-электрофорезу и масс-спектрометрии. Некоторые компании пытаются по возможности усовершенствовать и автоматизировать эти и другие методы.
Представляется, что после установления устройства человеческого генома и изучения всех его признаков данный узел удастся развязать, и останется лишь воспользоваться найденными закономерностями для выяснения подробностей. Но это не так. Новые сведения о геноме уже преподнесли немало неожиданностей. Поэтому не стоит удивляться очередным открытиям.
|
|
|
 Скачать 2.98 Mb.
Скачать 2.98 Mb.





