02 глава Асептика и антисептика. Асептика и антисептика общие положения, определения
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
|
Биологическая антисептика Виды биологической антисептики В отличие от видов антисептики, рассмотренных ранее, биологическая антисептика - не просто биологические методы уничтожения микроорганизмов. Биологическую антисептику разделяют на два вида: • биологическая антисептика прямого действия - использование фармакологических препаратов биологического происхождения, непосредственно воздействующих на микроорганизмы; • биологическая антисептика опосредованного действия - использование фармакологических препаратов и методов различного происхождения, стимулирующих способности макроорганизма в борьбе с микроорганизмами. Основные фармакологические препараты и методы Основные препараты и методы биологической антисептики представлены в табл. 2-1. Таблица 2-1. Основные препараты и методы биологической антисептики 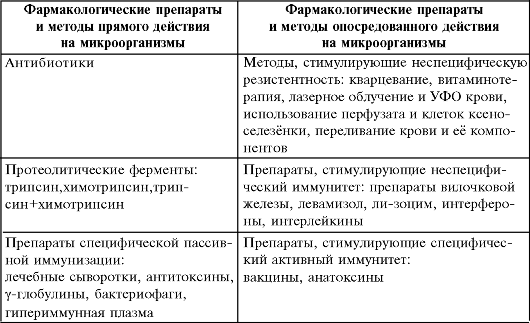 Протеолитические ферменты Протеолитические ферменты сами не уничтожают микроорганизмы, но лизируют некротические ткани, фибрин, разжижают гнойный экссудат, оказывают противовоспалительное действие. Трипсин, химотрипсин - препараты животного происхождения, их получают из поджелудочной железы крупного рогатого скота. Террилитин - продукт жизнедеятельности плесневого грибка Aspergillis terricola. Ируксол - мазь для ферментативного очищения; комбинированный препарат, в состав которого входят фермент клостридилпептидаза и антибиотик хлорамфеникол. Применение ферментов для лечения гнойных ран и трофических язв позволяет быстрее добиться их очищения от некротических тканей, насыщенных микробами; такие ткани становятся для патогенных микроорганизмов хорошей питательной средой. В ряде случаев, по существу, производится некрэктомия без применения скальпеля. Препараты для пассивной иммунизации Из препаратов пассивной иммунизации наиболее часто используют следующие. Противостолбнячная сыворотка и противостолбнячный γ-глобулин - для профилактики и лечения столбняка. Противогангренозную сыворотку применяют для профилактики и лечения анаэробной инфекции. В арсенале хирургов существуют антистафилококковый, антистрептококковый и антиколи-бактериофаги, а также поливалентный бактериофаг, содержащий несколько вирусов, способных репродуцироваться в бактериальной клетке и вызывать её гибель. Бактериофаги используют местно для промывания и лечения гнойных ран и полостей после идентификации возбудителя. Антистафилококковая гипериммунная плазма - нативная плазма доноров, иммунизированных стафилококковым анатоксином. Назначают при различных хирургических заболеваниях, вызванных стафилококком. Используют также антисинегнойную гипериммунную плазму. Методы стимуляции неспецифической резистентности К методам стимуляции неспецифической резистентности относят такие простые мероприятия, как кварцевание, витаминотерапия и даже полноценное питание, так как все они улучшают функции иммунной системы. Более сложными методиками признаны УФО и лазерное облучение крови. Методы приводят к активации фагоцитоза и системы комплемента, улучшают функцию переноса кислорода и реологические свойства крови, что также важно для купирования воспалительного процесса. Эти способы применяют как в острой фазе инфекционного процесса, так и для профилактики рецидивов, например, при роже и фурункулёзе. В последнее время всё большее применение в клинике находят препараты ксеноселезёнки (селезёнки свиньи). При этом используют свойства содержащихся в ней лимфоцитов и цитокинов. Возможна перфузия через цельную или фрагментированную селезёнку. Существуют методики приготовления ксеноперфузата и взвеси клеток селезёнки. Важным методом стимуляции иммунной системы служит переливание крови и её компонентов, прежде всего плазмы и взвеси лимфоцитов. Однако эти способы используют только при тяжёлых инфекционных процессах (сепсисе, перитоните и пр.). Препараты, стимулирующие неспецифический иммунитет К лекарственным веществам, стимулирующим неспецифический иммунитет, относят препараты вилочковой железы. Их получают из вилочковой железы крупного рогатого скота. Они регулируют соотношение Т- и В-лимфоцитов, стимулируют фагоцитоз. Левамизол в основном стимулирует функции лимфоцитов, лизоцим усиливает бактерицидную активность крови. Но в последнее время вместо них стали использовать интерфероны и интерлейкины, обладающие более целенаправленным воздействием на иммунную систему. Особенно эффективны новые препараты интерферон альфа-2а, интерлейкин-2 и интерлейкин-1b, полученные методом генной инженерии. Препараты, стимулирующие специфический иммунитет Из препаратов для стимуляции активного специфического иммунитета в хирургии наиболее часто используют стафилококковый и столбнячный анатоксины. Антибиотики Антибиотики - вещества, являющиеся продуктом жизнедеятельности микроорганизмов, подавляющие рост и развитие определённых групп других микроорганизмов. Это важнейшая группа фармакологических препаратов, используемых для лечения и профилактики хирургической инфекции. История антибиотиков начинается в XIX веке. В 1871 г. профессор Санкт-Петербургской Военно-медицинской академии В.А. Монассеин описал способность плесневых грибов подавлять развитие бактерий. В 1872 г. А.Г. Полотебнов сообщил о положительном результате применения плесени для лечения гнойных ран, а чуть позже И.И. Мечников, исследуя явление фагоцитоза, впервые предположил возможность использования сапрофитных бактерий для уничтожения патогенных микроорганизмов. В 1896 г. итальянский врач Б. Гозио выделил из культуры грибка Penicillium микофеноловую кислоту, оказывающую бактериостатическое действие на возбудителя сибирской язвы. Это был фактически первый в мире антибиотик, но широкого применения он не получил. В начале XX века были выделены антибиотики из культуры синегнойной палочки, но их эффект был непостоянен, вещества были нестойкими. Далее наступила «эра пенициллина». В 1913 г. американцы Альсберг и Блэк выделили из грибка рода Penicillium антимикробное вещество - пенициллиновую кислоту, но производство и клиническое применение препарата не состоялось из-за мировой войны. В 1929 г. англичанин Флеминг вырастил грибок Penicillium notatum, способный уничтожать стрептококки и стафилококки, а в 1940 г. группа учёных Оксфордского университета во главе с Говардом Флори выделила из этого грибка в чистом виде вещество, названное ими пенициллином. В 1943 г. в США впервые было начато промышленное производство антибиотика пенициллина. Первый отечественный пенициллин был получен в 1942 г. академиком З.В. Ермольевой из грибка Penicillium crustosum, продуктивность которого была выше английского. Появление пенициллина вызвало настоящую революцию в хирургии, да и в медицине вообще. После нескольких инъекций препарата поправлялись больные, ещё недавно обречённые. Казалось, что все виды заболеваний, вызываемых микроорганизмами, побеждены. У медиков началась некоторая эйфория, но вскоре выяснилось, что многие штаммы микроорганизмов устойчивы к пенициллину, причём эти штаммы стали выявлять всё чаще и чаще. Учёные стали открывать новые группы антибиотиков. В 1939 г. Дюбо получил грамицидин. В 1944 г. Шатц, Буги и Ваксман выделили стрептомицин, что позволило резко снизить смертность от тубер кулёза. В 1947 г. Эрлих получил хлорамфеникол. В 1952 г. Мак Гупре - эритромицин. В 1957 г. Умизава - канамицин. В 1959 г. Сенен - рифампицин. В 50-х годах в лаборатории Г. Флори был получен первый антибиотик из грибка Cephalosporum, положивший начало большой группе современных антибиотиков - цефалоспоринов. Однако со всеми антибиотиками была отмечена аналогичная картина - всё чаще начинали образовываться резистентные к ним штаммы бактерий. В последние десятилетия созданы новые группы антибиотиков, более эффективных в борьбе с современной хирургической инфекцией (фторхинолоны, карбапенемы, гликопептиды). Основные группы антибиотиков Ниже представлены основные группы антибиотиков. В скобках указаны механизм и спектр действия, возможные осложнения. I. Бета-лактамы 1. Пенициллины (ингибируют синтез клеточной стенки, в основном широкий спектр действия): • полусинтетические: оксациллин, ампициллин, амоксициллин; • пролонгированные: бензатина бензилпенициллин, бензатина бензилпенициллин + бензилпенициллин прокаина + бензилпенициллин, бензатина бензилпенициллин + бензилпенициллин прокаина; • комбинированные: амлициллин + оксациллин, амоксициллин + клавулановая кислота, ампициллин + сульбактам. Клавулановая кислота и сульбактам - ингибиторы пенициллиназы, синтезируемой микроорганизмами. 2. Цефалоспорины (нарушают синтез клеточной стенки, широкий спектр действия, нефротоксичны в высоких дозах): • I поколение: цефалексин, цефазолин; • II поколение: цефамандол, цефокситин, цефаклор, цефуроксим; • III поколение: цефтриаксон, цефотаксим, цефиксим, цефтазидим; • IV поколение: цефепим. 3. Карбопенемы (нарушение синтеза клеточной стенки, широкий спектр действия): • меропенем; • комбинированный: имипенем + целастатин натрия. Целастатин - ингибитор фермента, влияющего на метаболизм антибиотика в почках. 4. Монобактамы (нарушают синтез клеточной стенки, широкий спектр действия): II. Другие 5. Тетрациклины (подавляют функции рибосом микроорганизмов, широкий спектр действия): • тетрациклин; • полусинтетические: доксициклин. 6. Макролиды (нарушают синтез белка в микроорганизмах, гепатотоксичны, воздействие на желудочно-кишечный тракт): • эритромицин, олеандомицин, азитромицин, кларитромицин. 7. Аминогликозиды (нарушают синтез клеточной стенки, широкий спектр действия, ото- и нефротоксичны): • I поколение: стрептомицин, канамицин, неомицин; • II поколение: гентамицин; • III поколение: тобрамицин, сизомицин; • полусинтетические: амикацин, нетилмицин. 8. Левомицетины (нарушают синтез белка в микроорганизмах, широкий спектр действия, угнетают гемопоэз): • хлорамфеникол. 9. Рифампицины (нарушают синтез белка в микроорганизмах, широкий спектр действия, вызывают гиперкоагуляцию, гепатотоксичны): • рифампицин. 10. Противогрибковые: • леворин, нистатин, амфотерицин В, флуконазол. 11. Полимиксин В (воздействует на грамотрицательные микроорганизмы, в том числе на сингнойную палочку). 12. Линкозамины (нарушают синтез белка в микроорганизмах): • линкомицин, клиндамицин (в анаэробной среде). 13. Фторхинолоны (подавление ДНК-гиразы микроорганизмов, широкий спектр действия): • III поколение: норфлоксацин, офлоксацин, ципрофлоксацин, пефлоксацин, энофлоксацин; • IV поколение: левофлоксацин, спарфлоксацин. 14. Гликопептиды: (изменяют проницаемость и биосинтез клеточной стенки, синтез РНК бактерий, широкий спектр действия, обладают нефротоксичностью, влияют на гемопоэз): • ванкомицин, тейкопланин. Одни из самых распространённых антибиотиков - бета-лактамные. При контакте с этими антибиотиками некоторые микроорганизмы начинают синтезировать расщепляющий их фермент (пенициллиназа, цефалоспориназа или β-лактамаза 1, 3, 5 и др.). Наименее часто бактерии синтезируют подобные ферменты на новые препараты последних поколений, что определяет их высокую активность и широкий спектр действия. Кроме того, в антибиотики дополнительно вводят ингибиторы лактамаз (клавулановую кислоту, сульбактам). Кроме представленной классификации по группам, антибиотики разделяют на препараты широкого и узкого спектров действия. Выделяют антибиотики первой очереди, или первого ряда (пенициллины, макролиды, аминогликозиды), второй очереди, или второго ряда (цефалоспорины, полусинтетические аминогликозиды, амоксициллин + клавулановая кислота и пр.), и резервные (фторхинолоны, карбапенемы). Выделяют антибиотики короткого и пролонгированного действия. Так, для поддержания бактерицидной концентрации в плазме крови бензилпенициллин следует вводить каждые 4 ч, а цефтриаксон (цефалоспорин III поколения) - 1 раз в сут. По токсичности выделяют ото-, нефро-, гепато- и нейротоксичные антибиотики. Существуют антибиотики со строго регламентированной дозой применения (линкозамины, аминогликозиды и пр.) и препараты, дозу которых можно увеличивать в зависимости от выраженности инфекционного процесса (пенициллины, цефалоспорины). Осложнения антибиотикотерапии Лечение антибиотиками имеет особенности. Прежде всего это связано с возможностью развития определённых осложнений. Основные осложнения антибиотикотерапии следующие: • аллергические реакции; • токсическое действие на внутренние органы; • дисбактериоз; • формирование устойчивых штаммов микроорганизмов. Аллергические реакции могут иметь типичные проявления: аллергическая сыпь (крапивница), отёк Квинке, нарушение дыхания, бронхоспазм - вплоть до развития анафилактического шока. Относительно большая частота таких осложнений связана с тем, что препараты имеют биологическое происхождение и чаще других вызывают соответствующую реакцию макроорганизма. Основные варианты токсического действия на внутренние органы указаны в приведённой выше схеме основных групп антибиотиков. Чаще нарушаются слух, функции почек и печени. Развитие дисбактериоза чаще возникает у детей, а также при длительном применении антибиотиков в высоких дозах, особенно широкого спектра действия. Наиболее незаметное, но очень неприятное осложнение - формирование устойчивых штаммов микроорганизмов, что приводит к неэффективности последующей антибиотикотерапии этими фармакологическими препаратами. Классические принципы рациональной антибиотикотерапии Особенности лечения антибиотиками связаны с влиянием вида препарата, дозы, кратности введения и длительности его применения на эффективность лечения и возможность развития осложнений. Не последнее значение имеют доступность и стоимость лекарственного средства. Основные классические принципы рациональной антибиотикотерапии следующие: • Применять антибиотики только по строгим показаниям. • Назначать максимальные терапевтические или, при тяжёлых инфекциях, субтоксические дозы препаратов. • Соблюдать кратность введения в течение суток для поддержания постоянной бактерицидной концентрации препарата в плазме крови. • Применять антибиотики курсами с продолжительностью от 5-7 до 14 сут. • При выборе антибиотика основываться на результатах исследования чувствительности микрофлоры. • Менять антибиотик при его неэффективности. • Учитывать синергизм и антагонизм при назначении комбинации антибиотиков, а также антибиотиков и других антибактериальных препаратов. • При назначении антибиотиков обращать внимание на возможность побочных эффектов и токсичность препаратов. • Для профилактики осложнений аллергического характера тщательно собирать аллергологический анамнез. • При длительных курсах антибиотиков назначать противогрибковые препараты для профилактики дисбактериоза, а также витамины. • Использовать оптимальный путь введения. Существует поверхностная (промывание ран), внутриполостная (введение в грудную, брюшную полости, полость сустава) и глубокая (внутримышечное, внутривенное, внутриартериальное и эндолимфатическое введение) антибиотикотерапия, а также пероральный способ. Современные принципы антибиотикотерапии В последние годы классические принципы рациональной антибиотикотерапии существенно дополнены. Появилось понятие та тика (или алгоритм) антибактериальной терапии хирургических инфекций. В основном это касается так называемой эмпирической терапии, то есть назначения антибиотиков, когда ещё не высеян штамм микроорганизмов и не определена его чувствительность к антибиотикам. При эмпирической терапии соблюдают два принципа: • принцип максимального спектра; • принцип разумной достаточности. Принцип максимального спектра подразумевает назначение антибиотиков максимального спектра действия и наибольшей эффективности для обеспечения наибольшей вероятности уничтожения возбудителя заболевания. В то же время при этом высока вероятность формирования резистентных штаммов микроорганизмов и неэффективности применения в последующем курсов других антибиотиков. Принцип разумной достаточности подразумевает назначение препарата не самого широкого спектра действия, но достаточно эффективного в отношении предполагаемого возбудителя. Вероятность достижения клинического эффекта весьма высока, и в то же время менее вероятно развитие резистентности, а в резерве остаются более мощные современные препараты. Выбор подхода и сочетание двух этих принципов индивидуальны и зависят от степени тяжести инфекции, состояния пациента, вирулентности микроорганизма. Весьма важно учитывать и экономическую сторону вопроса (на антибиотики приходится примерно 50% бюджета хирургического отделения). Если у больного тяжёлое инфекционное заболевание, при эмпирической терапии целесообразно назначать либо комбинацию антибиотиков первой очереди (например, полусинтетический пенициллин ампициллин и аминогликозид гентамицин), либо проводить монотерапию антибиотиком второй очереди (обычно это цефалоспорины II и III поколений, реже - современные макролиды). Лишь при особо тяжёлой инфекции и неэффективности других препаратов используют антибиотики резерва - фторхинолоны и карбапенемы. При эмпирической терапии необходимо учитывать местные (региональные) особенности частоты распространения микроорганизмов и их резистентности. Важный фактор - развилась инфекция в стационаре (нозокомиальная инфекция) или вне его. При этиотропной терапии выбор препарата зависит от результата микробиологического исследования (выделение возбудителя и определение его чувствительности к антибиотикам). В современной хирургии доказана высокая эффективность так называемой ступенчатой терапии - раннего перехода с парентерального введения антибиотиков на пероральные формы препаратов той же группы или близких по спектру действия. Антибиотикопрофилактика Ещё недавно само существование такого термина было невозможным, так как одним из принципов антибиотикотерапии была недопустимость применения антибиотиков в профилактических целях. Однако сейчас этот вопрос пересмотрен. Более того, в последнее время антибиотико-профилактике придают особое значение. Для профилактики послеоперационных осложнений наиболее важно создать бактерицидную концентрацию препарата в плазме крови и зоне операции на момент выполнения разреза и в течение 1-2-х суток после вмешательства (в зависимости от вида операции по степени инфицированности). Поэтому антибиотики вводят с премедикацией или при вводном наркозе и продолжают вводить в течение 1-2 сут послеоперационного периода. Такие короткие курсы высокоэффективны и экономически выгодны. Препаратами выбора для антибиотикопрофилактики служат цефалоспорины II и III поколений, амоксициллин + клавулановая кислота. |
