Антиоксидантная система крови человека. Курсовая антиоксидантная система крови. Белоруский государственный университет биологический факультет
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ Кафедра биохимии Антиоксидантная система плазмы крови в норме и при патологии Курсовая работа Полозова Алиса Алексеевна cтудент 2 курса cпециальность «Биология –Биохимия» Научный руководитель: Кандидат биологических наук, Старший научный сотрудник Корик Е. О. Минск, 2021 ВВЕДЕНИЕ Цель данной курсовой работы: провести теоритическое исследование группы ферментов антиоксидантной систе мы крови, а именно супероксиддисмутаза, каталаза, глутатион-пероксидаза, которые принимают активную роль в защите организма от окислительных процессов активных форм кислорода (перекись водорода H2O2). Также рассмотреть неферментативную антиоксидантную систему сыворотки крови, которые включают в себя различные витамины, убихинон, триптофан, фенилаланин, флаваноиды и т.д. Задачи курсовой работы: проанализировать структуры ферментов и неферментативных элементов системы крови изучить механизм действия ферментов антиоксидантной системы плазмы крови проследить условия активности ферментов провести теоритическое обоснование необходимости фермента и других соединений в организме человека выяснить роль ферментов в метаболизме в норме и при различных патологиях (окислительный стресс, диабет, дерматит, сердечнососудистые заболевания и т.д.) Объектом рассмотрения в данном реферате будет ферменты антиоксидантной сыворотки крови и неферментативные элементы антиоксидантной системы сыворотки крови,встречающийся в теле животных. При написании данной работы были использованы следующие методы: Аналитический метод. В данной работе приводится анализ информации по данной теме, и делаются соответствующие методы Теоритический метод. Вся работа выполнена на основе теоритических данных с разных источников ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ H2O2-перекись водорода GPX-глутатионпероксидаза SH-группа- тиольная группа GSH-глутатион E-SeH-селеноцистеин E-SeOH-селеновая кислота E-Se-SG-селен GSSG- дисульфид глутатиона Arg-аргинин СОД- супероксиддисмутаза К.- каталаза ГЛАВА 1 АНАЛИТИЧЕСКИЙ ОБЗОР ФЕРМЕНТА ГЛУТАТИОН-ПЕРОКСИДАЗЫ Структура фермента глутатион-пероксидазы 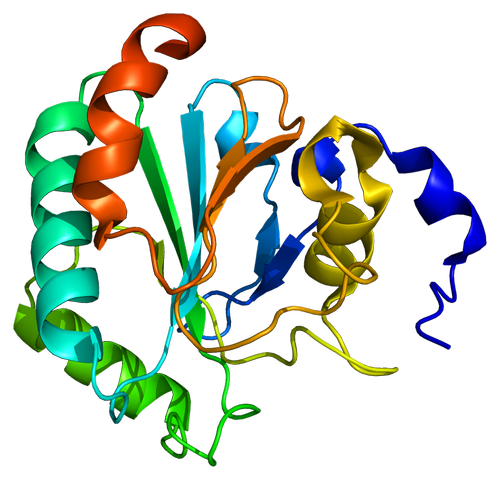 Рисунок 1.1- Структура глутатион-пероксидазы4 Шифр фермента: 1.11.1.9 1 Глутатионпероксидаза – это селензависимый фермент, следовательно, его активность зависит от содержания этого элемента в организме животных. Глутатионпероксидаза представляет из себя gглутаминил-L-цистсинил-глицин, трипептид, образованный остатками трёх аминокислот. Особенность строения глутатионпероксидазы в том, что в образовании пептидной связи между цистеином и глутаминовой кислотой, её g-карбоксильная группа последней2. Глутатионпероксидаза, как и каталаза, является гемсодержащим ферментом и обезвреживает H2O2. Обладая в 1000 раз большим сродством к пероксиду водорода, чем каталаза, она эффективна даже при низких его концентрациях. Глутатион является одним из важнейших антиоксидантов организма. В организме млекопитающих найдено 5 изоферментов глутатионпероксидазы. Уровень активности каждой изоформы зависит от типа органа и клеток. Цитозольная и митохондриальная глутатионпероксидаза (GPX1) восстанавливает гидропероксиды жирных кислот и H2O2 с использованием восстановленного глутатиона, содержит в активном центре селен, от содержания которого увеличивается экспрессия гена GPx-1 и соответственно активность изоформы2. Второй изофермент ГП-2 (GPx-2) не зависит от селена. Эта изоформа экспрессируется только в эпителии желудочно-кишечного тракта (ЖКТ), а у человека – еще и в печени; обнаруживается в основном в цитоплазме . Считают, что селензависимая GPx-1 катализирует восстановление как Н2О2, так и органических пероксидов (например, пероксидов жирных кислот до соответствующих спиртов), при этом не этерифицирует пероксильные радикалы липидов, тогда как независимая от селена GPx-2, которую обычно связывают с некоторыми формами глутатион-S-трансферазы, катализирует деградацию только органических гидропероксидов . На этом отличии в субстратной специфичности базируется раздельное определение активности этих изоформ. Полагают, что GPx-2 служит барьером для гидропероксидов и ксенобиотиков, содержащихся в пище8. Основным антиоксидантным ферментом плазмы является изоформа GPx-3, ген которой экспрессируется во многих тканях и главным образом в почках, откуда изоформа освобождается в кровеносное русло . Эта единственная изоформа из пяти известных существует во внеклеточном пространстве, из которого устраняет Н2О2 и гидропероксиды липидов, образующиеся в процессе нормального метаболизма. Кроме того, ее роль заключается в поддержании биодоступности NO·8. Фосфолипидгидропероксид-глутатионпероксидаза (GPX4) имеет чрезвычайно разнообразную субклеточную локализацию: в цитозоле, в ядре и в митохондриях. Более того, GPX4 существует в свободной и мембрано-связанной формах. Кроме того, GPX4 млекопитающих является еще структурным белком митохондриальной капсулы . Она может непосредственно восстанавливать гидропероксиды фосфолипидов, гидропероксиды жирных кислот и гидропероксиды холестерина, которые образуются после перекисного окисления мембран и окисления липопротеинов. GPX1 и GPX4 найдены в большинстве тканей. Однако GPX1 в основном локализуется в эритроцитах, печени и почках, тогда как GPX4 очень активно экспрессируется в эпителии почек и яичек. Активности двух других изоферментов – цитозольной (GPX2) и экстраклеточной (GPX3) глутатионпероксидазы – очень низки практически во всех органах и тканях млекопитающих, за исключением, соответственно, желудочно-кишечного тракта и почек. GPX3 является белком плазмы. Этот фермент не функционирует при низких концентрациях GSH. Все выше перечисленные ферменты в своих активных центрах содержат селен. Недавно обнаружен пятый изофермент глутатионпероксидазы – GPX5, который специфически экспрессируется в семенниках мышей2. GPx-5 эта изоформа является единственной среди GPx-изоферментов у млекопитающих, которая не содержит селенцистеин в активном центре4. Есть два основных типа глутатионпероксидазы. Один тип отличается тем, что в его активном центре селен, содержится в форме ковалентно связанного селеноцистеина. Этот селен-зависимый фермент активен как с органическими гидропероксидами, так и с H2O2.Второй тип глутатионпероксидазы состоит из белков, которые не зависят от селена для катализа и обладают незначительной активностью по отношению к H2O2.Этот класс составляют трансферазы глутатиона3. Роль фермента в метаболизме в норме и при различных патологиях Особенностью глутатионпероксидазы является то, что его активный центр содержит фермент селеноцистеин, т.е. такого цистеина, в котором сера заменена на селен. В качестве восстановителя для H2O2 фермент использует трипептидглутатион, содержащий цистеин с его SH-группой. Окисленный в результате реакции глутатион восстанавливается глутатионредуктазой. Она содержит по одному селен-цистеиновому остатку в каждой из 4-х субъединиц, и селен абсолютно необходим для проявления ферментативной активности . Атомы селена локализуются на поверхности фермента в его каталитическом центре4. Фермент катализирует восстановление гидропероксидов, используя восстановленный глутатион (GSH), что защищает клетки млекопитающих от окислительного повреждения: GPX LOOH + 2 GSH → LOH + GSSG + H2O GPX или Н2О2 + 2 GSН → GSSG + 2H2O, LOOH – гидропероксид, GSSG – окисленный глутатион 5 Механизм восстановления перекиси водорода двумя молекулами глутатиона, катализируемый селенопротеиновой глутатионпероксидазой (GPx), был изучен с помощью вычислений. Было показано, что первая элементарная реакция этого процесса (E-SeH) + H 2 O 2 → (E-SeOH) + H 2O проходит ступенчато. Вторая элементарная реакция (E-SeOH) + GSH → (E-Se-SG) + HOH. Последняя элементарная реакция (E-Se-SG) + GSH → (E-SeH) + GS-SG инициируется при координации второй молекулы глутатиона. Расчеты ясно показывают, что амидная основа остатка Gly50 принимает непосредственное участие в этой реакции, и присутствие двух молекул воды абсолютно необходимо для протекания реакции 2 O 2 + 2GSH → GS-SG + 2H 2 O6. Глутатионпероксидазы катализируют восстановление гидропероксидов (ROOH) глутатионом (GSH). «R» может быть алифатической или ароматической органической группой или просто водородом. Продукция H 2О, спирт (ROH) и дисульфид глутатиона (GSSG). Регенерация GSH из GSSG в клетке осуществляется ферментом глутатионредуктазой. Анализы активности глутатионпероксидазы основаны на измерении потребления ROOH или GSH. Альтернативно, производство GSSG контролируется путем связывания с реакцией, катализируемой глутатионредуктазой. Окисление НАДФН регистрируют спектрофотометрически или флуорометрически. Каталазы глутатиона выполняют двойную функцию: разложение H2O2 с образованием H2O и O 2 (каталитическая активность) окисление доноров H, например метанола, этанола, муравьиной кислоты, фенолов, с расход 1 моль перекиси (перекисная активность)7. Перекисное окисление липидов, катализируемое свободными радикалами, представляет собой непрерывный биологический процесс, который, если его не остановить, может вызвать повреждение клеточных и внутриклеточных мембран, что приводит не только к изменению структуры мембраны, но и к разрушению функциональной целостности мембраносвязанных ферментов6. В настоящее время в отношении более чем 60 заболеваний выявлена патогенетическая связь с оксидативным стрессом. Любые болезни, связанные с инфекцией, воспалением, синдромом ишемии-реперфузии, эндотелиальной дисфункцией, а также онкологическая патология и сахарный диабет сопровождаются массивным образованием свободных радикалов. Прооксидантными факторами являются алкоголь, курение, ионизирующее излучение, токсины, некоторые лекарства, а также факторы организма и образа жизни: возраст, избыточный вес, нерациональное питание, стрессы, гипокинезия9. Глутатион является важным регулятором внутриклеточного метаболизма. Их энзимопатии сопровождаются развитие различных патологических состояний. Сам глутатион играет ключевую роль в антиоксидантной защите клеток, регуляции апоптоза и желчевыведения коньюгации с ускорение элиминации многих ксено- и добиотиков. Снижение его внутриклеточного содержания - важный фактор развития болезни Альцгеймера, Паркинсона, шизофрении, катаракты, глаукомы, остеопороза канцерогенеза, ишемической болезни сердца, геморрагического и ишемического инсульта атеросклероза, эмфиземы легких, бронхиальной астмы, муковисцидоза, иммунодефицита, вирусных инфекций и сахарного диабета10. Регуляция активности глутатион-пероксидазы Активность антиоксидантных ферментов в тканях и органах зависит от многих причин: состояния организма и различных физиологических стимулов, возраста и пола, действия стрессорных внешних воздействий и внутренних факторов, диетических компонентов пищи, образа жизни. В норме уровень удельной активности антиокислительных ферментов и их изоформ в различных клетках и тканях организма генетически запрограммирован. Однако вследствие изменений в генетическом коде синтеза ферментов – ошибок в структуре ДНК-гена, кодирующего первичный дефектный белок, из-за декомпенсаций процессов биосинтеза, которые могут быть напряженными из-за малой “дозы гена” при гетерозиготности организма, из-за мутации, проявляющейся в других локусах, например, в факторах транскрипции, регулирующих экспрессию структурного гена (ответственного за проявление фермента), ферментная активность в одних случаях может отсутствовать, в других – быть сниженной, реже – повышенной. Мутации, приводящие к изменению уровней экспрессии генов, нарушают функционирование биохимических систем, что приводит к развитию соответствующих патологических состояний организма. Генетически обусловленная недостаточность активности антиоксидантных ферментов способствует аккумуляции реактивных продуктов свободнорадикальных реакций, что вызывает некомпенсированный окислительный стресс, проявляющийся на молекулярном, клеточном и организменном уровне8 . Глутатионпероксидазная активность обнаруживается почти во всех тканях организма человека и животных; наибольшая активность выявляется в печени и эритроцитах. По мнению некоторых авторов, между уровнем GSH в печени и активностью ГП наблюдается прямая связь . Считают также, что активность фермента в сыворотке крови людей не меняется в течение жизни . Большая часть активности ГП (до 70%) локализована в цитоплазме, в матриксе митохондрий – до 30%, при этом фермент не выявляется в ядрах и ядерных оболочках4 . Активность глутатион пероксидазы напрямую зависит от наличия и колическтва активных форм кислорода, а именно перекиси водорода в различных органах. Однако сама активность фермента в нормальных условиях должна быть равномерной и плавно увеличивающейся, что может быть нарушено в случае восспалительных процессов, болезней, возраста, мутаций (как со стороны гена, кодирующего фермент или же в общем из-за различных мутаций), также сильно влияет уровень стресса. Огромную роль в регуляции активности играют тирозинкиназы c-Abl и Arg активируются в клеточном ответе на окислительный стресс. Исследования демонстрируют, что c-Abl и Arg связываются с глутатионпероксидазой 1 (GPx1) и что это взаимодействие регулируется внутриклеточными уровнями оксидантов. Домены c-Abl и Arg SH3 связываются непосредственно с богатым пролином сайтом в GPx1 по аминокислотам 132–145. GPx1 также функционирует как субстрат для опосредованного c-Abl и Arg фосфорилирования Tyr-96. Результаты также показывают, что c-Abl и Arg стимулируют активность GPx и что эти киназы вносят вклад в GPx-опосредованную защиту клеток от окислительного стресса8. ГЛАВА 2 АНАЛИТИЧЕСКИЙ ОБЗОР ФЕРМЕНТА СУПЕРОКСИДДИСМУТАЗЫ Структура фермента супероксиддисмутазы   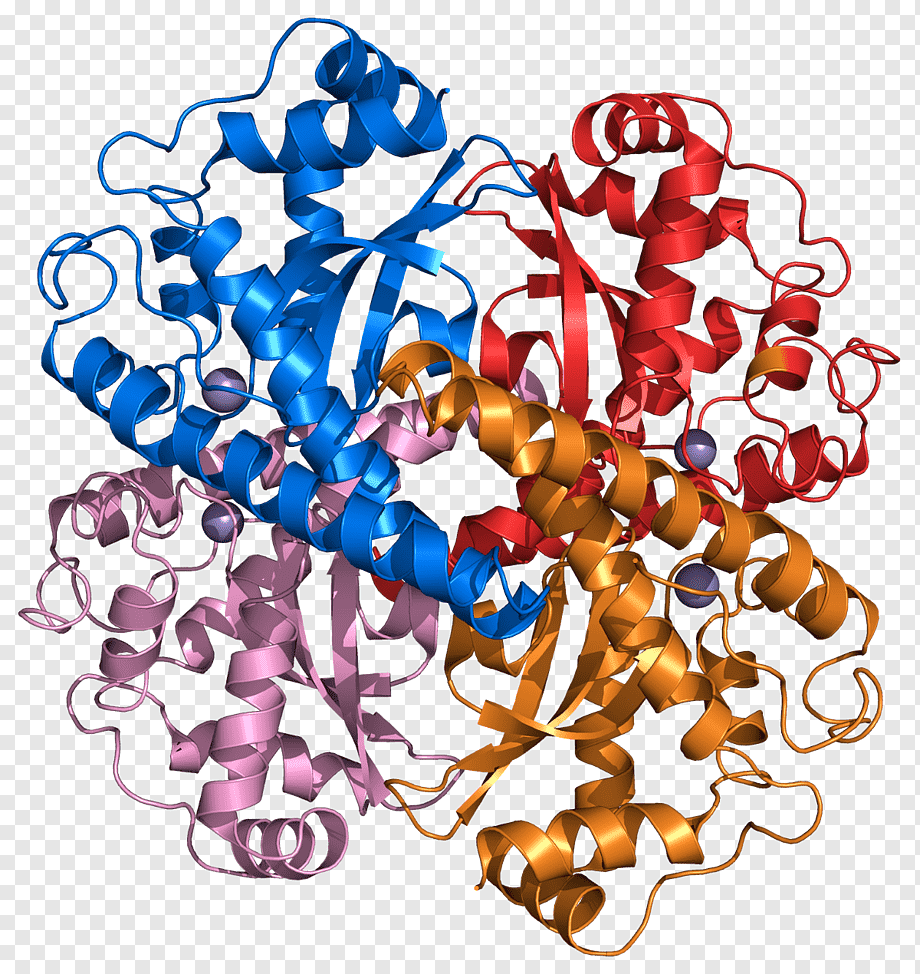 Рисунок 2.1- Структура супероксиддисмутазы1. Шифр -1.15.1.1 1. Супероксиддисмутаза один из основных ферментов антиоксидантной системы. Представляет собой группу металлоферментов, катализирующих реакцию дисмутации супероксидных анион-радикалов, поддерживая их концентрацию в клетке на низком уровне, и уменьшают вероятность образования еще более активного синглетного кислорода. В зависимости от иона металла в активном центре фермента различают несколько изоферментов СОД, среди которых наибольшей активностью обладает Cu, Zn- СОД. Экстрацеллюлярную изоформу считают основным регулятором метаболизма монооксида азота11. Каждая субъединица содержит 151 аминокислотный остаток:  Рисунок 2.2- Аминокислотная последовательность в супероксиддисмутазе13. Все СОД, независимо от источника их выделения — мультимерные металлопротеины, чрезвычайно эффективные в устранении супероксидных анионов (O2-). В механизме их действия предусмотрено попеременное чередование процессов окисления — восстановления соответствующих металлов, находящихся в активном центре ферментов. Выделяют 3 типа супероксиддисмутаз: Zn/Cu-SOD — димер, в основном обнаруживается в цитозоле и хлоропластах эукариот, во внеклеточной жидкости у млекопитающих — тетрамер12. Это восьмицепочечный «греческий ключ»«бета-цилиндр, с активным центром, удерживаемым между цилиндром и двумя поверхностными петлями. Две субъединицы тесно связаны друг с другом, в основном за счет гидрофобных и некоторых электростатических взаимодействий. Лиганды меди и цинка - шесть гистидиновых и одна боковые цепи аспартата ; один гистидин связан между двумя металлами14. Mn-SOD — димер, в митохондриях и у некоторых термофильных бактерий — тетрамер12. Лиганды ионов марганца являются 3 гистидиновыми боковыми цепями, в аспартатах боковой цепи и молекула воды или гидрокси-лиганд , в зависимости от степени окисления Mn14. Fe-SOD — димер, в основном обнаруживается у прокариот, в частности, у пропионовокислых бактерий (ПКБ), но встречается и у водорослей12. Трехмерные структуры гомологичных супероксиддисмутаз Mn и Fe имеют одинаковое расположение альфа-спиралей, а их активные центры содержат одинаковый тип и расположение боковых цепей аминокислот14. Никель - прокариотический . Он имеет гексамерную (6-копийную) структуру, построенную из правых 4-спиральных пучков, каждый из которых содержит N-концевые крючки, которые хелатируют ион Ni. Ni-крючок содержит мотив His-Cys-XX-Pro-Cys-Gly-X-Tyr; он обеспечивает большинство взаимодействий, критических для связывания металлов и катализа, и, следовательно, является вероятным диагностическим средством NiSOD14. Т.е. в человеческом организме СОД синтезируется в эукариотических клетках из гистидина и металлов - цинка, меди и марганца. Из пищевых источников получить СОД очень сложно (при замораживании, переработке, нагревании или высушивании изоферменты могут полностью или частично дезактивироваться, т.е. происходит самоокисление продуктов). СОД (SOD) можно разделить на 2 группы по структуре: Cu/Zn-SOD первая группа, и Mn-SOD и Fe-SOD вторая группа. Естественно возникающие SOD имеют различные ионы активного центра, но каталитически активные места имеют высокую степень структурной идентичности и эволюционной консервации, т.е. ионы активного центра представляют собой тетрагональную пирамиду или тетраэдр, состоящий из 3 или 4 молекул гистидина (His), имидазолила и 1 H2O12. Три формы супероксиддисмутазы присутствуют у человека, всех других млекопитающих и большинства хордовых. SOD1 находится в цитоплазме, SOD2- в митохондриях, а SOD3 - внеклеточный. Первый -димер (состоит из двух звеньев), а остальные - тетрамеры (четыре субъединицы). SOD1 и SOD3 содержат медь и цинк, тогда как SOD2, митохондриальный фермент, имеет марганец в своем реактивном центре14. 2.2 Роль фермента в метаболизме в норме и при различных патологиях Считается, что цинк играет структурную и стабилизирующую роль, в то время как ион меди непосредственно вовлечен в катализ. Каталитическая функция Cu,Zn-СОД – реакция диспропорционирования супероксидного анион-радикала с образованием перекиси водорода и молекулярнрго кислорода. Процесс двухступенчатый, термодинамически обусловлен и связан с циклическим восстановлением и окислением меди в активном центре. ECu2+ + O2. - + H+à HECu+ + O2 HECu+ + O2.- + H+à EСu2+ + H2O213. СОД является эндогенным акцептором свободных кислородных радикалов, избыточное накопление которых в клетке имеет значение в развитии целого ряда кислород зависимых патологических процессов (гипоксия, воспаление, интоксикация и др.) СОД удаляет супероксидные радикалы и предотвращает образование других, более опасных для организма свободных радикалов: гидроксильного радикала и синглетного кислорода. Кроме того, СОД предотвращает накопление в очаге воспаления нейтрофилов, которые секретируют значительные количества лизосомальных ферментов, разрушающих близлежащие ткани. Очевидно, что лекарственные препараты на основе СОД являются наиболее перспективными среди противовоспалительных препаратов13. СОД превосходит повреждающие реакции супероксида, защищая клетку от токсичности супероксида. Реакция супероксида с нерадикалами запрещена по спину. В биологических системах это означает, что его основные реакции происходят с самим собой (дисмутация) или с другим биологическим радикалом, таким как оксид азота (NO), или с металлом переходного ряда. Супероксид-анион-радикал (O2) самопроизвольно распадается на O2 и перекись водорода (H2О2) довольно быстро. SOD необходим, потому что супероксид реагирует с чувствительными и критическими клеточными мишенями. Например, он реагирует с радикалом NO и производит токсичный пероксинитрит14. Физиологическое значение SOD иллюстрируется серьезными патологиями, очевидными у мышей, генетически модифицированных без этих ферментов. Мыши, лишенные SOD2, умирают через несколько дней после рождения на фоне сильного окислительного стресса. У мышей, лишенных SOD1, развивается широкий спектр патологий, включая гепатоцеллюлярную карциному, ускорение возрастной потери мышечной массы, более раннюю заболеваемость катарактой и сокращение продолжительности жизни. Мыши, лишенные SOD3, не обнаруживают каких-либо явных дефектов и демонстрируют нормальную продолжительность жизни, хотя они более чувствительны к гипероксическим повреждениям. Мыши, лишенные какого-либо фермента SOD, более чувствительны к летальному исходу от соединений, вырабатывающих супероксид, таких как паракват и дикват (гербициды)14. Мутации в первом ферменте SOD (SOD1) могут вызывать семейный боковой амиотрофический склероз (БАС, форма болезни двигательных нейронов). Самая распространенная мутация в США - это A4V , а наиболее интенсивно изучаемая - G93A . Две другие изоформы SOD не были связаны со многими заболеваниями человека, однако у мышей инактивация SOD2 вызывает перинатальную летальность , а инактивация SOD1 вызывает гепатоцеллюлярную карциному. Мутации в SOD1 может вызывать семейный БАС (несколько свидетельств также показывают, что SOD1 дикого типа в условиях клеточного стресса вовлечен в значительную часть спорадических случаев БАС, которые составляют 90% пациентов с БАС), по механизму. что в настоящее время не изучено, но не из-за потери ферментативной активности или снижения конформационной стабильности белка SOD1. Избыточная экспрессия SOD1 связана с нервными расстройствами, наблюдаемыми при синдроме Дауна. У пациентов с талассемией СОД будет увеличиваться как форма компенсационного механизма. Однако на хронической стадии СОД кажется недостаточным и имеет тенденцию к снижению из-за разрушения белков в результате массивной реакции окислитель-антиоксидант14. У мышей внеклеточная супероксиддисмутаза (SOD3, ecSOD) способствует развитию гипертонии. Снижение активности SOD3 было связано с заболеваниями легких, такими как острый респираторный дистресс-синдром (ОРДС) или хроническая обструктивная болезнь легких (ХОБЛ) 14. Супероксиддисмутаза также не экспрессируется в клетках нервного гребня у развивающегося плода. Следовательно, высокий уровень свободных радикалов может вызвать их повреждение и вызвать дисрафические аномалии (дефекты нервной трубки) 14. Признаки дефицита СОД в организме: ускоренное старение; морщины; пигментные пятна; ослабление иммунитета; респираторные инфекции; аутоиммунные заболевания12. 2.3 Регуляция активности супероксиддисмутазы Основное условие активности СОД это pH среды, которая напрямую зависит от наличия активных форм кислорода в организме. Фермент стабилен в области pH 4,0-8,0, однако при pH <4 и> 9 его активность быстро снижалась; фермент выдерживал нагревание до 70 °С, ингибировался цианидом и Н2С>2, но слабо ингибировался азидом. Особенностью является то, что разные изоформы по-разному реагируют на одинаковые соединения, тем самым меняя или нет свою активность в определенных условиях. Так, например, медь-цинковая форма (СОД1) чувствительна к цианиду. Также влияет на активность концентрация ионов, которые являются металлами активного центра изоформ супероксиддисмутазы15. Основная активность каталазы, как и супероксиддисмутазы обнаруживалась в цитоплазме клеток. Большей активности СОД (и каталазы) соответствует большая супероксидпродуцирующая способность, что свидетельствует о важной роли этих ферментов в избавлении клеток от супероксидных радикалов12. Активность фермента зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей17. ГЛАВА 3 АНАЛИТИЧЕСКИЙ ОБЗОР ФЕРМЕНТА КАТАЛАЗЫ 3.1 Структура фермента каталазы 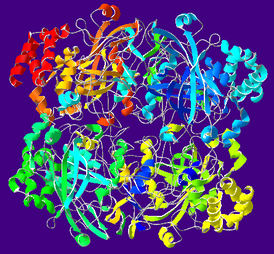 Рисунок 3.1- Структура каталазы Шифр- 1.11.1.6 1 В каталаза представляет собой фермент оксидоредуктазы (H2O2: H2O2 оксидоредуктаза), широко распространенный в природе. Он катализирует в различных тканях и типах клеток реакцию «разложения» перекиси водорода на молекулярный кислород и воду. Каталаза - один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду16. В клетках эукариот каталаза локализована в пероксисомах. Если рассматривать тканевую локализацию каталазы, то следует отметить, что в печени сосредоточено около 60% общей активности каталазы. Высокий уровень фермента также отмечается в почках, лейкоцитах, эритроцитах. Энзиматическая активность каталазы в нервных тканях (в том числе и в мозге) составляет лишь несколько процентов от ее уровня в печени18. Этот фермент, имеющий решающее значение для поддержания клеточной целостности и главный регулятор метаболизма перекиси водорода, был фундаментальным фактором, позволяющим подтвердить, что в природе существуют ферменты, которые действуют на определенные субстраты. Млекопитающие и другие организмы обладают ферментами каталазы, которые также могут вести себя как пероксидазы, катализируя окислительно-восстановительные реакции различных субстратов с использованием перекиси водорода. Его структура состоит из более 500 аминокислот, которые образуют четыре домена, состоящих из вторичных структур, образованных альфа-спиралями и бета-складчатыми листами, и исследования, показали, что эти белки связаны с четырьмя молекулами НАДФН. Эти молекулы НАДФН, по-видимому, не являются необходимыми для ферментативной активности каталазы (для производства воды и кислорода из перекиси водорода), но они, похоже, связаны со снижением восприимчивости этого фермента к высоким концентрациям его токсичный субстрат16. Домены каждой субъединицы каталазы человека: -Глобулярное удлиненное N-концевое плечо, которое функционирует для стабилизации четвертичной структуры -Бета-ствол из восьми антипараллельных β-складчатых листов, которые вносят часть боковых связывающих остатков в гем-группу -Домен-конверт, который окружает внешний домен, включая группу гема и, наконец, -Домен со структурой альфа-спирали Четыре субъединицы с этими четырьмя доменами отвечают за образование длинного канала, размер которого имеет решающее значение для механизма распознавания перекиси водорода ферментом (который использует такие аминокислоты, как гистидин, аспарагин, глутамин и аспарагиновая кислота) 16. Каталаза выполняет две ферментативные функции: -Разложение перекиси водорода на воду и молекулярный кислород (как специфическая пероксидаза). -Окисление доноров протонов, таких как метанол, этанол, многие фенолы и муравьиная кислота, с использованием одного моля пероксида водорода (как неспецифическая пероксидаза). -В эритроцитах большое количество каталазы, по-видимому, играет важную роль в защите гемоглобина от окислителей, таких как перекись водорода, аскорбиновая кислота, метилгидразин и другие. Фермент, присутствующий в этих клетках, отвечает за защиту других тканей с низкой активностью каталазы от высоких концентраций перекиси водорода16. Известно 2 изоформы каталазы: мембранная и цитоплазматическая, но ее активность определяется в плазме крови19. 3.2 Роль фермента в метаболизме в норме и при различных патологиях Биологическая роль состоит в разрушении перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.) 20. Чтобы предотвратить разрушение клеток и тканей, перекись водорода должна быть быстро превращена в другое, менее опасное для организма вещество. Именно с этой задачей и справляется фермент каталаза - он разлагает молекулу перекиси до двух молекул воды и молекулы кислорода. 2 H2O2 → 2 H2O + O2 Реакция проходит в два этапа - на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода. Каталаза катализирует расщепление перекиси водорода H2O2 до молекул воды и кислорода и может разложить 44 000 молекул H2O2 в секунду17. Если вследствие генетических причин возникает дефицит каталазы развивается акаталазия. Это наследственная болезнь, клиническими проявлениями которой являются изъязвления слизистой носа и полости рта, а в некоторых случаях явно выраженные выпадение зубов и атрофические изменения альвеолярных перегородок12. Каталаза участвует в воспалительных процессах, в экспрессии адгезивных молекул, в апоптозе, в регуляции агрегации тромбоцитов и контроле пролиферации клеток16. Сильное повышение концентрации каталазы в организме человека может служить маркером серьезных заболеваний таких как: острый панкреатит, так как при этом заболевании в плазме крови отмечается активация процесса пероксидации липидов, связанное с увелечинием числа продуктов ПОЛ21. Активность каталазы в эритроцитах остается неизмененной при ряде заболеваний, только при злокачественной анемии и других макроцитарных анемиях увеличивается так называемый каталазный индекс (каталазная активность определенного объема крови, деленная на количество эритроцитов в этом объеме в млн.). При злокачественных новообразованиях отмечается уменьшение активности каталазы в печени и в почках, причем существует зависимость между величиной и скоростью роста опухоли и степенью уменьшения активности в печени. Из некоторых опухолей выделены фракции, которые при введении экспериментальным животным вызывали у них снижение активности каталазы в печени. Эти фракции были названы токсогормонами20. При недостатке этого фермента образуются высокие концентрации его субстрата, что вызывает повреждение клеточной мембраны, дефекты транспорта электронов в митохондриях, метаболизма гомоцистеина и ДНК. К заболеваниям, связанным с мутациями в кодирующем гене каталазы человека, относятся: -Сахарный диабет -Артериальная гипертензия -Альцгеймер -Витилиго и другие16. Регуляция активности каталазы Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей. Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда - каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители17. Оптимальное значение pH для К. лежит в интервале 6,0—8,0. Активность каталазы ингибируется цианидом, фторидом, азидом, сульфидом, ацетатом, 3-амино-1,2,3-триазолом и его аналогами. К. быстро инактивируется в р-ре при pH больше 10,0 и меньше 4,0 и в присутствии высоких концентраций мочевины или других вызывающих разрыв водородных связей агентов. Инактивация фермента связана с образованием каталитически неактивных субъединиц20. Активность ферментов, таких как каталаза, может значительно варьироваться в зависимости от рассматриваемого типа ткани. Например, у млекопитающих активность каталазы значительна как в почках, так и в печени и намного ниже в соединительных тканях 16. Основными источниками производства субстрата каталазы, перекиси водорода, являются реакции, катализируемые ферментами оксидазы, активными формами кислорода и некоторыми опухолевыми клетками. Таким образом, каталаза у млекопитающих в первую очередь связана со всеми тканями, демонстрирующими значительный аэробный метаболизм. Млекопитающие обладают каталазами как в митохондриях, так и в пероксисомах, и в обоих отделах они являются ферментами, связанными с мембранами органелл. В эритроцитах, напротив, активность каталазы связана с растворимым ферментом (помните, что у эритроцитов мало внутренних органелл) 16. ГЛАВА 4 АНАЛИТИЧЕСКИЙ ОБЗОР НЕФЕРМЕНТАТИВНОЙ АНТИОКСИДАНТНОЙ СИСТЕМЫ КРОВИ Структурная организация витаминов, действующих как антиоксиданты и механизм их действия 4.1.1 Витамин Е К неферментативной антиоксидантной системе крови относятся соединения, имеющие в своей структуре ароматическое кольцо, связанное с одной или несколькими гидроксильными группами. Такие как витамины C, E, D, K, F, а также убихиноны, триптофан, фенилаланин, флаваноиды, каротины, каротиноиды и др. В отличие от специализированных ферментов низкомолекулярные вещества, способные снижать интенсивность свободнорадикальных процессов, осуществляют другие метаболические функции. Большинству низкомолекулярных антиоксидантов характерна прямая зависимость между их концентрацией и степенью ингибирования свободнорадикальных процессов. Прогрессивное увеличение тканевой концентрации веществ с выраженными антиоксидантными свойствами в конкретных условиях может способствовать активации побочных реакций с синтезом токсичных метаболитов, прооксидантов и даже АФК23. 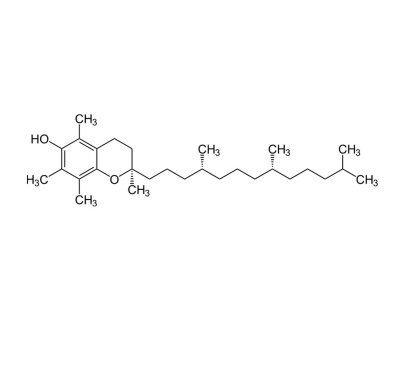 Рисунок 4.1- Структура витамина Е Витамин Е представлен несколькими гомологами (α, β , γ- токоферолами) из которых наибольшей антиоксидантной активностью обладает α-токоферол. Эффективность действия α-токоферола, как природного антиоксиданта, обусловлена его исключительно высокой антирадикальной активностью и стабилизацией липидного бислоя мембран путем образования прочных комплексов с полиеновыми жирными ацилами липидов. α-Токоферол взаимодействует с перекисными радикалами в качестве донора водорода22. Токофеноксильный радикал (α-ТФ-О∙) взаимодействует с аскорбиновой кислотой (НО-АК-ОН), в результате чего радикал альфа-токоферола восстанавливается, но возникает свободный радикал полувосстановленной формы аскорбиновой кислоты – семидегидроаскорбат (НО-АК-О∙), при взаимодействии которого с новой молекулой токофеноксильного радикала образуется дегидроаскорбиновая кислота (О=АК=О): α-ТФ-О∙ + НО-АК-ОН → α-ТФ-ОН + НО-АК-О∙ α-ТФ-О∙ +НО-АК-О∙→ α-ТФ-ОН + О=АК=О22. Восстановление аскорбиновой кислоты и ее полувосстановленной формы - семидегидроаскорбиновой кислоты осуществляется в различных компартаментах клетки (микросомы, митохондрии, цитозоль) с участием NADPH+ и G-SH-зависимых редуктаз. Окисленный глутатион (GS – SG) быстро регенерируется под влиянием глутатионредуктазы, источником которого является пентозофосфатный цикл. Время полураспада α-токоферола, определенное с помощью изотопной метки варьирует от 5 дней в печени и эритроцитах до 30 дней в клетках головного мозга22. Витамин С  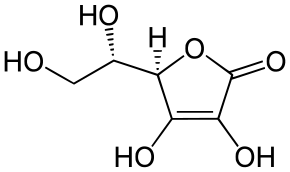 Рисунок 4.1- Структура витамина С Витамин С (L-аскорбиновая кислота) по химическому строению является лактоном гулоновой кислоты со структурой, близкой α-глюкозе. Благодаря наличию двух асимметричных атомов углерода, аскорбиновая кислота образует четыре стереоизомера, биологической активностью обладает только L-аскорбат. При окислении АК в тканях человека и животных образуется дегидроаскорбиновая кислота (ДАК), превращающийся затем в дикетогулоновую кислоту (ДКГК). При распаде последнего образуются щавелевая и трионовая кислоты, а при декарбоксилировании – ксилулоза, превращающаяся, как обычно, в глюкозу. Вследствие легкой окисляемости АК восстанавливает многие соединения, чем объясняется ее участие в окислительно-восстановительных процессах в клетке . У растений окисление АК с образованием ДАК катализирует специфический медьсодержащий фермент аскорбатоксидаза. Антиоксидантные свойства АК основаны на функционировании одноэлектронных циклических переходов между дигидро-, семигидро- и дегидроаскорбатными формами, чему способствуют весьма подвижные протоны. 23. Некоторые белки ингибируют окисление АК путем ее связывания или образования ее комплекса с медью. Окисление АК также тормозится в присутствии тиоловых соединений. Значительная часть витамина С (30-40%) в тканях животных, у растений связана с белками, нуклеиновыми кислотами и другими соединениями 23. Структурная организация каротиноидов, действующих как антиоксиданты и механизм их действия К гидрофобным антиоксидантам также относятся витамины группы А: А1 (ретинол), А2 и цис-форма витамина А1, отличающиеся дополнительными двойными связями в кольце ионона. Все соединения представляют собой циклический непредельный одноатомный спирт, состоящий из 6-членного кольца (ионон), двух остатков изопрена и первичной спиртовой группы: 22. 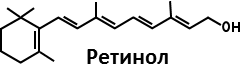 Рисунок 4.2.1- Структура ретинола Всасывание происходит в кишечнике в присутствие липидов. В организме легко окисляются с образованием цис- (сетчатка глаза) и транс-альдегидов (остальные ткани); откладываются про запас в печени в форме более устойчивых сложных эфиров: ретинилпальмитат, ретинилацетат и ретинилфосфат. Известны также предшественники (провитамины) витамина А - каротины. Различают α и β-каротины. Наибольшей биологической активностью обладает β-каротин, поскольку он содержит два -иононовых кольца и при расщеплении в кишечнике, и возможно в печени, при участие -каротин-диоксигеназы, в присутствие молекулярного О2, из него образуются две молекулы витамина А: 22. 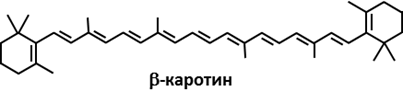 Рисунок 4.2.2- Структура β-каротина Повышенное содержание β-каротина в пищевом рационе и плазме крови оказывает профилактическое действие в отношении целого ряда заболеваний. Существует предположение, что благодаря наличию двойных связей в молекуле, витамин А может участвовать в окислительно-восстановительных реакциях, поскольку он способен образовывать перекиси, которые в свою очередь увеличивают активность антиоксидантных ферментов в клетке. Также предполагается участие витамина А в делении и дифференцировке клеток, обусловленного его действием на инициацию репликации; на рост костной ткани - участие в синтезе хондроитинсульфата. Неотъемлемым является участие витамина А в фотохимическом акте зрения22. Структурная организация убихинона, действующая как антиоксидант и механизм его действия КоэнзимQ10(Q10)–жирорастворимоевитамино подобное вещество. Q10 встречается в организме человека буквально повсюду, с чем связано его второе официальное название – убихинон. Внутри клеток Q10 в основном содержится в митохондриях. В сердечной мышце этого вещества вдвое больше, чем в любом другом органе или ткани. Сегодня известны две основные функции Q10 в живых организмах. Q10 участвует в выработке энергии в любой из клеток. Коэнзим Q10 в митохондриях участвует в синтезе АТФ как переносчик электронов, сопрягающий процессы электронного транспорта и окислительного фосфорилирования. Он является необходимым звеном для передачи электронов с комплексов I и II на комплекс III дыхательной цепи. При недостатке Q10 (затруднении в передаче электронов по дыхательной цепи) комплексы I и III становятся основными генераторами супероксид-радикалов22. Q10 – единственный жирорастворимый антиоксидант, способный синтезироваться в организме человека и животных, а также постоянно регенерировать из окисленной формы с помощью ферментных систем. Непосредственное (прямое) антиоксидантное действие Q10 заключается в улавливании свободных радикалов. Q10 способен предупреждать развитие цепных реакций свободнорадикального окисления, в том числе перекисного окисления фосфолипидов клеточных мембран и липопротеинов плазмы23. Еще одно уникальное свойство коэнзима Q10 – постоянная регенерация его окисленной формы с помощью ферментных систем организма и антиоксидантов неферментной природы (аскорбата, альфа-токоферола), что возвращает ему антиоксидантную активность. Опосредованное (непрямое) антиоксидантное действие Q10 состоит в предупреждении образования феноксил-радикалов альфа-токоферола, то есть в недопущении возможного прооксидантного действия альфа-токоферола24. ЗАКЛЮЧЕНИЕ В данном обзоре литературы мы смогли наглядно проследить структуру, механизм действия и активность ферментов антиоксидантной системы плазмы крови, а именно каталазы глутатион-пероксидазы и супероксиддисмутазы, а также рассмотрели роль неферментативных элементов антиоксидантной системы, которые также оказывают большое значение в устранении активных форм кислорода в организме животных. Помимо этого узнать про их изоформы, локализацию, условия их активности, специфические факторы, влияющие на возбудимостьферментов. А также научились выполнять реферат согласно нормам оформления и изучили различные научные статьи, главы из исследовательских журналов и личные эксперименты других людей. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ KEGG - Table of Contents [Электронный ресурс]. – Режим доступа: https://www.genome.jp/kegg/kegg2.html. – Дата доступа: 20.03.2022. Узбеков, М.Г. Перекисное окисление липидов и антиоксидантные системы при психических заболеваниях / М.Г. Узбеков: Московский научно-исследовательский институт психиатрии – филиал «ФМИЦПН им. В.П.Сербского» Минздрава. Россия, 2016.с. 91-94 Структура, свойства, биологическая роль и регуляция глутатионпероксидазы / Кулинский В.И., Колесниченко Л.С. // Успехи современной биологии. – 1993. – Т. 113, № 1. – С. 107–122. Генетическая регуляция активности антиоксидантных ферментов. генетически обусловленный дефицит ферментов антиокислительной защиты / Э. А. Ефимцева, Т. И. Челпанова // Успехи современной биологии 2009. № 5. с. 440–453. Глутатионпероксидазы электронный ресурс // Академик. Режим доступа: https://dic.academic.ru/dic.nsf/ruwiki/1293186#.D0.A1.D1.82.D1.80.D1.83.D0.BA.D1.82.D1.83.D1.80.D0.B0/. Дата доступа: 02.04.2022. Выяснение механизма восстановления перекиси водорода, катализируемого селенопротеином глутатионпероксидазой (GPx) двумя молекулами глутатиона / Р. Прабхакар, Т. Вревен // Biochemistry 2005 . № 44. с. 11864–11871. Methods in Enzymology: Oxygen Radicals in Biological Systems [Электронный ресурс] / Mode of access: https://www.sciencedirect.com/science/article/abs/pii... – Date of access: 06.04.2022. Glutathione Peroxidase 1 Is Regulated by the c-Abl and Arg Tyrosine Kinases / The American Society for Biochemistry and Molecular Biology // The journal of biological chemistry Vol. 2782003.№41. pp. 39609–39614. Шульгин К.К. Активность и каталитические свойства глутатионпероксидазы при токсическом поражении печених / К.К. Шульгин [и др.] // Воронежский государственный университет. — 2020. — Т. 20, № 1. — С. 100-108. Борисёнок О.А. Биологическая роль глатутионов / О.А. Борисёнок, М.И Бушма, О.Н. Басалай, А.Ю. Радковец [и др.] // Медицинские новости. – 2019. – № 7. – С. 3-7. Волыхина, В.Е. Супероксиддисмутазы: структура и свойства / В.Е. Волыхина, Е.В. Шафрановская // Вестник Витебского Государственного Медицинского университета. – 2009. – Т. 8, № 4. – С. 1-18. Maan Hayyan, Superoxide Ion: Generation and Chemical Implications / Maan Hayyan, Mohd Ali Hashim // ASC Publication. – 2016. – № 59. – pp. 3029-3085 Способ выделения супероксиддисмутазы: Патент РФ, МПК: C12N 9/02 / Соловьева Л.Я., Чурилова И.В., Княжев В.А., Калошин В.Г., заявитель Всесоюзный научно-исследовательский технологический институт антибиотиков медицинского назначения - № 2186848, заявл. 10.08.2002; опубл. 10.04.1996 // Всесоюзный научно-исследовательский технологический институт антибиотиков медицинского назначения.2014.с. 98 Richardson, J: Crystal structure of bovine Cu,Zn superoxide dismutase at 3 A resolution: chain tracing and metal ligands. / J Richardson, K.A. Thomas // National Library of Medicine. – 1975. – Т. 72, № 4. – pp. 1349–1353 Меныцикова Е. Б. Супероксиддисмутаза. Изоформы, структура, распространение / Е.Б. Меныцикова, В.З. Ланкин, Н.К. Зенков [и др.] // Фирма «Слово». — 2006. — c. 556. László, Góth Catalase enzyme mutations and their association with diseases / Góth László, Péter Rass // National Library of Medicine. – 2004. – Т. 8, № 3. – pp. 141-149 FB.ru [Электронный ресурс]. – Режим доступа: fb.ru/s/article/325833/ferment-katalaza-osnovnyie-osobennosti. – Дата доступа: 10.04.2022. Мирошниченко О.С. Биогенез, физиологическая роль и свойства каталазы / О.С. Мирошниченко // Научно-теоретический журнал. — 1992. — Т. 8, № 6. — C. 3. Дзугкоев С.Г. Участие биохимических систем в патогенезе эндотелиальной дисфункциии / С.Г. Дзугкоев, Ф.С. Дзугкоева, О.И. Маргиева [и др.] // Институт биомедицинских исследований, Владикавказ; Северо-Кавказский многопрофильный медицинский центр, Беслан. — С. 1-12. Большая Медицинская Энциклопедия: в 35 томах / под редакцией Петровского Б.В – Москва: Советская энциклопедия, 1974-1989. т. 3: Большая Медицинская Энциклопедия (БМЭ) / А.М.Прохоров и др..-1988.- 579-595 с. Филипенко, Н.С. Изменение активности глутатионпероксидазы и каталазы в крови у больных острым панкреатитом: / Н.С. Филипенко, Г.С. Ивченко // Медицинский вестник Северного Кавказа. сб. науч. статей /Ставропольская государственная медицинская академия; науч. ред. Г.В.Потапов.Кавказ , 2006. – № 4. – С. 71-74 Основы биохимии в 3 томах /под редакцией Леман И. Моска : Мир, 1981.т.2: Основы биохимии/ Уайт А., Хендлер Ф., Смит Э., Хилл Р.-1981.-617 с. Баглай, О.М. Система антиоксидантной защиты и перекисное окисление липидов организма животных / О.М. Баглай, С.Т. Мурська // Научный вестник ЛНУВМБТ. – 2011. – Т. 13, № 4. – С. 1-9 |
