Курсовая 4 курс ОБРАЗЕЦ. Белорусский государственный университет биологический факультет
 Скачать 93.77 Kb. Скачать 93.77 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ Кафедра биохимии СОСТОЯНИЕ АНТИОКСИДАНТНОЙ СИСТЕМЫ ПРИ ТОКСИЧЕСКОМ ПОРАЖЕНИИ ПЕЧЕНИ. ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ОБЛАДАЮЩИЕ ГЕПАТОПРОТЕКТОРНЫМИ СВОЙСТВАМИ Курсовая работа Коледа Алёна Ивановна студентка 3 курса 52 группы специальность «биохимия» Научный руководитель: старший преподаватель кафедры С.М. Петрова Минск, 2018 Оглавление Перечень условных обозначений АО антиоксиданты АОС антиоксидантная система АФК активные формы кислорода ГК глицирризиновая кислота ГП (GSH-PX) глутатионпероксидаза ЛП лекарственные препараты ЛПП лекарственные поражения печени ПОЛ перекисное окисление липидов СОД супероксиддисмутаза СРО свободнорадикальное окисление ЕФл эссенциальные фосфолипиды Введение Печень – уникальная химическая лаборатория, каждую минуту в ней разрушаются миллионы токсических веществ. Еще одна особенность печени отсутствие болевых рецепторов, вследствие чего она практически не подает сигналов о болезни, в буквальном смысле «страдая молча». Когда появляются симптомы, ситуация с печенью близка к критической. Существует группа заболеваний печени с объединяющим названием гепатит, характеризующиеся наличием воспалительного процесса в печени. В зависимости от причины возникновения гепатиты классифицируют на: инфекционные вирусные и бактериальные, токсические (лекарственный, алкогольный и др.), аутоиммунные гепатиты. Основная причина токсического поражения печени алкоголь. По данным литературы, злоупотреблением принято считать прием алкоголя в пересчете на этанол более 140 г в неделю для мужчин и более 70 г в неделю для женщин. В последнее время на одно из ведущих мест среди заболеваний печени выходят лекарственные поражения. По данным американских исследований, побочные эффекты лекарственных препаратов становятся причиной 40% гепатитов среди пациентов старше 40 лет и 25% случаев острой печеночной недостаточности [15]. Основную роль в патогенезе нарушений функций печени играет увеличение уровня перекисного окисления липидов (ПОЛ). В условиях нормы в крови и тканях определяется низкий уровень ПОЛ. Повышение уровня ПОЛ, а также содержания высокоактивных форм молекулы кислорода приводит к оксидативному стрессу, при котором нарушаются клеточные мембраны и патологически изменяются функции клеток, в том числе и гепатоцитов. Уровень ПОЛ и содержание продуктов свободнорадикального окисления зависят от работы специализированной защитной системы, получившей название антиоксидантной. Во многих исследованиях установлено, что компанентами такой системы в организме являются ферменты супероксиддисмутаза, глутатионпероксидаза, каталаза и др. Возможность лечения поражений печени антиоксидантными средствами в настоящее время широко исследуется. Патологические изменения печени отражаются на всех органах и системах органов, провоцируя возникновение заболеваний. В связи с этим важную роль играет поиск лекарственных веществ с гепатопротекторными свойствами. Перспективным источником биологически активных соединений с антиоксидантными свойствами считаются лекарственные растения. Ряд их преимуществ будет рассмотрен в дальнейшем в этой работе [16]. Глава 1 Лекарственное и токсическое поражение печени. Поражение печени может сопровождаться, как нарушением одной, так и всех её функций, что лежит в основе степени тяжести заболевания. Какие же причины могут вызвать подобные негативные эффекты? Лекарственные поражения печени. Развиваются из-за приема гепатотоксичных препаратов. Это довольно распространенная причина заболеваний печени, так как около 10% всех побочных действий медикаментозных препаратов связаны с влиянием именно на нее. Чаще всего от лекарственных поражений печени страдают дети в возрасте до трех лет и взрослые старше 40. Токсические поражения печени. Провоцируются воздействием на организм различными бытовыми и производственными химикатами, радиационным излучением, природными ядами, содержащимися в ядовитых грибах или растениях. Курение, хотя и не является прямой причиной токсического поражения печени, усугубляет негативные воздействия [1,2]. Алкогольные поражения печени. Наиболее распространены в силу своей «социальной» природы. По данным ВОЗ 2014 года смертность от алкоголя в Беларуси составила 26,5%, причинами которой могут являться заболевания циррозом печен (16,6%) [18]. Вирусные поражения печени. К ним относятся многие виды гепатитов A, B, C, D и E. Данные типы вирусов попадают в организм с продуктами питания, водой, через кровь или другие биологические жидкости. Более 170 миллионов людей в мире страдают гепатитом C, 350 миллионов гепатитом B. Иммунные поражения. От общего числа воспалительных заболеваний печени они составляют примерно 10% и считаются довольно редкими. Причина аутоиммунных заболеваний печени кроется в сбое работы антител или киллерных клеток, которые начинают уничтожать здоровые ткани организма. Дистрофические поражения. Жировая дистрофия печени возникает из-за нарушения обмена веществ и избыточного веса (в 65% процентах случаев). Здоровые клетки при этом перерождаются в жировую ткань, теряя свои свойства и функциональность. Раковые поражения. Одно из наиболее страшных и серьезных заболеваний печени. Рак характеризуется наличием злокачественных новообразований или метастазов в этой железе. Их появление может быть последствием вирусного гепатита или цирроза. Практически все поражения печени отличаются последовательным прохождением следующих стадий. Первичная воспаление железы вследствие различных причин, может протекать как на фоне имеющегося стеатоза печени, так и без него. Второй стадией является фиброз. И третья стадия цирроз необратимый процесс замены живых клеток печени на грубую соединительную ткань, который может трансформироваться в рак печени [1,2]. Рассмотрим подробнее токсическое и лекарственное поражения печени. Токсическое поражение печени Токсические поражения печени вызываются химическими веществами, применяемыми в промышленности, сельском хозяйств и быту, а также природными гепатотропными ядами (фаллоидин, фаллоин и -аманитин в бледной поганке). К веществам с гепатотоксической потенцией, используемым на производстве, относят металлы и многие органические соединения, прежде всего растворители. Экзогенные химические токсины вызывают широкий спектр повреждений печени от белковой и жировой дистрофии, токсического гепатита до цирроза и карциномы [5]. Этиология. Используется следующая классификация гепатотоксичных веществ с учетом их химического строения: I. Хлорированные углеводороды (хлористый метил, хлороформ, четыреххлористый углерод, этилхлорид, дихлорэтан, тетрахлорэтан, этилхлоргидрат, дихлордифенилтрихлорэтан) широко применяются в машино-, авиа- и автостроении, обувном производстве, для чистки одежды, при дегельминтизации, дезинсекции и дезинфекции. II. Хлорированные нафталины и дифенилы представляют собой твердую воскообразную массу желтоватого или бурого цвета. Применяются под названиями «галовакс», «савол» для покрытия электрических проводов, наполнения конденсаторов; используются как заменители смолы, воска, каучука. III. Бензол, его гомологи и производные (нитробензол, динитробензол, толуол, тринитротолуол, динитрофенол, анилин) в связи с развитием промышленной химии все шире применяются для изготовления ароматических соединений, органических красок, взрывчатых веществ. IV. Металлы и металлоиды (свинец, ртуть, золото, марганец, мышьяк, фосфор) постепенно заменяются в промышленном производстве другими, менее вредными соединениями [5]. Патогенез. Различные химические вещества, попадающие в организм человека, подвергаются биотрансформации в печени путем либо деструкции (окисление, восстановление, гидролиз), либо связывания (конъюгация). Некоторые вещества или их метаболиты, образующиеся в процессе биотрансформации, могут быть гепатотоксичными и вызывать поражения печени. Понятие о гепатотоксичности включает истинную токсичность химического агента, которая зависит от дозы и воспроизводится в эксперименте, и идиосинкразию, которая является индивидуальной реакцией и может быть обусловлена различными механизмами, в том числе иммуноаллергическим. Характер метаболитов у лиц, чувствительных и не чувствительных к токсину, различный. При воздействии большинства гепатотоксичных веществ непосредственно повреждается паренхима печени и нарушаются обменные ферментативные процессы в ее ткани. В зависимости от химической природы и дозы яда механизм его действия может быть различным [5]. Некроз гепатоцитов при отравлении четыреххлористым углеродом является следствием нарушения ферментных систем эндоплазматического ретикулума. В других случаях дистрофические изменения гепатоцитов при воздействии четыреххлористого углерода, аллилового спирта связаны с усилением переокисления ненасыщенных жирных кислот мембранных липидов. При воздействии тяжелых металлов патогенез повреждения связан с блокадой сульфгидрильных групп ферментов. Следует подчеркнуть, что предшествующие повреждения печени алкоголем, вирусной инфекцией повышают чувствительность к гепатотропным ядам. Токсический эффект усиливается при бактериальной инфекции, дефиците белков в пище. Вместе с тем известно, что к токсическому гепатиту ведут повреждения ароматическими аминами, фенолом, толуолом; жировой гепатоз развивается под действием этанола, метанола, инсектицидов (ДДТ), мышьяка, хрома, четыреххлористого углерода; фиброз-цирроз печени метанола, винилхлорида, мышьяка; канцерогенный эффект дают диметилнитрозамин, винилхлорид, мышьяк [5]. Прогноз. В большинстве случаев токсических повреждений после прекращения контакта с гепатотропными ядами наступает выздоровление. Наиболее частые осложнения дискинезия желчного пузыря и желчных путей. После тяжелых отравлений с массивными некрозами паренхимы может развиться макронодулярный цирроз печени. При хронических интоксикациях формируется жировой гепатоз. Цирроз и рак печени наблюдаются относительно редко. В этих случаях необходимо исключить конкурентные экзогенные воздействия (алкоголь, лекарства, вирусный гепатит, заболевания желчных путей) или эндогенные факторы (гемохроматоз, болезнь Вильсона-Коновалова) [5]. Лечение токсических поражений печени состоит прежде всего в прекращении поступления яда в организм, быстром обезвреживании и удалении токсичного вещества (антидотная терапия). При остром отравлении тяжелыми металлами ртутью, мышьяком, свинцом внутримышечно или под кожу вводят унитиол или внутривенно тиосульфат натрия. При остром отравлении солями железа применяют десферал внутрь и внутримышечно для удаления всосавшегося железа. При острых отравлениях медью назначают витамины В1, В6, аскорбиновую, никотиновую, фолиевую кислоты [5]. Лекарственные поражения печени Печень наиболее часто подвергается нежелательному воздействию многих экзогенных факторов, в т. ч. лекарств. В настоящее время известно более 1 тыс. лекарственных препаратов (ЛП), обладающих гепатотоксичным действием. Лекарственные поражения печени (ЛПП) являются причиной 2-5% всех госпитализаций по поводу желтухи, 40% гепатитов у лиц старше 40 лет и 25-50% всех случаев печеночной недостаточности. Частота фатальных исходов у больных ЛПП и желтухой составляет 9-12%. Необходимо помнить, что почти все без исключения ЛП, метаболизирующиеся в печени, вызывают определенные изменения, которые могут не сопровождаться измнениями функции и развитием заболеваний печени (адаптационные изменения печени) [3]. Патогенез лекарственных поражений печени, несмотря на многочисленные исследования, нельзя считать достаточно изученным. К основным механизмам повреждения печеночной ткани относятся: прямое токсическое действие лекарственного препарата на гепатоциты с их последующим некрозом; токсическое действие метаболитов лекарственных средств; нарушение обмена билирубина; сосудистые нарушения: дилатация синусов и веноокклюзия; иммунологические реакции по типу гиперчувствительности немедленного типа или гиперчувствительности замедленного типа. ! Факторы риска лекарственной гепатотоксичности: возраст (старше 55 лет), женский пол, беременность, злоупотребление алкоголем, ожирение/нутритивная недостаточность, наследственность (генетические дефекты печеночных ферментных систем), предшествующая лекарственная терапия, сопутствующие заболевания печени. Лекарственное поражение печени необходимо диагностировать как можно в более ранние сроки, поскольку продолжающийся прием лекарственных препаратов, предположительно вызвавших поражение печени, способен многократно усилить тяжесть и выраженность морфологических изменений, клинических проявлений и в итоге существенно повлиять на исход заболевания в целом [4]. Гепатотоксичность лекарств. Лекарства, поражающие печень, подразделяют на 2 группы: I группа истинные гепатотоксины, вызывающие облигатные реакции, II группа гепатотоксины, зависящие от идиосинкразии с факультативными реакциями. Лекарственные реакции, вызываемые препаратами I группы, определяются дозой и временем приема лекарства, воспроизводятся в эксперименте и развиваются у значительного числа лиц. Лекарственные реакции при приеме препаратов II группы не зависят от дозы препарата, развиваются лишь у немногих лиц, особенно чувствительных к данному препарату. Частота гепатотоксических повреждений при использовании этих лекарств составляет 0,1%, но проявления минимальных печеночных нарушений достигают 10%. Механизм гепатотоксических повреждений. I группа включает лекарства, которые выступают как гепатотоксины опосредованного действия, преимущественно метаболиты и родственные соединения, которые вызывают поражение гепатоцитов путем интерференции с каким-либо процессом обмена веществ. Среди гепатотоксинов опосредованного действия выделяют цитотоксические и холестатические. К цитотоксическим лекарствам относится тетрациклин; к холестатическим анаболические стероиды, алкилированные в позиции С-17, литохолевая кислота. Эти вещества вызывают поражение печени посредством избирательного нарушения секреции в желчные канальцы. Во II группе выделяют 2 подгруппы. Первая подгруппа включает те вещества, которые вызывают поражение печени за счет аллергических реакций по типу гиперчувствительности. Характерно развитие гранулематозного воспаления и других аллергических реакций с лихорадкой, сыпью, эозинофилией. Препараты второй подгруппы вызывают медикаментозное поражение печени за счет токсичных метаболитов, образующихся в процессе биотрансформации лекарственных средств в печени. В развитии поражения печени в этих случаях может играть роль снижение глутатионовых фрагментов гепатоцитов, конъюгирующих токсические метаболиты. Гепатотоксины идиосинкразии, например хлорпромазин, также могут давать повреждающий эффект за счет образования потенциально токсических метаболитов, в то время как другие метаболиты нетоксичны или малотоксичны. Вполне вероятно, что индивидуальная переносимость лекарства определяется скоростью превращения токсических метаболитов. Предполагают также, что реактивные метаболиты выступают в роли гаптенов, связывающихся с макромолекулами клеток и образующих антигены. Тем самым индуцируются иммунопатологические реакции, ведущие к поражению клеток печени. В ряде случаев нарушения метаболизма лекарств генетически детерминированы. Ферменты, метаболизирующие лекарства, в самом большом количестве содержатся в печени. Биотрансформация происходит в первую очередь за счет ферментов микросомальной оксидазной системы, связанной с гладким эндоплазматическим ретикулумом гепатоцитов. Метаболизм лекарств осуществляется в две стадии. Первая стадия создание полярных групп за счет окислительных реакций. Образующиеся вследствие окислительных реакций метаболиты биологически более активны, чем сами лекарства. При этом образуются гепатотоксические дериваты, которые играют роль в патогенезе лекарственных поражений печени. Существенная роль в окислительных процессах принадлежит цитохрому Р450, количество которого увеличивается при приеме лекарств и уменьшается при заболеваниях печени. Некоторые окислительные ферменты связаны с митохондриями, в частности моноаминоксидаза, и цитозолем алкогольная дегидрогеназа. Превращение лекарств обеспечивают цитохромы, относящиеся к трем семействам Р450. Каждый цитохром способен метаболизировать несколько лекарств. Генетические различия в каталитической активности фермента могут быть причиной развития идиосинкразии к вводимому препарату. Вторая стадия печеночной биотрансформации включает связывание (конъюгацию) метаболитов первой фазы с различными субстратами глюкуронидами, сульфатом и глутатионом. Образовавшиеся полярные соединения выделяются с мочой и желчью. Факторы, регулирующие активность ферментов, метаболизирующих лекарства. Из внешних факторов важно помнить о хроническом злоупотреблении алкоголем, который вызывает индукцию ферментов гладкого эндоплазматического ретикулума. Степень ферментной активности в значительной мере зависит от генетических факторов. Цитохром Р450 существует в разных формах и генетические факторы регулируют профиль его у каждого больного. Эстрадиол, тестостерон, андростерон, прогестерон, гидрокортизон ингибируют лекарственную метаболическую активность, являясь потенциальными субстратами ферментной системы цитохрома Р450. Ферментная активность зависит также от предшествующей лекарственной терапии, взаимодействия одновременно применяемых лекарств [5]. Лечение. Основные задачи лечения печеночной гепатопатии – своевременная отмена препарата, вызвавшего нежелательные явления (промывание желудка, клизмы, форсированный диурез, эфферентные методы), введение антидотов (силибинин, N-ацетилцистеин, дефероксамин), применение антиоксидантов (β-каротин, витамины Е и С, полифенол, препараты цинка, селен и др.). В связи с кумулятивным действием многих гепатотоксичных препаратов, а также медленным регрессом патологических морфологических изменений в печени, особенно актуальным становится использование гепатопротекторов растительного происхождения (см. Глава 4) [3]. Однако перед назначением сильнодействующих факультативно гепатотоксических препаратов необходимо проверить функциональное состояние печени [5]. Глава 2 Антиоксидантная система печени Согласно современным представлениям, многие жизненно важные метаболические и физиологические процессы, протекающие в организме, тесно связаны со свободнорадикальным окислением (СРО). Оно влияет на физикохимические свойства биологических мембран, их проницаемость, структуру, что отражается на обмене веществ, функциональном состоянии клеток и организма в целом. Свободные радикалы участвуют в поддержании гомеостаза, аккумуляции и биотрансформации энергии, обеспечивают защитные функции, в частности, детоксикаци чужеродных соединений (как поступающих извне, так и образующихся в организме), обладают микробиоцидными свойствами, влияют на иммунитет и т. д. В то же время при избытке свободных радикалов и перекисных продуктов ингибируется созревание и пролиферация клеток, происходят структурные и функциональные повреждения биологических мембран. В нормально функционирующих клетках содержание продуктов свободнорадикального окисления находится на крайне низком уровне, несмотря на обилие субстратов ПОЛ. Этот факт свидетельствует о наличии антиоксидантной защитной системы [6]. Первоначально понятие антиоксиданты (АО) ассоциировалось с химическими соединениями, непосредственно взаимодействующими с токсическими радикалами и нейтрализующими их. В настоящее время к АО относят более широкий класс соединений, тем или иным способом снижающих интенсивность свободнорадикальных реакций окисления. Антиоксиданты контролируют уровень СРО и препятствуют накоплению токсичных продуктов окисления, участвуют в различных видах обмена веществ, способны изменять активность других регулирующих систем, участвуют в построении структурных элементов клетки. Систему защиты тканей и клеток от токсических метаболитов кислорода и продуктов ПОЛ можно условно разделить на физиологическую – механизмы, осуществляющие регуляцию доставки и поступления кислорода к клеткам, и биохимическую – собственно антиоксидантные системы (АОС) организма, включающая широкий класс химических соединений, снижающих активность радикальных окислительных процессов. Физиологический компонент системы антиоксидантной защиты организма обеспечивает равновесие между интенсивностью транспорта кислорода к клеткам и метаболическими процессами по его выгодной и безопасной утилизации. Биохимическую АОС организма условно можно разделить на специфическую и неспецифическую. Специфическая АОС направлена на разрушение АФК и продуктов их дальнейших превращений. Действие неспецифической АОС связано с предотвращением условий и возможностей утечки электронов и генерации АФК в ходе окислительно-восстановительных реакций (в рамках окислительного фосфорилирования) или в процессе аутоокисления субстратов (микросомального окисления). Для понимания механизмов действия АО их можно разделить по выполнению антирадикальной функции. Исходя из этого, возможно выделение первичных АО, например супероксиддисмутазы (СОД) и глутатионпероксидазы (ГП), препятствующих образованию новых радикалов кислорода, а также вторичных АО, захватывающих уже образовавшиеся радикалы, предотвращая накопление их избытка. К этой группе относят большой перечень веществ, иногда называемых «тушителями» – scavenger (англ.) [7]. 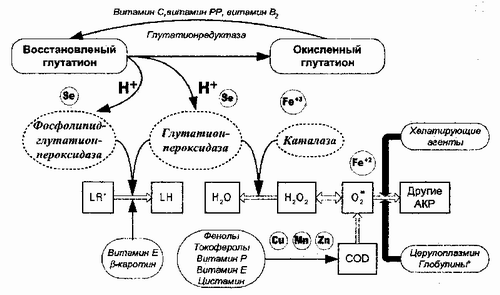 Рисунок 1 Антиоксидантная система печени Известно, что собственно антиоксидантная система может быть разделена на 3 группы (Рис. 1): –ферменты, обладающие антиоксидантным действием (СОД, каталаза, система глутатионпероксидаза-глутатионредуктаза); –антиоксиданты неферментативного действия (жирорастворимые – токоферол, полифенолы, убихинол, тканевые липиды, витамины К, А, водорастворимые – витамин С, мочевина, глутатион, цистеин, никотинамид, бензойная кислота); –синергисты, которые потенциируют действие других антиоксидантов (аскорбиновая, глутаминовая и лимонная кислоты) [6]. 2.1 Ферментативная антиоксидантная система Эта группа ферментов обладает способностью разрушать свободные радикалы, а также участвовать в разложении гидроперекисей нерадикальным путем. Энзимы антирадикальной защиты характеризуются высокой избирательностью действия, направленного против определенных радикалов; специфичностью клеточной и органной локализации; а также использованием в качестве стабилизаторов металлов, к которым относятся медь, цинк, марганец, железо и ряд других. Содержание АО-ферментов в различных тканях организма существенно различается. В нормальных условиях содержание ферментных АО относительно постоянно и мало зависит от пола, отмечается некоторое снижение их уровня с возрастом как результат старения органов и тканей. В условиях гипоксии и гипероксии, то есть состояний, усиливающих образование АФК, повышается уровень ферментных АО внутри клеток. К отрицательным эффекторам (ингибиторам) АО относятся: в основном тяжёлые металлы (Cu, Zn, ванадия (V)), цианиды, сульфиды, нитраты, фосфаты, сульфаты и многие кислоты (сенильная, уксусная, H2S) [12]. Ферментные АО практически всегда выполняют свою функцию внутри клеток, так как большая молекулярная масса молекул энзимов препятствует их выходу из клетки, это же является препятствием для проникновения внутрь клетки введенных в организм в виде лекарственных препаратов экзогенных ферментов (например, СОД). Их синтез и внутриклеточное содержание, как и большинства белков, находится под генетическим контролем и изменяется под влиянием ряда внешних воздействий, в том числе фармакологических [7]. Супероксиддисмутаза (СОД, КФ 1.15.1.1) представлена семейством металлоферментов, катализирующих реакцию дисмутации супероксидных радикалов: 2Н+ О2- + О2-. = Н2О2 + О2 Основная активность сосредоточена внутри клетки и поделена между митохондриями (Mn-СОД, тетрамер) и компартментами цитозоля (Cu/Zn-СОД, димер) и является как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода [9]. В гепатоцитах крысы около 70% СОД обнаружено в компартментах цитозоля. Активность СОД в разных тканях варьирует. Наиболее активен фермент в печени, надпочечниках, почках и селезенке Он характеризуется необычайной структурной стабильностью и является одним из наиболее термостабильных глобулярных белков [8]. Каталаза (КФ 1.11.1.6) фермент класса оксиредуктаз. Хромопротеид, состоит из четырех идентичных субъединиц с молекулярной массой 62000. Она является основным первичным антиоксидантом системы защиты, который катализирует разложение перекиси водорода до воды (В отличие от глутатионпероксидазы каталазы работают при высоких концентрациях Н2О2) [9]: 2Н2О2 → H2O+ O2 Каталаза широко распространена в различных тканях. Уровень активности различается не только в разных тканях, но и внутри самой клетки. Печень, почки и эритроциты содержат высокий уровень каталазы. В гепатоцитах ожидаемо высокий уровень активности наблюдается в пероксисомах, хотя фермент активен также в микросомах и в цитозоле. Каталаза-это тетрамерный гем-содержащий белок, который образуется в цитозоле в виде мономеров, не содержащих гем. Мономеры переносятся в просвет пероксисом и там собираются в тетрамеры в присутствии гема. Хотя каталаза не содержит сигнальной последовательности, отрезаемой после использования, она должна иметь какой-то сигнал, направляющий ее в пероксисому. Согласно последним данным, эту роль, по крайней мере частично, играет специфическая последовательность из трех аминокислот, расположенная вблизи карбоксильного конца многих пероксисомных белков [8]. Глутатионпероксидаза (ГП либо GSH-PX) геминовый фермент, как и каталаза восстанавливает перекись водорода до воды, но при этом обязательно идет окисление другого вещества восстановителя. В организме человека это глутатион (трипептид: g-глутамил-цистеил-глицин). SH-группа цистеина, входящего в состав глутатиона, может отдавать всего 1 атом водорода, а для пероксидазной реакции необходимы 2 атома. Поэтому молекулы глутатиона работают парами. Реакция: 2Н2О2 + 2G-SH → H2O + G-S-S-G, где G-SH глутатион, а -S-S- дисульфидный мостик. С участием глутатионредуктазы и НАДФН2 идёт регенерация (восстановление) глутатиона: G-S-S-G + НАДФН2 → 2G-SH + НАДФ [10]. 2.2 Неферментативная антиоксидантная система Основным механизмом действия антиоксидантов неферментативной природы является обрыв свободнорадикальной реакции; они выступают в роли «ловушек» свободных радикалов. Такой механизм действия характерен, в первую очередь, для группы токоферолов, наиболее активным из которых является α-токоферол (витамина Е). Важной характеристикой токоферолов является их жирорастворимость, которая позволяет им встраиваться в липидный слой мембраны и оказывать преимущественно мембранопротектирующее действие [6]. Витамин Е отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), прерывает ПОЛ, а сам превращается в свободный радикал. Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму токоферолхинон. Витамин С ингибирует СРО с помощью двух различных механизмов: 1) восстанавливает в мембранах клеток токоферолхинон до витамина Е; 2) взаимодействует с активными формами кислорода О2., Н2О2, НО. и инактивирует их [9]. Он может выступать в качестве донора и акцептора ионов водорода благодаря наличию в структуре двух фенольных групп [11]. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Соединения, связывающие железо. Для детоксикации двухвалентного железа в организме существует целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина [9]. Коэнзим Q10, или убихинон (вездесущий хинон) является важнейшим антиоксидантом митохондрий и содержится практически во всех тканях организма. Как известно, коэнзим Q10 является переносчиком электронов в дыхательной цепи, в то же время эффективно защищает липиды биологических мембран и липопротеиды крови от перекисного окисления, предохраняет ДНК и белки от окислительной модификации. К низкомолекулярным антиоксидантам относятся мочевина и мочевая кислота. Антиоксидантный эффект мочевины связан со стабилизацией мембран и модификацией ферментов, и тем самым сокращением числа железосодержащих центров перекисного окисления липидов. Окислительно-восстановительные реакции мочевой кислоты тесно связаны с аскорбиновой кислотой. Она, как и аскорбат, способна вступать в обменные реакции с АФК, ингибировать ПОЛ, оказывать выраженный протективный эффект по отношению к Fe- и рН – индуцированному окислению аскорбата всыворотке крови [11]. Глава 3 Лекарственые средства растительного происхождения, обладающие гепатопротекторными свойствами Для фармакотерапии нарушений функции печени часто используют гепатопротекторные средства. Гепатопротекторы лекарствейные средства, улучшающие метаболические процессы в печени, повышающие ее устойчивость к патогенным воздействиям, а также способствующие восстановлению ее функций при различных повреждениях. Гепатопротекторы различаются механизмом действия: некоторые из них, обладая антиоксидантной активностью, тормозят ПОЛ; другие связывают токсины и переводят их в менее токсичные или неактивные формы; третьи являются антигипоксантами; четвертые стимулируют синтез нуклеотидов. Но все они в той или иной мере, устраняют повреждения гепатоцитов, восстанавливая их детоксицирующую и синтетическую функции. Гепатопротекторы на сегодняшний день составляют 9,2% от общего количества лекарственных средств [14]. 3.1 Биофлавоноидные гепатопротекторы растительного происхождения 1.Расторопша пятнистая В 1969 году из плодов расторопши пятнистой (Silybum marianum L.) была выделена группа флавоноидных соединений, оказывающих гепатотропное действие. Эта группа соединений была обозначена как силимарин (Silimarin). Он представляет собой смесь четырёх основных изомерных соединений силимарин, силибинин, силидианин и силикристин, имеющих фенилхроманоновую структуру. На сегодняшний день лекарственные средства биофлавоноидной природы являются препаратами-лидерами в терапии заболеваний печени. Силимарин является действующим веществом препаратов под коммерческими названиями: гепадебтал, гепарсил, карсил, легалон, лепротек, силимарин, и входит в состав комбинированных препаратов гепабене, сибектан и др. Гепатопротекторное действие силимарина обусловлено его антиоксидантными, мембраностабилизирующими и стимулирующими репаративный потенциал печеночных клеток свойствами: 1. Защита биологических мембран от токсинов в результате ингибирования их захвата гепатоцитами, стабилизации клеточных мембран и включения в них фосфолипидов (репарация мембран); 2. Повышение обезвреживающей функции гепатоцитов; связанное с увеличением пула глутатиона в гепатоците и возрастанием активности ферментов, участвующих в окислении ксенобиотиков (в частности супероксиддисмутазы); 3. Антиоксидантное действие, обусловленное связыванием свободных радикалов, торможением реакций избыточного перекисного окисления липидов в результате ингибирования фермента липооксигеназы; 4. Повышение белково-синтетической функции печени; 5. Ингибирование синтеза холестерина в результате уменьшения активности микросомальной гидроксил-СоА-редуктазы; 6. Противовоспалительное и иммуномоделирующее действие, обусловленное уменьшением активности макрофагальных клеток, участвующих в презентации антигенов [14]. В фармакодинамике силибинина ведущими являются мембраностабилизирующие и метаболические свойства. Мембраностабилизирующее действие реализуется несколькими, путями: биохимическим взаимодействием силибинина с мембранами гепатоцитов, его способностью ингибировать активность цАМФ и, как следствие, понижать содержание кальция внутри клеток, угнетать кальций-зависимый процесс активации фосфолипаз. Метаболическое действие связано со стимуляцией биосинтеза белка и ускорением регенерации поврежденных гепатоцитов. Силибинин специфически стимулирует РНК-полимеразу I в клеточном ядре, что активирует транскрипцию и скорость синтеза р-РНК в клетках печени. Последнее в свою очередь, приводит к увеличению количества рибосом и активации биосинтеза структурных и функциональных белков. Стимуляция белоксинтетической функции гепатоцитов имеет большое значение для процессов регенерации в печени. В многочисленных исследованиях, посвященных изучению действия силимарина, показана его высокая эффективность при лечении больных с хроническими гепатитами и циррозами, токсическими поражениями печени, в том числе вызванными алкоголем, лекарственными препаратами, ядохимикатами, солями тяжелых металлов и др. Силимарин обладает желчегонными свойствами благодаря наличию у него одновременно холеретического и холекинетического действия. Холерез развивается благодаря повышению секреции желчных кислот и электролитов гепатоцитами. Холекинетический эффект связан со снижением тонуса сфинктеров желчевыводящих путей [14]. 2. Экстракт Дымянки аптечной Основным действующим веществом Дымянки аптечной (Дымянка лекарственная, Fumaria officinalis) является производное фумаровой кислоты алкалоид протопин. Он увеличивает желчевыделение, активирует продукцию холецистокинина и секретина, что повышает секрецию воды и бикарбонатов эпителием желчных протоков, приводит к сокращению желчного пузыря, ослаблению сфинктера Одди и беспрепятственному поступлению желчи в кишечник. Протопин эффективно восстанавливает дренажную функцию желчевыводящих путей, предупреждая развитие застоя желчи и образование конкрементов в желчном пузыре. Кроме того, через механизм обратной связи он уменьшает всасывание холестерина в кишечнике, его синтез в печени и секрецию в желчь, что уменьшает литогенность последней. Экстракт Дымянки наряду с флавонойдами расторопши пятнистой входит в состав комбинированного препарата гепабене, который возможно использовать при различных заболеваниях гепатобилиарной системы от функциональных заболеваний желчных путей (как у взрослых, так и у детей) до жирового гепатоза и хронического гепатита. Применение гепабене при жировом гепатозе позволяет увеличить скорость экскреции триглицеридов их липолиз и последующее окисление жирных кислот, включение триглицеридов в пре--липопротеиды и их секрецию в кровяное русло. При назначении желчегонных препаратов пациентам с хроническими гепатитами необходимо учитывать отрицательное действие желчных кислот на гепатоциты. В связи с наличием в составе гепабене гепатопротектора силимарина, способного нивелировать отрицательное действие желчных кислот, препарат не противопоказан при хронических поражениях печени [14]. 3. Оригинальные комплексы растительного происхождения В их состав входят соки свеклы обыкновенной и моркови посевной, отвар плодов шиповника, листьев мяты перечной, наземной части хвоща полевого, обладающие гепатопротекторной активностью При остром токсическом гепатите, вызванном тетрахлорметаном они оказывают мембранопротекторное и антиоксидантное действие, что подтверждается уменьшением активности аланиновой аминотрансферазы, содержания в сыворотке крови общего билирубина, конечных и промежуточных продуктов липопероксидации. Использование фитопрепаратов позволяет восстановить нарушенный гомеостаз, структуру и целостность мембран гепатоцитов, ингибировать ПОЛ как одно из звеньев патогенеза гепатитов, стимулировать антиоксидантную защиту, желчеобразование и желчевыделение, активировать репаративные процессы печеночной ткани, улучшить процессы пищеварения и абсорбции питательных веществ [14]. 4. Экстракты чистотела большого, одуванчика лекарственного и чертополоха курчавого. Они составляют основу гомеопатического гепатопротекта препарата Галстена. Галстена состоит из пяти натуральных компонентов (фосфор, расторопша пятнистая или чертополох, чистотел большой, одуванчик лекарственный и сульфат натрия), обладающих гисто- и органотропностью к гепатобилиарной системе. Эти компоненты подобраны в таком составе и соотношении, что оказывают многостороннее регулирующее воздействие на печень и желчные пути, сочетая действие гепатопротектора, спазмолитика, противовоспалительного, желчегонного и холеретического средства [14]. Препарат стабилизирует коллоидное состояние желчи и препятствует образованию камней. Применение Галстены противопоказано при алкоголизме, а также в случаях гиперчувствительности к компонентам, входящим в состав средства [13]. 3.2 Фосфолипидные гепатопротекторы растительного происхождения К числу наиболее широко употребляемых гепатопотекторов относятся препараты, содержащие эссенциальные фосфолипиды (ЕФл), основным компонентом которых является полиненасыщенный фосфатидилхолин. Гепатопротективный эффект ЕФл реализуется путем встраивания их молекул непосредственно в структуру поврежденных гепатоцитов, устранения дефектов и восстановления барьерной функции мембран. Печень примерно на 80% состоит из мембран, и ее дезинтоксикационный потенциал определяется; прежде всего, их нормальным функционированием. С этой точки зрения крайне важно, что ЕФл влияют на мембраны всех структур печени. Кроме того, нормализация структуры и функции клеточных мембран под влиянием ЕФл способствует снижению доступа кислорода в гепатоциты и тем самым уменьшению ПОЛ и образования обладающих повреждающим действием свободных радикалов [14]. Экстракт корня солодки (Glycyrrhizaglabra), в котором основным компонентом явлется глицирризиновая кислота (глицирризин), активно используется в медицине в странах Азии, давно известен положительным воздействием на ткань печени и обладает широким спектром, биологической активности, не все механизмы которого выяснены достаточно. Глицирризиновая кислота (ГК) представляет собой тритерпеновый гликозид, состоящий из глицирретовой кислоты и двух остатков глюкуроновой кислоты. Противовирусное действие экстракта корня солодки выявлено на нескольких видах вирусов. Механизм широкого противовирусного действия ГК связан с инактивацией вируса на ранней стадии репликации за счет присоединения полисахаридного фрагмента ГК к внешней, обогащенной гликолипидами, стороне мембраны. Показано также воздействие ГК на клетки организма-хозяина блокирование рецепторов проникновения вируса, а также ингибирование протеинкиназы С, казеинкиназы Р и казеинкиназы С, препятствующее транскрипции и репликации вируса внутри клетки. Долговременное использование ГК предотвращает развитие гепатоклеточной карциномы у больных с хроническим гепатитом С. Высказывается точка зрения, что в основе лечебного действия ГК при гепатитах лежит продукция интерферона. Однако препараты ГК оказывались в ряде случаев более эффективными, чем сам интерферон, что свидетельствует о дополнительных, не совсем ясных пока механизмах ее гепатопротекторного действия. Считают также, что ГК повышает способность печени к выведению токсинов и обладает антиоксидантным действием [14]. Заключение В заключении хочется сделать несколько выводов: 1. Главной причиной токсических и лекарственных поражений печени является воздействие различных экзогенных факторов (гепатотоксичных веществ). К их числу относятся: природные гепатотропные яды (фаллоидин, фаллоин и др.); химические вещества, компоненты бытовой химии, чистящие средства, используемые в промышленности и быту; металлы; широкий ряд лекарственных препаратов, обладающих гепатотоксичным действием и т.д. [5]. Все эти вещетва приводят к морфологическим и функциональным изменениям печени, стеатозу, фиброзу и циррозу [1.2]. Повреждения, возникающие при патологических процессах в печени, могут приводить к серьезным нарушениям метаболизма, иммунного ответа, де-токсикационной и антимикробной функций. Многие болезни печени, заканчивающиеся выздоровлением, оставляют «след» метаболического нарушения, который сохраняется на многие годы, и нередко переходит в болезнь, требующую лекарственной коррекции. Для фармакотерапии подобных нарушений функции печени часто используют гепатопротекторные средства. 2. Гепатопротекторы лекарствейные средства, улучшающие метаболические процессы в печени, повышающие ее устойчивость к патогенным воздействиям, а также способствующие восстановлению ее функций при различных повреждениях. Гепатопротекторный эффект в той или иной степени могут проявлять различные фармакологические средства, улучшающие метаболические процессы в организме, ингибирующие перекисное окисление липидов (ПОЛ), обладающие антигипоксической активностью, защищающие митохондриальные и микросомальные ферменты от повреждения, замедляющие синтез коллагена и повышающие активность коллагеназы. Таким образом, группа гепатопротекторов гетерогенна и включает вещества различного химического строения с разнонаправленным воздействием на метаболические процессы. Несмотря на многолетний клинический опыт и большое количество проведенных научных исследований, границы их применения до сих пор не очерчены [14]. 3. Основными помощниками печени являются антиоксиданты, непосредственно взаимодействующие с токсическими радикалами и нейтрализующие их [7]. Однако содержание АО-ферментов в различных тканях организма существенно различается. В нормальных условиях содержание ферментных АО относительно постоянно и мало зависит от пола, отмечается некоторое снижение их уровня с возрастом как результат старения органов и тканей. В условиях гипоксии и гипероксии, то есть состояний, усиливающих образование АФК, повышается уровень ферментных АО внутри клеток. К положительным эффекторам относятся катионы металлов и некоторые анионы (Mg2+, Mn2+, Zn2+, K+, Сl-) [17], к отрицательным (ингибиторам) АО в основном тяжёлые металлы (Cu, Zn, ванадия (V)), цианиды, сульфиды, нитраты, фосфаты, сульфаты и многие кислоты (сенильная, уксусная, H2S), спирты, при высоких концентрациях субстрата может наблюдаться субстратное ингибирование, обусловленное образованием непродуктивного комплекса фермента с несколькими молекулами субстрата и др. [12]. Список использованной литературы 1. Что такое поражение печени? [Электронный ресурс]. 2015. Режим доступа: https://www.kp.ru/guide/porazhenie-pecheni.html. 2. Что такое поражение печени и как с этим бороться? [Электронный ресурс]. 2016. Режим доступа: https://www.pravda.ru/navigator/chto-takoe-porazhenie-pecheni.html. 3. Ильченко, Л.Ю. Лекарственная болезнь печени. Роль гепатопротекторов в ее терапии / Л.Ю. Ильченко, Т.И. Корович // Медицинский совет. 2013. № 10. С. 32-37. 4. Трухан, Д.И. Лекарственные поражения печени: Актуальные вопросы диагностики и лечения / Д.И. Трухан, А.Л. Мазуров // Медицинский совет. 2016. № 5. С. 70-73. 5. Подымова, С.Д. Болезни печени: Руководство / С.Д. Подымова. М.: Медицина, 2005. 768 с. 6. Габитова, Д.М. Антиоксидантная защитная система организма / Д.М. Габитова [и др.] // Башкирский химический журнал. 2006. Том 13, №2. С. 94-96. 7. Чанчаева, Е.А. Современное представление об антиоксидантной системе организма человека / Е.А. Чанчаева [и др.] // Экология человека. 2013. С. 50-58. 8. Антиоксидантная система: общие сведения [Электронный ресурс]. Режим доступа: http://medbiol.ru/medbiol/antioks/000061b9.htm#0000db59.htm. 9. Антиоксидантная система [Электронный ресурс]. Режим доступа: https://studfiles.net/preview/6688757/page:11/. Дата доступа: 19.06.2017. 10. Антиоксидантная система. Понятие о метаболизме [Электронный ресурс]. 2010. Режим доступа: https://cribs.me/biokhimiya/antioksidantnaya-sistema-ponyatie-o-metabolizme. 11. Попков, В.М. Активация липопероксидации как ведущий патогенетический фактор развития типовых патологических процессов и заболеваний различной этиологии / В.М. Попков, Н.П. Чеснокова, М.Ю. Ледванов. М.: Академия Естествознания, 2012. 12. Титова, Н.М. Энзимология / Н.М. Титова, Т.Н. Субботина. Красноярск: СФУ, 2012. 60 с. 13. Галстена [Электронный ресурс]. 2018. Режим доступа: http://instrukciya-po-primeneniyu.com/galstena/. 14. Новиков, В.Е. Фармакология гепатопротекторов / В.Е. Новиков, Е.И. Климкина // Обзоры по клинической фармакологии и лекарственной терапии. 2005. Том 4, №1. С. 2-20. 15. Заболевания печени: симптомы и лечение // Европейский Медицинский Центр (EMC) [Электронный ресурс]. 2018. Режим доступа: http://www.emcmos.ru/articles/zabolevaniya-pechenisimptomy-i-lechenie. 16. Царева, А.А. Антиоксидантная активность фитопрепаратов, содержащих фенилпропаноиды, при токсическом поражении печени / А.А. Царева // Диссертация. Самара, 2007. 177 с. 17. Пархоменко, Н.С. Лабораторная работа «Изучение каталитической активности каталазы в живых и вареных тканях» / Н.С. Пархоменко // Лабораторная работа «Изучение каталитической активности каталазы в живых и вареных тканях» [Электронный ресурс]. – 2017. Режим доступа: http://www.openclass.ru/node/528081. 18. Беларусь сильно пьющая страна [Электронный ресурс]. 2018. Режим доступа: https://4esnok.by/mneniya/belarus-pjushaya-strana// |
