Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
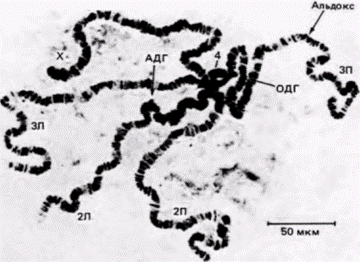
Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследованияНаследственность осуществляется путем передачи ядерной преформации, которая в ходе развития находит свое выражение в процессе цитоплазматического эпигенеза. Э. Б. ВИЛЬСОН (1925)' Две клетки дифференцированы по-разному, если, обладая одинаковым геномом, они синтезируют разные белки. Φ. ЖАКОБ и Ж. МОНО (1963) ВведениеГенетика развития изучает проблему реализации наследственных потенций оплодотворенного яйца в течение жизни организма. Когда мы наблюдаем развитие зародыша, становится очевидным, что в клетках разных типов экспрессируются разные гены. Гемоглобин, например, характерен для эритроцитов, тогда как кристаллин обнаруживается только в клетках хрусталика глаза. Клетки сетчатки способны передавать электрические импульсы на большие расстояния, а прилежащие к ним клетки пигментного эпителия черны от гранул меланина и лишены способности проводить электричество. А между тем клетки каждого из типов образуются в результате митотических делений одного и того же оплодотворенного яйца, и, следовательно, ядра клеток каждого типа должны содержать одинаковую информацию. Развитие, таким образом, осуществляется посредством избирательного включения специфических генов в соответствующем месте и в соответствующее время. Отсюда рождается и проблема, которой занимается генетика развития: какие именно механизмы обусловливают такое избирательное включение, в результате которого возникают различия между клетками? Центральная гипотеза генетики развития заключается в том, что дифференцировка клеток происходит без генетических изменений. Другими словами, предполагается, что в любом организме все соматические клетки содержат одинаковый набор генов. Следовательно, разные типы дифференцированных клеток должны использовать разные гены из этого общего для всех клеток наследственного материала. Данные, положенные в основу гипотезы дифференциальной экспрессии генов, получены как в генетических, так и эмбриологических исследованиях. В этой главе мы обсудим работы, посвященные вопросу о том, происходят ли в процессе развития необратимые изменения генома. Тождество геномовНекоторые крупные неделящиеся клетки личинок двукрылых (таких, как Drosophila и Chironomus) содержат политенные (многонитчатые) хромосомы. В этих хромосомах репликация ДНК происходит без последующего митоза, и поэтому они содержат 512, 1024 и даже больше двойных спиральных молекул ДНК вместо одной (рис. 9.1 и 9.2). Клетки с политенными хромосомами никогда не делятся. Эти хромосомы можно увидеть с помощью светового микроскопа и различить характерную для них исчерченность. У дрозофилы в гаплоидном наборе хромосом насчитывается примерно 5150 дисков. В некоторых тканях в политенных хромосомах видны широкие полосы, внутри которых после спе- 1 Цит. по кн.: Э. Вильсон. Клетка и ее роль в развитии и наследственности. т. 2. с. 974. Изд-во АН СССР. M.-Л., 1940. 1062 с. Перевод с англ. В. А. Дорфмана и М.С. Навашина. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.66________________ ГЛАВА 9______________________________________________________________________________
циальной обработки можно обнаружить два или более тонких дисков. В ряде генетических работ (Judd, Young, 1973) высказывалось предположение о наличии корреляции между числом этих дисков или хромомер, и числом генов у мухи (Swanson et al., 1981). Число политенных хромосом и характер исчерченности на протяжении всего личиночного периода остаются неизменными (Beermann, 1952; рис. 9.3). При сравнении политенных хромосом в разных тканях личинки не было
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ________________ 67
выявлено утраты какого-либо из их участков. Когда появилась возможность изучать индивидуальные хромосомы позвоночных, удалось установить, что число хромосом в разных тканях взрослого организма постоянно (Tjio, Puck, 1958). Как мы узнаем позже, в разных исследованиях было показано, что состав и свойства ДНК, экстрагированных из разных соматических тканей, очень сходны. Другие данные, свидетельствующие об эквивалентности генома, были получены в эмбриологических исследованиях. Дриш и Шпеман (гл. 8) четко показали, что ядра ранних бластомеров морских ежей и тритонов тотипотентны, т.е. способны обеспечить дифференцировку любых типов клеток. В их опытах бластомер. который в норме должен был бы дать начало лишь части зародыша, оказался способным дать в процессе развития целый организм. Следовательно, его ядро должно было содержать гены, необходимые для образования всех других типов клеток Кроме того, Шпеман обнаружил, что проспективное значение клеток, взятых у зародыша тритона на стадии ранней гаструлы, меняется после пересадки их в другую область зародыша. Можно ли экстраполировать результаты этих эмбриологических исследований на клетки, которые уже детерминированы к дифференцировке в определенном направлении? Сохраняют ли детерминированные или дифференцированные клетки другие потенции к развитию? Излагаемые ниже данные, полученные в двух направлениях исследований, приводят к положительному ответу на эти вопросы. ТрансдетерминацияЛичинка дрозофилы после вылупления имеет две четко различающиеся популяции клеток. Ее ткани образованы примерно 10 000 клеток. У большей части клеток имеются политенные хромосомы; эти клетки интенсивно растут, увеличиваясь в объеме примерно в 150 раз. Помимо этого, еще около 1000 клеток с диплоидными (неполитенными) ядрами образуют скопления в различных областях личинки. Такие скопления недифференцированных клеток называются имагинальными дисками (от латинского слова «имаго», означающего «взрослый»). Эти клетки делятся в течение всего периода роста личинки. Во время метаморфоза гормон экдистерон вызывает огромные изменения во всем организме (гл. 19). Личиночные клетки дегенерируют, тогда как имагинальные диски получают сигналы к дифференцировке в органы взрослой мухи. На рис. 9.4 показано расположение имагинальных дисков и перечислены структуры, которые из них развиваются. Клетки имагинальных дисков личинки детерминированы. Так, например, глазной диск можно удалить у одной личинки и имплантировать его в брюшко другой. После метаморфоза муха, развившаяся из этой второй личинки, будет иметь Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.68________________ ГЛАВА 9______________________________________________________________________________
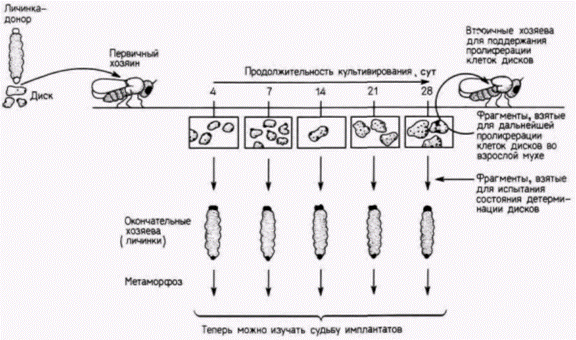
лишний глаз на брюшке. Если трансплантировать часть имагинального диска, то разовьется только часть глаза. Таким образом, трансплантация диска или его фрагмента личинке – прекрасный метод для тестирования состояния их детерминации, т.е. того, какая структура или ее фрагмент возникнет из этого диска при метаморфозе. Однако, когда диски трансплантируют взрослым мухам, они не дифференцируются, а их клетки продолжают пролиферировать. Эти пролиферирующие клетки можно непрерывно культивировать, пересаживая их от одной взрослой мухи к другой. Вместе с тем можно вновь тестировать состояние детерминации клеток диска путем удаления у мухи фрагментов растущих дисков и помещения их в личинку, претерпевающую метаморфоз (рис. 9.5).
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.___________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ______________ 69
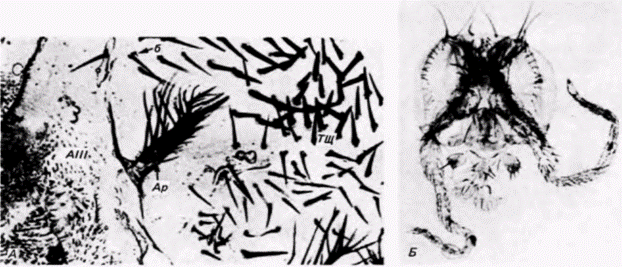
Эрнст Халорн с коллегами (Hadorn, 1968) использовали методику пересадки дисков, чтобы показать, что клетка может изменять свое коммитированное состояние. Обычно фрагменты диска, детерминированного к образованию антенн, продолжали образовывать антеннальные структуры каждый раз, когда их тестировали, даже после нескольких серийных трансплантаций таких фрагментов взрослым мухам. Однако результат одного опыта удивил исследователей: вместо монотонного образования антеннальных структур участки антеннального диска формировали части ног, ротового аппарата или крыла. Это явление названо трансдетерминацией. Вместо развития в «собственный» орган имагинальные клетки развивались в другую часть взрослой мухи. Например, из диска, в норме детерминированного к развитию антенны, могла возникнуть структура, свойственная ноге взрослой мухи (рис. 9.6). Кроме того, подобно исходному состоянию детерминации, трансдетерминированное состояние оказалось относительно стабильным и наследовалось клетками диска на протяжении многих поколений. Трансдетерминация чаще наблюдается после нескольких пассажей через взрослых мух и происходит преимущественно в определенных направлениях (рис. 9.7). Из диска крыла, например, могут возникнуть структуры груди, но грудные диски никогда не дифференцируются в части крыла. Генитальные диски могут дать начало антеннам или ногам, но никогда не наблюдается образования генитальных структур из дисков других типов. Причина такой направленности остается неизвестной, однако ясно, что детерминированные клетки могут дать начало иным типам клеток, чем те, которые образуются из них в норме. Следовательно, в клетках имагиналь-
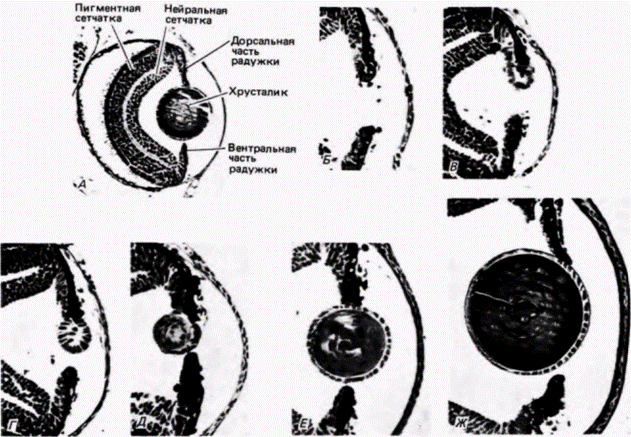
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.70________________ ГЛАВА 9______________________________________________________________________________ ных дисков сохраняются гены для специфических продуктов, которые в норме синтезируются клетками других типов. МетаплазияРезультаты экспериментов по регенерации глаз у тритонов показали, что даже дифференцированные клетки взрослого организма могут сохранять потенции к образованию клеток других типов. Удаление сетчатки у тритона стимулирует ее регенерацию из пигментного эпителия, а новый хрусталик может сформироваться из клеток дорсальной радужки. Этот последний тип регенерации (названный вольфовской регенерацией по имени ученого, первым обнаружившего это явление) интенсивно изучался Тунео Ямадой и его коллегами (Jamada, 1966; Dumont, Jamada, 1972). Они обнаружили, что после удаления хрусталика происходит ряд событий, в результате которых радужка образует новый хрусталик (рис. 9.8). 1. Меняется форма ядер клеток радужки. 2. В клетках дорсальной части радужки образуется огромное количество рибосом. 3. ДНК этих клеток реплицируется, и вскоре клетки начинают делиться. 4. Происходит дедифференцировка этих клеток. Они выбрасывают меланосомы (продукты дифференцировки. придающие глазу его характерный цвет), которые перевариваются макрофагами, проникающими в рану. 5. Клетки дорсальной части радужки продолжают делиться, формируя дедифференцированную ткань в области удаленного хрусталика. 6. В дедифференцированных клетках радужки начинается синтез специфических для клеток хрусталика продуктов белков кристаллинов.
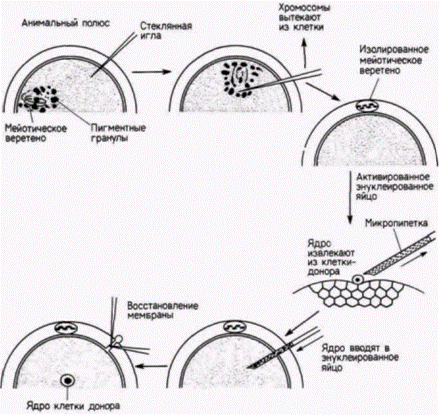
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ______________ 71 Эти белки синтезируются в такой же последовательности, как и при развитии нормального хрусталика. 7. Как только сформировался новый хрусталик, деления клеток дорсальной части радужки прекращаются. Перечисленные события нельзя считать нормальным путем образования хрусталика. Вспомним, что в эмбриогенезе хрусталик образуется из слоя эпителиальных клеток, индуцированных клетками передней стенки глазного пузыря. Процесс формирования хрусталика из дифференцированных клеток радужки называется метаплазией; явление это состоит в превращении (трансформации) одного типа дифференцированных клеток в другой. Следовательно, данные, полученные генетиками и биологами развития, подтверждают гипотезу дифференциальной экспрессии генов в генетически идентичных ядрах. Клонирование у амфибий: ограничение потенций клетокОкончательно решить вопрос о том, является ли сужение функций ядра дифференцированной клетки необратимым, было бы можно, проверив способность этого ядра индуцировать образование дифференцированных клеток любого другого типа. В 1938 г. Ганс Шпеман предложил, по его словам, «фантастический» опыт, чтобы ответить на вопрос о том, действительно ли геномы в разных клетках идентичны. Для этого следует имплантировать ядро какой-либо дифференцированной клетки в яйцо, собственное ядро которого предварительно было удалено. Если любое пересаженное ядро идентично ядру зиготы, то оно должно обеспечить полное развитие организма. Однако для проведения такого опыта необходимо было прежде всего разработать три методики: I ) методику энуклеации яиц-реципиентов без их разрушения. 2) методику изоляции неповрежденных ядер; 3) методику переноса таких ядер в яйцо без повреждения и ядра, и яйца. Указанные методики были разработаны Робертом Бриггсом и Томасом Кингом. Эти исследователи комбинировали энуклеацию яйца с его партеногенетической активацией. Если яйцеклетку леопардовой лягушки (Ranapipiens) уколоть стеклянной иглой, то в ней начнут происходить все цитологические и биохимические изменения, связанные с оплодотворением: разрушаются кортикальные гранулы, перемещается внутренняя цитоплазма, а вблизи анимального полюса завершается мейоз.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.72________________ ГЛАВА 9_____________________________________
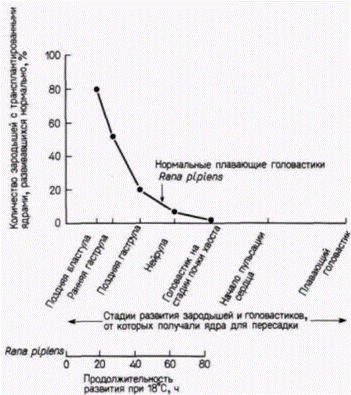
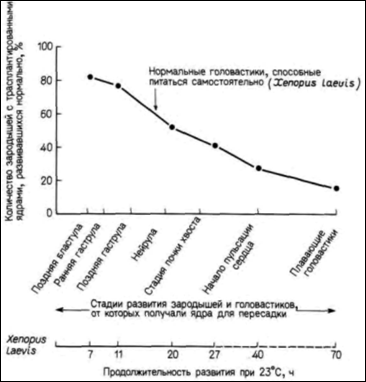
Положение мейотического веретена в яйце легко определить, поскольку на анимальном полюсе пигментные гранулы удаляются от него и прокол яйца в этом месте приводит к вытеканию мейотического веретена вместе с хромосомами наружу (рис. 9.9). Теперь яйцо является и активированным (так как процессы, необходимые для начала развития, свершены), и одновременно энуклеированным. В энуклеированные яйца переносят ядра из клеток-доноров. Для этого клетку разрывают, с помощью микропипетки захватывают ее ядро и вводят его в яйцо-реципиент. Вместе с ядром в яйцо попадает и некоторое количество окружающей его цитоплазмы клетки-донора, но соотношение цитоплазмы донора и реципиента столь ничтожно (1:105), что вряд ли она оказывает какое-либо влияние на исход опыта. В 1952 г. Бриггс и Кинг (Briggs, King, I952) показали, что ядра, взятые у зародыша на стадии бластулы, будучи перенесенными в цитоплазму яйцеклетки, обеспечивают развитие полностью сформированного головастика. Еще раньше Шпеман продемонстрировал, что клетки бластулы не детерминированы и, следовательно, их ядра тотипотентны. Поэтому если система переноса ядер работает, то ядра бластулы должны быть способны обеспечить полное развитие. Именно это и наблюдается в опытах по пересадке ядер бластулы. Шестьдесят процентов всех имплантированных ядер оказались способными направлять развитие яиц до стадии свободно плавающего головастика; все эти головастики были диплоидными (результат, подтверждающий, что их ядра происходили из ядра клетки-донора). Следовательно, система переноса ядер работает и ее можно использовать для изучения потенций ядра (рис. 9.10). Что произойдет, если в активированное энуклеированное яйцо пересадить ядро из клетки зародыша, находящегося на более продвинутой стадии развития? Результаты опытов Кинга и Бриггса (King, Briggs, 1956) суммированы на рис. 9.11. Из этого рисунка видно, что большинство ядер из клеток
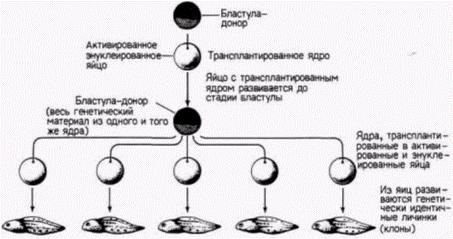
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ___________________ 73 бластулы способны обеспечить развитие яиц-реципиентов до стадии нормальных свободно плавающих головастиков, однако в ядрах, взятых от доноров, находящихся на более поздних стадиях развития, эта способность резко ограничивается. Ни одно из ядер соматических клеток, взятых на стадии хвостовой почки, не могло дать информацию, необходимую для развития нормального зародыша. Однако, когда на той же стадии брали ядра половых клеток (в норме дающих после оплодотворения начало целому организму), в 40% случаев были получены бластулы, способные к дальнейшему развитию (Smith, 1956). Следовательно, соматические клетки, становясь детерминированными и дифференцированными, по-видимому, утрачивают способность обеспечивать полное развитие организма. Было показано, что ограничение потенций ядер по мере развития является стабильным и тканеспецифическим признаком. Данные в пользу этого получали в следующих опытах. Число энтодермальных ядер, взятых на стадии поздней гаструлы, увеличивали путем серийных пересадок. С этой целью одно ядро переносили в энуклеированное яйцо; развившийся в результате такой процедуры зародыш имел на стадии бластулы тысячи идентичных ядер. Ядра этой бластулы снова переносили в энуклеированные яйца и таким образом получали много копий первоначального ядра, что позволяло количественно оценить его потенции. Такая методика называется клонированием ядер (рис. 9.12). При трансплантации неклонированных ядер наблюдается большая изменчивость в способности ядер, полученных от разных доноров, обеспечивать развитие. Некоторые ядра обеспечивают весь путь развития до стадии свободно плавающего головастика, тогда как другие - только до стадии аномальной гаструлы. Кинг и Бриггс считали эту изменчивость в разных клонах нормальной. Однако они обнаружили, что в пределах одного клона все ядра обладают одинаковыми потенциями. Каждый клон имел «характерный» фенотип, и часто стадия, на которой останавливалось развитие особей, полученных в результате пересадки ядер потомков одного клонированного ядра энтодермальной клетки, была сходной. Это наблюдалось и при трансплантации ядер, клонированных в течение нескольких поколений. Кроме того, если личинки развивались с какими-либо дефектами, то эти дефекты у всех личинок были одинаковыми. Все личинки с клонированными ядрами имели энтодермальные структуры (а именно, кишку), но у них отсутствовали некоторые производные мезодермы или эктодермы. По-видимому, ядра из клеток энтодермы пригодны для формирования энтодермы, но их способность к формированию эктодермы или мезодермы ограничена. Сходная утрата потенций была обнаружена и в ядрах клеток эктодермы (DiBerardino, King, 1967). Аномальные головастики имели превосходно дифференцированные нейральные структуры, но у них отсутствовали энтодермальные производные. Таким образом, прогрессивное ограничение потенций ядер по мере развития является, по-видимому, общим правилом. Не исключено, что ядра разных дифференцированных клеток отличаются друг от друга.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.74________________ ГЛАВА 9______________________________________________________________________________ Клонирование у амфибий: исключения из ограничения потенцийМожно, однако, и по-иному объяснить ограничение потенций ядер в дифференцированных клетках. Перенося ядро дифференцированной клетки в цитоплазму зрелого яйца, мы тем самым заставляем его вернуться к теперь уже не свойственному ему физиологическому состоянию. У лягушек в период дробления ядра клеток делятся с очень высокой скоростью, тогда как в некоторых дифференцированных клетках они делятся редко или не делятся вообще. Неспособность к репликации ДНК быстро приводит к поломкам хромосом: такие хромосомные аномалии наблюдаются во многих клетках головастиков, развившихся из яиц, содержавших клонированные ядра. Джон Гёрдон и его коллеги, используя несколько измененную методику пересадки ядер, получили результаты, показывающие, что многие из ядер дифференцированных клеток остаются тотипотентными. Главное различие между опытами Гёрдона и опытами Бриггса и Кинга заключалось в выборе объекта исследований. Гёрдон изолировал ядра из клеток Xenopus laevis, южноафриканской шпорцевой лягушки. Эта лягушка (рис. 9.13) гораздо более
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 75
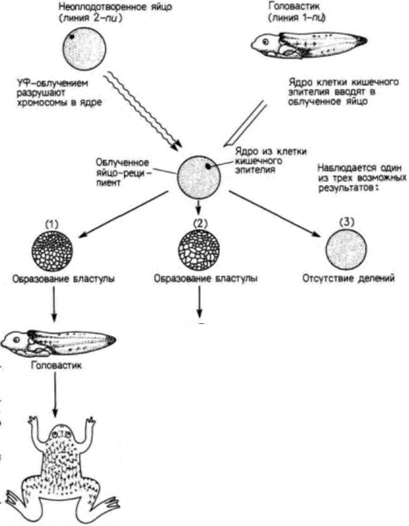
примитивна, чем Rana pipiens; y нее отсутствуют веки, среднее ухо и даже язык, столь характерный для позднее эволюционировавших видов Rana. Шпорцевая лягушка отличается также и по биологии развития. В отличие от леопардовой лягушки взрослая особь Xenopus способна регенерировать утраченные конечности; раннее развитие у нее протекает в три раза быстрее, чем у леопардовой лягушки. В частности, для достижения стадии хвостовой почки зародышу Rana pipiens требуется 80 ч, тогда как Xenopus laevis достигает той же стадии развития всего за 26 ч. Следовательно, ядра энтодермальных клеток на стадии хвостовой почки у шпорцевой лягушки имеют такой же возраст, как ядра из клеток ранней гаструлы у Rana (McKinnell, 1978). Гёрдон также обнаружил постепенную утрату потенций ядер по мере развития (рис. 9.14). Однако из этого правила выявились интересные исключения. Гёрдон переносил ядра из энтодермальных эпителиальных клеток кишечника, взятые у головастика Xenopus на стадии перехода к активному питанию, в активированные энуклеированные яйца. Ядра клеток донора имели генетический маркер одно ядрышко на клетку (линия 1-nu) вместо обычных двух (линия 2-nu). Из 726 пересаженных ядер только 10 оказались способными обеспечить развитие зиготы до стадии донора. Число ядер, обеспечивающих развитие, удалось повысить до 7% (Gurdon. 1962) с помощью метода серийных пересадок (переноса ядра из клеток кишечника в яйцо и после достижения яйцом-реципиентом стадии бластулы, последующего переноса ядер клеток бластулы в большее число яиц). В некоторых случаях ядра были способны реализовать информацию, достаточную для достижения стадии головастика и образования клеток всех линий нейронов, клеток крови и др. Кроме того, семь головастиков (развившихся после пересадки в яйца ядер, полученных клонированием двух исходных ядер) метаморфизировали и превратились в половозрелых взрослых лягушек (Gurdon, Uehlinger. 1966). Эти ядра были тотипотентными (рис. 9.15). Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.76________________ ГЛАВА 9_______________________________________________________________________________ Однако Кинг и его коллеги с сомнением отнеслись к опытам Гёрдона, считая, во-первых, что исследователи не приняли достаточных мер предосторожности, исключающих возможность использования вместо ядер кишечника ядер первичных половых клеток, которые, мигрируя, часто задерживаются в кишке, и. во-вторых, что эпителиальные клетки кишечника таких ранних, перешедших на активное питание головастиков могут не обладать свойствами вполне дифференцированных клеток. У них эти клетки еще содержат желточные пластинки (DiBerardino, King, 1967; McKinnell, 1978; Briggs, 1979). В ответ на эти критические замечания Гёрдон и его коллеги провели следующие опыты. Они культивировали эпителиальные клетки из кожных межпальцевых перепонок ноги взрослой особи Xenopus. Эти клетки были, безусловно, дифференцированными, потому что каждая из них содержала кератин – белок, характерный для клеток кожи взрослых особей. Когда ядра этих клеток пересаживали в энуклеированные яйца, ни одно из ядер не обеспечивало развития зародышей дальше нейрулы. Однако после клонирования ядер и их пересадки в энуклеированные яйца из таких яиц развивались многочисленные головастики: правда, все они погибали, не переходя на активное питание (Gurdon el al.. 1975). Сходную остановку развития наблюдали другие исследователи (Wabl et al., 1975), пытаясь получить взрослых лягушек при пересадке ядер лимфоцитов. Ди Берардино (DiBerardino, 1987) пришла к заключению, что «на сегодня еще не доказано, что ядра клеток хотя бы одного какого-либо специализированного типа или клеток взрослого организма являются тотипотентными». Результаты опытов по клонированию ядер у амфибий позволяют сделать два вывода. Во-первых, в них можно увидеть общее правило ограничения потенций в процессе развития. Это ограничение генетически детерминировано и характерно для ядер определенного типа клеток-доноров. Во-вторых, можно легко убедиться в том, что геном дифференцированной клетки обладает изумительной способностью инициировать образование всех типов клеток головастика. Ядро эритроцита лягушки, в котором никогда не происходит репликации ДНК (и синтеза мРНК), может претерпеть при серийных пересадках в общей сложности свыше 100 делений и все же сохранить способность обеспечивать развитие энуклеированного и активированного яйца в свободно плавающего головастика (Orr et al., 1986). Другими словами, даже если еще и ведутся споры о тотипотентности таких ядер, то в том, что они в высокой степени полипотентны, сомневаться не приходится. Ясно одно многие неиспользованные гены клеток кожи или крови могут реактивироваться и обеспечить образование нервов, желудка и сердца свободно плавающего головастика. Дополнительные сведения и гипотезы: Клонирование Как мы уже убедились ранее, обсуждая работы Ру и Дриша, детали экспериментальной методики могут сильно повлиять на получаемые результаты. Незначительное изменение процедуры клонирования ядер леопардовой лягушки привело к тому, что ядра, взятые даже на поздней стадии развития, обеспечивали развитие нормальной личинки. Салли Хеннен (Hennen, 1970) показала, что эффективность действия ядер донора можно увеличить, обработав их перед трансплантацией спермином или охладив яйца после пересадки, чтобы дать ядру время для адаптации к цитоплазме яйца. Обрабатывая таким способом ядра энтодермальных клеток, взятых у зародыша леопардовой лягушки на стадии хвостовой почки, и пересаживая затем эти ядра в энуклеированные яйца, Хеннен в 60% случаев получала нормальных личинок (в контрольных опытах процент таких личинок был равен нулю). Однако обработка ядер, взятых из дифференцированных клеток кожи взрослых лягушек, спермином не приводила к развитию взрослых особей из энуклеированных яиц, в которые пересаживали эти ядра. Клонирование человека из дифференцированных клеток, похоже, стало задачей некоторых журналистов и писателей (писатели задавались целью воспроизводить важных политических деятелей, таких, как Гитлер или Кеннеди, а журналисты возмечтали распространить эту методику на атлетов и кинозвезд). Из предыдущего обсуждения очевидно, что клонирование полностью развитого индивидуума из дифференцированных клеток невероятно трудное дело, да и результаты этих опытов не вполне убедительны. Даже у амфибий ядра дифференцированных клеток, взятые у взрослого животного, не способны после их пересадки в активированные и энуклеированные яйца обеспечить развитие из этих яиц взрослого животного. Но даже если бы и удалось вырастить взрослых лягушек из яиц, в которые были пересажены ядра дифференцированных клеток, то этот результат Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ________________ 77
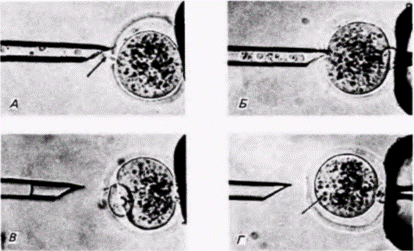
нельзя экстраполировать на человека. Не говоря уже об этических проблемах, при работе с человеческим материалом исследователь сталкивается с многочисленными трудностями. Если у самки амфибий одновременно созревают сотни яиц, то у женщины ежемесячно образуется очень мало зрелых яиц. Кроме того, цитоплазма из яйцеклетки женщины может существенно отличаться от цитоплазмы яйцеклетки лягушки по своей способности воспринимать сигналы, исходящие из ядра клетки, которая находится на более продвинутой стадии развития. Пересадки ядер были впервые осуществлены у мышей. С этой целью у одной зиготы удаляли оба пронуклеуса и замещали их пронуклеусами. взятыми из другой зиготы (McGrath, Solter, 1983). Процедура этого опыта показана на рис. 9.16. Сначала одноклеточных зародышей инкубируют в среде с цитохалазином и колхицином, чтобы ослабить микрофиламенты и микротрубочки цитоскелета. Затем зародыша удерживают на месте с помощью присасывающей пипетки, а пипеткой для энуклеации прокалывают прозрачную оболочку (zona pellucida) яйца. Цитоплазматическую мембрану клетки энуклеирующей пипеткой не прокалывают, а лишь нажимают ею на область, где находятся пронуклеусы, и втягивают внутрь пипетки этот участок мембраны вместе с прилежащей к нему цитоплазмой и пронуклеусами (А). Затем пипетку оттягивают и тем самым цитоплазму с пронуклеусами отделяют от яйца. Эта цитоплазма окружена плазматической мембраной (Б). Пипетку с пронуклеусами, окруженными мембраной, погружают в каплю, содержащую инактивированный вирус Сендай, который вызывает слияние мембран. После всасывания некоторого количества вируса пипетку приближают к другой зиготе, из которой таким же образом были удалены пронуклеусы. Прокалывают прозрачную оболочку и вводят пронуклеусы вместе с окружающей их мембраной в перивителлиновое пространство между оболочкой яйца и его плазматической мембраной (В). Затем зародыш инкубируют при температуре 37С до момента слияния мембраны яйца-хозяина и донора ядер (Г). Таким образом два пронуклеуса донора попадают в цитоплазму хозяина. Через пять дней культивирования зародыши достигают стадии бластоцисты, и их можно имплантировать в матку приемной псевдобеременной взрослой самки. Родившийся мышонок имеет фенотип мыши, служившей донором ядер. Свыше 90% энуклеированных зигот мыши, получивших ядра из других зигот, успешно развивались до стадии бластоцисты. Когда же в энуклеированные зиготы пересаживали ядра 4-клеточных Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.78________________ ГЛАВА 9___________________________________________________________________________
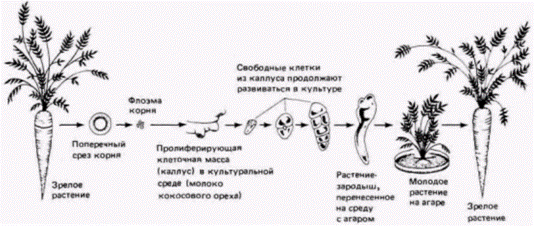
зародышей, ни одна зигота (из 81) не достигала стадии бластоцисты. Точно так же ядра из клеток 8-клеточного зародыша и из клеток внутренней клеточной массы были не способны поддерживать развитие до предимплантационных стадий (McGrath. Solter. 1984). В отличие от морских ежей и амфибий у мышей ядра ранних бластомеров (которые, как известно, являются тотипотентными) не способны обеспечить полное развитие. Эти опыты не удаются, по-видимому, из-за того, что ядра бластомеров не могут правильно функционировать в цитоплазме зиготы. Таким образом, вряд ли стоит серьезно относиться к идее (высказанной в сентябре 1984 г. в журнале «National Examiner») о клонировании второго Элвиса Пресли из его дифференцированной клетки. Однако свойства ранних бластомеров не у всех млекопитающих одинаковы: разные виды сильно различаются по времени активации и имплантации зародышей в матку. Недавно появилось сообщение (Willadsen, 1986) о том, что, используя модифицированную методику трансплантации ядер, автор получил ягнят из зигот, в которые были пересажены ядра бластомеров 8-клеточного зародыша. У мыши ядра бластомеров не способны направлять развитие зиготы, а у овцы они, по-видимому, могут это делать. Если указанное сообщение подтвердится, его результаты будут иметь огромное значение для сельского хозяйства. Случаинесомненной способности ядер клеток взрослого организма обеспечивать развитие другого взрослого организма обнаружены только у растений. Эта способность чрезвычайно четко продемонстрирована на клетках моркови и табака. В 1958 г. Стюард и его коллега разработали методику, позволившую получить из дифференцированной ткани корня моркови целое новое растение (рис. 9.17). Из корня моркови изолировали маленькие кусочки флоэмы и вращали в больших колбах, содержащих молоко кокосового ореха (которое на самом деле является его жидким эндоспермом). Оно содержит различные факторы и питательные вещества, необходимые для роста растений, а также гормоны, необходимые для их дифференцировки. В этих условиях клетки флоэмы делятся и формируют неорганизованную ткань, называемую каллусом. Непрерывное вращение вызывает выталкивание отдельных клеток из каллуса в суспензию. Из этих единичных суспендированных клеток образуются корнеподобные узелки, которые продолжают расти все время, пока остаются в суспензии. Если эти узелки перенести на среду, уплотненную агаром, то из них развиваются остальные части растения: в конце концов образуются целые растения моркови, способные к размножению (Steward et al., 1964; Steward, 1970). Весь процесс развития от единичной клетки до цветущего растения в условиях вращающейся культуры наблюдать невозможно, однако Вазил и Хильдебрандт (Vasil, Hildebrandt, 1965) проследили эти события, изолировав единичные клетки табака и наблюдая за их развитием или непосредственно, или с помощью цейтраферной киносъемки. Как и из клеток моркови, из клеток табака образовывались растеньица, которые могли расти и давать семена. Клетки табака дают нам еще один пример тотипотентности ядер. Все гены, необходимые для образования целого растения, имеются в ядре дифференцированной клетки. Однако растения и животные развиваются по-разному. Вегетативное размножение отводками (т.е. частями растения, которые. получая питательные вещества, регенерируют недостающие части) представляет собой обычный прием в практике сельского хозяйства. В отличие от животных (у которых половые клетки обособляются Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ___________________ 79 очень рано в развитии в виде отчетливой клеточной линии) у растений в норме гаметы образуются из соматических клеток. Поэтому нет ничего удивительною в том, что единичная клетка может давать начало другому типу клеток и сформировать генетически однородный клон (от греч. klon, что означает «ветвь»). Итак, мы можем сделать вывод, что дифференциальная утрата генов не является причиной дифференцировки. Ядра дифференцированных клеток содержат большую часть, а возможно, и все гены зиготы: эти гены экспрессируются в соответствующих условиях. Следовательно, процесс дифференцировки включает в себя селективную экспрессию разных частей генома. Нам предстоит более глубокое исследование проблемы постоянства генома и дифференциальной экспрессии генов с привлечением методов молекулярной биологии и клонирования генов. В следующей главе обсуждение этой проблемы будет продолжено на уровне современной молекулярной биологии. ЛИТЕРАТУРА  |