Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.50________________ ГЛАВА 8_______________________________________________________________________________
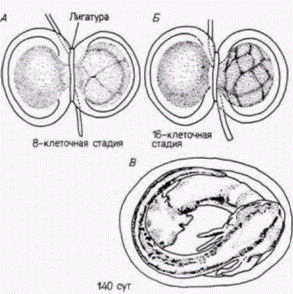
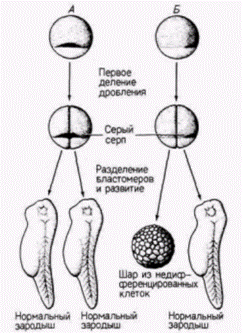
серого серпа может попасть только в один из двух бластомеров. Шпеман обнаружил, что когда эти два бластомера разделены полностью, нормально развивается только тот бластомер, который содержит материал серого серпа. Отсюда следует, что в области серого серпа содержится, по-видимому, какой-то фактор, весьма существенный для правильного развития зародыша. Но как этот фактор действует? Какую роль играет в нормальном развитии? Наиболее важный ключ к решению этого вопроса дает судьба области серого серпа. Показано, что из нее образуются клетки, которые инициируют гаструляцию и формируют спинную губу бластопора. Клетки спинной губы бластопора (см. гл. 4) запрограммированы, чтобы инвагинировать внутрь зародыша и, таким образом, начинать гаструляцию и формирование архентерона. Поскольку вес будущее развитие амфибий зависит от взаимодействия клеток, перемещающихся в процессе гаструляции. Шпеман предположил, что материал серого серпа играет решающую роль в инициации гаструляции и что в период гаструляции в развитии зародыша происходят кардинальные изменения. В 1918 г. Шпеман показал, что в период гаструляции действительно резко меняется потенция клеток. Он обнаружил, что клетки ранней гаструлы еще не детерминированы к их конечной дифференцировке, тогда как на стадии поздней гаструлы судьба клеток уже определена. Шпеман произвел пересадки тканей на стадии ранней гаструлы у двух различно пигментированных видов тритонов (рис. 8.13). Если участок презумптивного эпидермиса трансплантировали в область будущей нервной пластинки, то он превращался в нервную ткань. Λ если клетки презумптивной нервной пластинки пересаживали в область будущего эпидермиса живота, то они становились эпидермальными (табл. 8.2). Следовательно, клетки ранней гаструлы тритона не были коммитированы к специфическому типу дифференцировки. Их проспективные потенции были все еще шире их проспективного значения. Принято говорить о зависимом развитии этих клеток, поскольку их судьба зависит от их локализации в зародыше. Однако, когда такие же самые гетеропластические (межвидовые) пересадки были осуществлены на стадии поздней Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.______________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ______________________________________________________________ 51
гаструлы. Шпеман получил совершенно другой результат. Вместо того, чтобы регулировать собственную дифференцировку в соответствии со своим новым положением, трансплантированные клетки обнаружили независимое (или автономное) развитие. Их проспективное значение уже было зафиксировано, и клетки развивались независимо от своего нового положения в зародыше. Презумптивные нервные клетки теперь образовывали нервную ткань даже в том случае, когда их помещали в область будущего эпидермиса, а презумптивный эпидермис формировал кожу, даже будучи помещенным в область презумптивной нервной трубки. Следовательно, за время, прошедшее от стадии ранней гаструлы до стадии поздней гаструлы. потенции этих групп клеток сузились, так что они
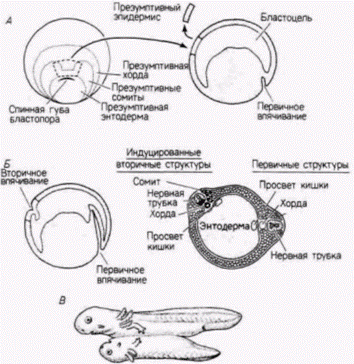
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.52________________ ГЛАВА 8________________________________________________________________________ смогли следовать только одному своему специфическом) пути дифференцировки. Эти клетки теперь можно назвать детерминированными. Под детерминацией подразумевается коммитирование (предназначение) клеток к тому, чтобы в конечном счете дифференцироваться именно в этот, а не в какой-либо иной специфический тип. Поэтому на стадии поздней гаструлы клетки анимального полюса на той стороне, где закладывается спинная губа бластопора, коммитированы (детерминированы) к образованию нервной ткани в любом месте, куда бы они ни попадали (включая чашку Петри). Их развитие уже не поддается регуляции, и они не могут превратиться в клетки других типов. Следует отметить, что критерием для определения состояния детерминации служит поведение клеток в условиях опыта. Никаких явных изменений в клетках не происходит, и еще не видно никаких признаков их дифференцировки. Молекулярные основы детерминации остаются одной из главных и пока нерешенных проблем биологии развития. Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукцияГанс Шпеман и Гильда Мангольд в 1924 г. опубликовали результаты наиболее эффектных опытов по трансплантации. Они показали, что единственной самодифференцирующейся областью на стадии ранней гаструлы является область спинной губы бластопора и что она действительно инициирует гаструляцию и эмбриогенез в окружающей ткани. В этих опытах Шпеман и Мангольд использовали зародышей двух по-разному пигментированных видов тритона: сильно пигментированного обыкновенного тритона [Triturusvulqaris (taeniatus)] и непигментированного (светлого) гребенчатого тритона (Trituruscristatus)]. Препарируя зародышей. Шпеман и Мангольд по окраске с легкостью могли различить ткани донора и хозяина. Спинную губу бластопора (материал дорсальной краевой зоны), взятую от зародышей гребенчатого тритона на стадии ранней гаструлы, пересаживали зародышу обыкновенного тритона, находящемуся на той же стадии, в область, предназначенную стать брюшным эпидермисом (рис. 8. 14. А). В отличие от других тканей гаструлы, которые развивались согласно своему новому положению, губа бластопора донора не стала брюшным эпидермисом. Она инвагинировала, как делала бы это на своем обычном месте (обнаруживая тем самым свою детерминированность), и исчезала под клетками вегетативного полушария. Светлоокрашенные ткани донора затем продолжали дифференцироваться в хордомезодерму и другие мезодермальные структуры, образова-
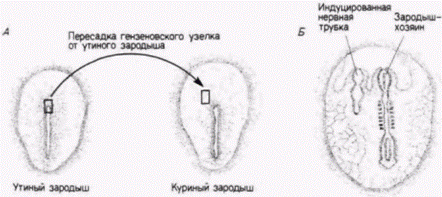
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ_________________________ 53
ние которых соответствовало собственной судьбе материала спинной губы бластопора. После того как сформировались эти вторичные осевые структуры, клетки хозяина начали также принимать участие в образовании нового зародыша, давая начало органам, которыми они никогда не должны были стать. Например, сомиты содержали как бесцветную (донорскую), так и пигментированную (хозяйскую) ткань. Но наиболее поразительным оказалось то, что хордомезодерма была способна, взаимодействуя с лежащими над ней эктодермальными клетками, индуцировать образование всей нервной пластинки. В некоторых случаях «лицом к лицу» с зародышем-хозяином формировался вторичный зародыш (рис. 8.14. А). Эти методически трудные опыты были недавно повторены с использованием ядер-маркеров: результаты опытов Шпемана и Мангольд подтвердились (Gimlich, Cook, 1983; Recanzone, Harris, I985)1. Процесс, посредством которого одна область зародыша, взаимодействуя с другой, возбуждает эту область развиваться в направлении ином, чем она развивалась бы без этого воздействия, называют индукцией. Поскольку в эмбриогенезе происходят самые разнообразные многочисленные индукционные взаимодействия, это ключевое взаимодействие, в котором дорсальная мезодерма индуцирует эктодерму к дифференцировке в нейральные структуры, получило название первичной эмбриональной индукции 2. Область спинной губы бластопора Шпеман назвал организатором. Теперь известно (главным образом благодаря Шпеману и его ученикам), что взаимодействия между хордомезодермой и эктодермой недостаточно, чтобы «организовать» целого зародыша. Точнее, это взаимодействие инициирует серию индукционных процессов. Мы также знаем теперь, что спинная губа бластопора сходным образом «организует» вторичного зародыша у Amphioxus(ланцетника), круглоротых и различных видов амфибий. Передняя часть первичной полоски (т.е. гензеновский узелок область, в которой начинается гаструляция у птиц и млекопитающих) действует сходным образом, инициируя образование вторичных зародышей у этих классов позвоночных (Waddington, 1933. рис. 8.15). Региональная специфичность индукцииОдним из наиболее любопытных явлений в первичной эмбриональной индукции является региональная специфичность образующихся нейральных структур. Переднемозговая (архенцефалическая), заднемозговая (дейтеренцефалическая) и спинокаудальная области нервной трубки должны быть организованы в соответствующем порядке спереди назад. Следовательно, хордомезодермальная ткань крыши первичной кишки индуцирует не только нервную трубку в целом, но также и ее специфические отделы. Эта региональная специфичность индукции была обнаружена Отто Мангольдом 1 Гильда Прэшольдт-Мангольд трагически погибла при взрыве бензина в нагревательном приборе. Она прожила всего 26 лет, и статья ее была только что опубликована. Опыт, который лег в основу ее кандидатской диссертации, был одним из очень немногих в биологии, имевших прямое отношение к присуждению Нобелевской премии. Более подробные сведения о жизни этого замечательного человека и ее времени можно найти в статье Гамбургера (Hamburger, 1984). 2 Этот классический термин cтал источником путаницы, поскольку индукция нервной трубки хордой больше не считается первым индукционным влиянием узародыша. Позже мы обсудим индукционные события, предшествующие этой «первичной» индукции. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
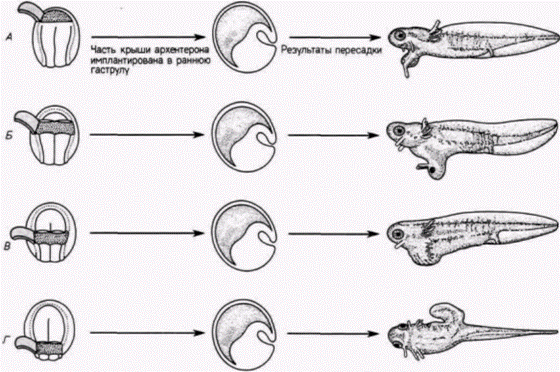
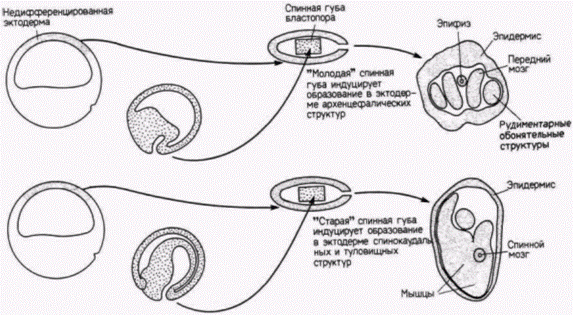
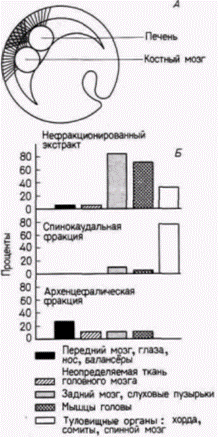
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ______________________________________________________ 55 (Mangold, 1933) в серии изящных экспериментов, в которых участки крыши архентерона, взятые на стадии ранней нейрулы тритона, имплантировали в бластоцель ранней гаструлы тритона (рис. 8.16). У зародышей, только что завершивших гаструляцию, после удаления нервной пластинки из лежащей под ней крыши первичной кишки были вырезаны четыре последовательных участка. Эти участки по отдельности имплантировали в бластоцель зародышам на стадии ранней гаструлы. Самая передняя часть крыши первичной кишки индуцировала образование балансёров и частей ротового аппарата (рис. 8.16. А): следующая за ней передняя часть индуцировала различные структуры головы, в том числе нос, глаза, балансёры и слуховые пузырьки (органы слуха) (рис. 8.16. Б). Третий участок индуцировал только слуховые пузырьки (рис. 8.16. В), а самый задний участок дорсальную туловищную и хвостовую мезодерму (рис. 8.16. Г). (Индукция задним концом хорды дорсальной мезодермы, а не дорсальной эктодермы нервной системы была подтверждена Биджтелем (Bïjtel, 1931) и Споффордом (Spofford. 1945), которые показали, что из задней 1/5 части нервной пластинки происходят хвостовые сомиты и задний отдел протока пронефроса.) Продолжая изучение феномена индукции, Гольтфретер (Holtfreter, 1936) изготовил «сандвичи» из материала спинной губы бластопора. который поместил между двумя лоскутами недифференцированной эктодермы и культивировал их in vitro (рис. 8.17). Губа бластопора, взятая на стадии ранней гаструлы. индуцировала главным образом архенцефалические структуры, тогда как материал спинной губы бластопора. взятый на все более поздних стадиях, вызывал дифференцировку все более задних нейральных структур. Существует гипотеза, что региональная спецификация обусловлена действием двух веществ, секретируемых клетками хордомезодермы. Высокая концентрация одного из этих веществ обусловливает развитие переднего мозга, тогда как высокая концентрация другого индуцирует формирование спинного мозга и туловищных структур. Смесь этих двух веществ приводит к образованию среднего и заднего мозга. Данные, подтверждающие эту модель, были получены в исследованиях с использованием искусственных тканеспецифических индукторов. Было обнаружено, например, что костный мозг морской свинки индуцирует образование только мезодермальных структур. Однако печень морской свинки может индуцировать развитие только структур переднего мозга. Тойвонен и Саксен (Toivonen. Saxèn, 1955) имплантировали оба этих индуктора в бластоцель одного и того же зародыша на стадии ранней гаструлы. И если одна печень индуцировала
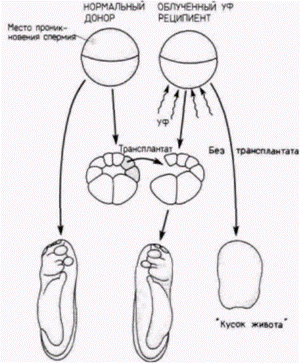
только передний мозг, а костный мозг только мезодерму, то оба вместе индуцировали нормальные передний, задний и спинной мозг и туловищную мезодерму. Таким образом, первичная нейральная индукция может также быть обусловлена двойным градиентом (рис. 8.18). В дальнейшем были получены данные, свидетельствующие о правильности модели двойного градиента: из экстракта куриного зародыша, способного индуцировать преимущественно структуры заднего мозга, выделили препараты, обладающие способностью индуцировать передний мозг и туловищные структуры (Tiedmann. 1967). Когда вещество, индуцирующее задний мозг. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.56________________ ГЛАВА 8_______________________________________________________________________________ фракционировали на колонке, получали два активных начала: одно индуцировавшее мезодермальные структуры, и другое индуцировавшее передний мозг (рис. 8.18. Б.). Механизмы первичной эмбриональной индукцииПервичная эмбриональная индукция включает в себя по крайней мере три основных процесса. Во-первых, это индукция вегетативными клетками специфических различий в мезодерме Дорсальные вегетативные клетки индуцируют лежащие над ними дорсальные краевые клетки к образованию хорды и сомитов (как это описано в гл. 4), тогда как другие вегетативные клетки индуцируют вентральные краевые клетки к образованию других мезодермальных структур. Индуцирующая способность дорсальной мезодермы (хорды), по-видимому, активируется лежащими под ней клетками энтодермы, потому что пересадка дорсальных вегетативных клеток облученным ультрафиолетом зародышам предотвращает эффект облучения; без этих клеток у зародышей не формируются осевые структуры. Следовательно, существует индукция, предшествующая «первичной» эмбриональной индукции. Во-вторых, происходит индукция нейральных клеток инволюирующими хордомезодермальными клетками. Этот тип индукции обнаружили Шпеман и Г. Мангольд. В-третьих, индукция, ответственная за возникновение региональной специфичности в нервной трубке. Этот тип индукции был описан О. Мангольдом. Современные данные подтверждают, что из вегетативной энтодермы в клетки краевой зоны зародыша постепенно поступает индуктивная информация и что в полярности эктодермы отражается региональная специфичность хордомезодермы, которая индуцирована вегетативной энтодермой, подстилающей хордомезодерму. Индукция мезодермальной специфичности энтодермойНьюкоп (Nieuwkoop, 1969, 1973, 1977) выявил значение вегетативной энтодермы для индукции. Удаляя экваториальные клетки у зародыша на стадии бластулы, он показал, что ни анимальная, ни вегетативная шапочки по отдельности не образуют мезодермальные ткани. Однако, когда эти две шапочки соединяли одну с другой, клетки анимальной шапочки оказывались индуцированными к образованию мезодермальных структур, таких, как хорда, мышцы, пронефросы и клетки крови. Кроме того, полярность этой индукции (будет ли область анимальных клеток формировать хорду или мышцы и т. п.) зависела от дорсовентральной полярности энтодермальной шапочки. В сходной серии опытов было показано (Nakamura, Takasaki, 1970), что эксплантаты из экваториальной области зародыша, взятые на стадии средней бластулы (участки, удаляемые в опытах Ньюкопа), были способны формировать мезодерму при культивировании in vitro. Эксплантаты из той же области, взятые на стадии 32 или 64 клеток, не могли формировать мезодермы и давали начало реснитчатым эктодермальным клеткам. Результаты этих опытов позволили предположить, что 1) клетки презумптивной мезодермы не детерминированы изначально, но достигают своего проспективного значения путем прогрессивного взаимодействия между анимальными и вегетативными клетками и 2) что клетки-предшественники экваториальных клеток становятся детерминированными к образованию мезодермы до начала гаструляции. В середине восьмидесятых годов гипотеза нашла свое подтверждение и более глубокую трактовку в работах Гимлиха и Герхарта (Gimlich, Gerhart, 1984; см. также гл. 4). Когда лежащую наиболее дорсально вегетативную клетку зародыша шпорцевой лягушки, находящегося на стадии 64 клеток, пересаживали другому такому же зародышу, она индуцировала образование мезодермы. Сами эти вегетативные клетки формировали энтодермальные структуры, тогда как индуцированная мезодерма возникала из клеток хозяина. Можно видеть, что этот опыт (схему которого см. на рис. 4.20) аналогичен опыту Шпемана и Мангольд. Но если Шпеман и Мангольд получили две осевые структуры у хозяина, трансплантируя клетки дорсальной краевой зоны (ДКЗ), то Гимлих и Герхарт получили тот же результат, трансплантируя наиболее дорсальные вегетативные клетки, т.е. клетки, находящиеся ниже ДКЗ. Кроме того, Гимлих показал (Gimlich. 1985, 1986), что клетки презумптивной хордомезодермы у 32-клеточного зародыша (т.е. клетки дорсальной краевой зоны, но не их вентральные или латеральные экваториальные двойники) способны индуцировать образование осевых структур. Эти трансплантаты ДКЗ также индуцировали соседние клетки хозяина к формированию осевых структур, включая сомиты и клетки ЦНС (рис. 8.19). Отсюда, по-видимому, следует, что бластомеры дорсальной краевой зоны обладают частичной автономией и что их судьба детерминируется относительно рано (Gimlich, 1985, 1986)1. Частота, с которой эти транс- 1 Описание «частичной автономии» указывает на частичный характер этого явления, поскольку полный хордомезодермальный фенотип не всегда продуцируется трансплантатами ДКЗ, взятыми со стадии 32 клеток. Так, например, даже если 92% хозяев имеют явные мезодермальные структуры, то только у 19% из них хордомезодерма образована тканями хозяина. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ_____________________________________________________ 57
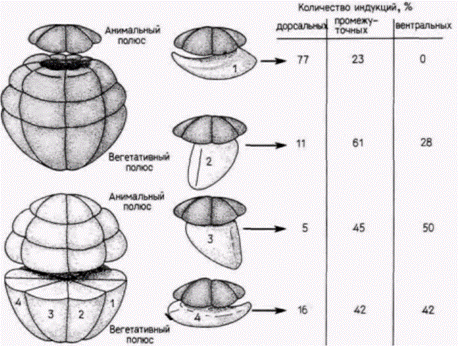
плантаты ДКЗ могут индуцировать образование полного набора осевых структур в облученных зародышах-хозяевах, вначале очень низкая и увеличивается с возрастом зародышей-доноров. Напротив, способность дорсальных вегетативных клеток индуцировать мезодерму в течение этого периода снижается (Gimlich, 1985; Boterenbrood, Nieuwkoop, 1973). По-видимому, клетки дорсального вегетативною квадранта каким-то образом активируют (или продуцируют) факторы в клетках ДКЗ и окончательный фенотип «индуктивной мезодермы» развивается постепенно по мере того, как вегетативные клетки оказывают влияние на клетки краевой зоны, лежащие над ними. Вентральные и боковые вегетативные клетки также играют определенную роль в спецификации мезодермы. Если наиболее дорсальные вегетативные клетки специфицируют осевые компоненты мезодермы (хорду и сомиты), то остальные вегетативные клетки детерминируют промежуточные (мышцы, мезенхима) и вентральные (мезенхима, кровь, пронефросы) мезодермальные структуры. Об этом свидетельствуют опыты по рекомбинации, результаты которых представлены в форме иллюстрированной таблицы на рис. 8.20 (Dale, Slack, 1987). Четыре вегетативных бластомера. взятых у 32-клеточного зародыша Xenopus. по отдельности соединяли с самым верхним ярусом клеток, взятым у меченного флуоресцеином зародыша ранней стадии. Как и ожидалось, наиболее дорсальная вегетативная клетка индуцировала в клетках анимального полюса образование дорсальных мезодермальных структур. Остальные вегетативные клетки обычно индуцировали в анимальных клетках образование либо промежуточных, либо вентральных мезодермальных структур. Эти опыты свидетельствуют о наличии двух четко различающихся индукционных процессов (один в наиболее дорсальных вегетативных клетках, индуцирующих дорсальные краевые клетки, и другой в остальных вегетативных клетках, индуцирующих промежуточную и вентральную мезодерму). Однако они не объясняют, чем процесс индукции промежуточных мезодермальных структур отличается от процесса индукции вентральных мезодермальных структур. Кроме того, данные этих авторов не вполне соответствуют карте презумптивных зачатков зародыша Xenopus, согласно которой большая часть промежуточных мезодермальных тканей происходит из вентральных краевых клеток. Дейл и Cлэк (Dale, Slack, 1987) считают, что такое несоответствие можно объяснить действием третьего индуктивного сигнала, исходящего от дорсальных краевых клеток, который «дорсализирует» прилежащие к ним краевые клетки. Изолированные вентральные краевые клетки способны образовать в основном вентральные мезодермальные структуры. Если же эти клетки культивируют вместе с дорсальными краевыми клетками, то они образуют промежуточную мезодермальную ткань. Таким образом, имеются данные о трехступенчатой спецификации мезодермы (рис. 8.21): 1) индукция дорсальной мезодермы наиболее дорсальными вегетативными клетками; 2) индукция вентральной мезодермы другими вегетативными клетками: 3) дорсализация вентральных краевых клеток, прилежащих к дорсальным краевым клеткам, приводящая к образованию промежуточной мезодермы. Влияние индукции на активность геновСогласно приведенной выше модели, эктодерма и энтодерма специфицируются как таковые автономно. Лишь мезодерма приобретает свой статус путем индукции. Эта модель появилась на свет Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.58 ГЛАВА 8
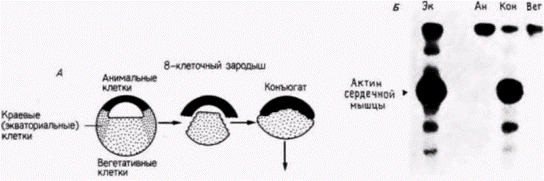
благодаря недавним исследованиям, в которых удалось идентифицировать клеточные РНК (такие методики будут изложены подробнее в гл. 10). Сарджент и др. (Sargent et al., 1986) диссоциировали ранние бластулы шпорцевой лягушки (от 32- до 128-клеточной стадии) на составляющие их клетки, удаляя оболочку оплодотворения и помещая зародышей в культуральную среду, не содержащую ионов Са и Mg. Они решили выяснить, будут ли эти диспергированные клетки по прошествии соответствующего времени синтезировать мРНК, специфичные для данного зародышевого листка. Результаты исследований показали, что гены, специфичные для энтодермы или синтеза специфического белка кишечника ) и для эктодермы (для синтеза определенного белка цитоскелета), активируются и с них транскрибируются новые мРНК даже в диспергированных клетках. Это открытие позволило предположить, что клетки энтодермы регулируются автономно содержащимися в них цитоплазматическими факторами. Однако гены, специфические для мезодермы (гены α-актина), не активируются в изолированных клетках. Когда зародышей диссоциировали даже на 128-клеточной стадии, в потомках диссоциированных клеток не удалось обнаружить мРНК α-актина. Но этот ген можно было активировать, если клеткам давали возможность формировать скопления и таким образом взаимодействовать между собой. Отсюда следует, что экспрессия генов мезодермы требует, по-видимому, взаимодействия по меньшей мере двух типов клеток. Наблюдения Ньюкопа были также подтверждены Гёрдоном и др. (Gurdon et al., 1985). Если морфологические исследования Ньюкопа правильны, то вегетативные клетки, помещенные непосредственно под клетки анимального полушария (которые в норме дают эктодермальные ткани), должны индуцировать в них активность α-актинового гена. У зародыша на стадии средней бластулы Гёрдон и его коллеги отрезали клетки краевой зоны и рекомбинировали клетки анимального полюса с массой вегетативных клеток (рис. 8 22). Они обнаружили, что в клетках анимального полюса началась транскрипция специфичной для мезодермы мРНК α-актина. Вегетативные клетки индуцировали включение специфического для мезодермы гена в презумптивной эктодермальной ткани. Одновременно эти взаимодействия вызывали утрату специфической активности эктодермальных генов (Sargent et al., 1986). Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
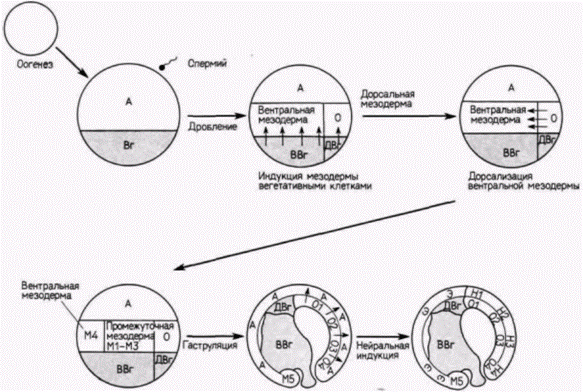
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.60________________ ГЛАВА 8___________________________________________________________________ Поиски индукторов мезодермыПредполагается, как это следует из рис. 8.21, что в индукции мезодермы участвуют три фактора (или три комплекса факторов). Два фактора (исходящие из дорсальных вегетативных клеток и из вентральных вегетативных клеток) индуцируют формирование кольца мезодермы, содержащего область организатора (т.е. клеток, лежащих над дорсальными вегетативными клетками). Организатор затем синтезирует другой фактор, регионально индуцирующий специфические мезодермальные структуры (такие, как хорда и сомиты, лежащие на дорсальной стороне, и клетки крови, локализующиеся на периферии). Эти факторы еще не идентифицированы, однако результаты недавних исследований показали, что они могут быть идентичными или очень сходными с факторами роста, которые известны как регуляторы пролиферации клеток у млекопитающих (и которые будут обсуждаться в гл. 20). Фактор, вырабатываемый вентральными вегетативными клетками, по-видимому, сходен с фактором роста фибробластов (ФРФ). Сравнительно недавно было показано (Slack et al., 1987), что клетки анимального полушария зародышей шпорцевой лягушки на стадии средней бластулы (1024-2048 клеток), подвергнутые воздействию ФРФ в слабых концентрациях, формируют мезодермальные ткани, такие, как клетки крови и мезенхиму. Кроме того, подобно ФРФ, естественный мезодермальный индуктор специфически связывается с полисахаридом гепарином. (Об этом свидетельствует тот факт, что гепарин подавляет индукцию мезодермы в клетках анимального полушария, когда эти клетки культивируют вместе с вегетативными клетками.) Затем было обнаружено (Kimelman, Kirschner, 1987), что инкубация клеток Xenopus, взятых из области анимального полюса, в присутствии ФРФ приводит к транскрипции специфических для мезодермы актиновых генов. Таким образом, представляется вероятным, что у зародышей лягушек какой-то белок, очень сходный с ФРФ, ответствен за индукцию вентральной мезодермы. Фактор, ответственный за образование дорсальной мезодермы (хорды и осевой мускулатуры), по-видимому, представляет собой белок с молекулярной массой 16 000 дальтон, который секретируется клоном клеток линии ХТС из головастиков Xenopus (Smith. 1987). Когда клетки анимального полушария зародышей Xenopusна стадии средней бластулы помещали в среду, в которой росли клетки линии ХТС (и секретировали в нее белки), то клетки Xenopus давали начало хорде и мышцам (но из них не возникали клетки крови и лишь изредка развивались почки) (рис. 8.23). Один из факторов, секретируемых клетками ХТС, возможно, аналоги
чен трансформирующему фактору роста β2 (ΤΦΡß2). Во-первых, продукты, секретируемые клетками ХТС в опытах с количественным анализом роста, способны действовать подобно ΤΦΡ-β2. Во-вторых, один ΤΦΡ-β2 оказался мощным активатором специфичного для мезодермы α-актинового гена в клетках анимальной шапочки. В-третьих, антитела к ΤΦΡ-β2 блокировали 80% индукций мезодермальных структур в клетках анимальной шапочки, помешенных в кондиционированную ХТС среду (Rosa et al., 1988). Этот ТФР-β2-подобный фактор, вероятно, является продуктом гена Vgl, мРНК которого локализована в вегетативной части яйца Xenopus (см. рис. 7.9). В развивающемся зародыше эта мРНК обнаруживается исключительно в энтодерме. Белок, который кодирует эта мРНК, напоминает белок ТФР и секретируется вегетативными клетками (Weeks, Melton, 1987). Возможно, что взаимодей- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ_____________________________________________________ 61 ствия между этими ФРФ-подобными и ΤΦΡ-β2подобными факторами ответственны за генерирование региональной специфичности мезодермальных индукторов. ФРФ усиливает способность ΤΦΡ-β2 к индукции мезодермы, а смесь ΤΦΡ-β-факторов, по-видимому, усиливает способность ФРФ к индукции мезодермы (Kimelman, Kirschner, 1987; Rosa et al., 1988). Не исключено, что дорсализирующий фактор (или факторы) присутствует во всех вегетативных клетках, но только в вегетативных клетках, занимающих наиболее дорсальное положение, он может репрессироваться. Было обнаружено (Као et al., 1986), что микроинъекция ионов лития в клетки любого вегетативного слоя, облученного ультрафиолетом 32-клеточного зародыша, приводит к образованию из него нормальной личинки с дорсовентральной полярностью. Инъекция лития в любую вентральную вегетативную клетку необлученного 32-клеточного зародыша приводит к возникновению головастика с двумя головами. По-видимому, все вегетативные клетки могут обладать потенциальной «дорсализирующей информацией», но для ее реализации необходима некоторая активация этого материала. Нейральный индуктор как молекула, способная к диффузииПерейдем теперь к стадии, на которой хордомезодерма индуцирует образование нервной трубки (т.е. к тому, что Шпеман называл первичной индукцией). Хотя Шпеман считал поиски молекулы-организатора, мягко говоря, глупостью, его ученики упорно стремились вперед. Они пришли к выводу, что идентификация активного индуктора является нелегкой задачей. Проблема заключалась в отсутствии специфичности: оказалось, что огромное число самых разных веществ могут индуцировать нервную пластинку. Среди веществ были терпентин, формальдегид и краситель метиленовый синий, а также фиксированный материал спинной губы и широкой ассортимент тканей взрослых организмов, относящихся к разным типам животных. Основываясь на таком эклектическом характере индукции, Гольтфретер (Holtfreter, 1948) предположил, что реальный индуктор может содержаться в самой эктодерме и высвобождаться из нее с помощью слабого цитолиза. Достаточным было любое воздействие, вызывающее такое сублетальное повреждение, например помещение эктодермы в слабощелочную или гипертоническую среду. Впоследствии эта гипотеза была изменена некоторыми авторами (Barth, Barth, 1969), предположившими, что различные вещества действуют, высвобождая из клеток эктодермы ионы натрия, находящиеся в них в связанном состоянии. Молекула индуктора не выделена до сих пор. хотя получены данные, свидетельствующие о том, что нейрализующий фактор в маскированной форме содержится в рибонуклеопротеидных частицах эктодермальных клеток (John et al., 1984). Какое бы вещество ни было ответственным за индукцию, для нее не требуется физический контакт между эктодермой и хордомезодермой. Ниу и Твитти (Niu, Twitty, 1953) было показано, что фактор, вызывающий индукцию, способен к диффузии. Эти авторы культивировали губу бластопора или хордомезодерму в течение недели in vitro. Когда они удалили индуктор и поместили в такую кондиционированную среду эктодерму зародыша, она дифференцировалась в нейральные, пигментные и мезодермальные клетки. Преобладание того или иного типа клеток зависело от возраста индуктора. Хордомезодерма более ранних зародышей-доноров вызывала в большинстве случаев дифференцировку нейральных и пигментных клеток. В культуральной среде, не кондиционированной тканями индуктора, не наблюдалось ни нейральной, ни мезодермальной дифференцировки эктодермальных клеток. Следовательно, для осуществления индукции не нужен физический контакт между индуктором и реагирующей тканью. Сходные данные получил Тойвонен (Toivonen, 1979), поместив спинную губу бластопора и эктодермальную ткань на противоположные стороны мембранного фильтра с диаметром пор 0.5 мкм. И хотя в порах мембраны не было обнаружено отростков клеток, индукция имела место. Таким образом, подтвердились данные о том, что индукция может происходить без контакта между клетками. Все еще ведутся споры относительно компонентов и механизма первичной эмбриональной индукции, одной из старейших проблем биологии развития. В одном обзоре, написанном в 1985 г. (Smith et al., 1985), авторы признаются: «Нельзя не согласиться с тем. что мы в самом деле ничего не знаем о биохимических основах индукционных взаимодействий». Обсуждая эту проблему в 1927 г., Шпеман заметил: «То, что достигнуто, - это лишь первый шаг. Мы стоим перед загадками, но не без надежды решить их. А загадки с надеждой на их решение - чего еще больше может желать ученый?» Брошенный Шпеманом вызов все еще остается в силе. Компетенция и вторичная индукцияКаждая система эмбриональной индукции состоит по меньшей мере из двух компонентов: из ткани, способной синтезировать индуцирующие Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.62________________ ГЛАВА 8______________________________________________________________________________
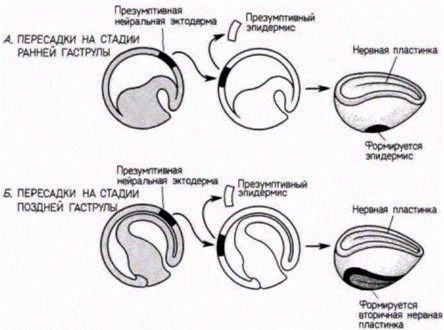
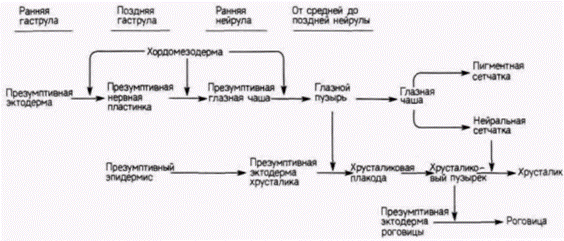
стимулы, и ткани, способной воспринимать эти стимулы и реагировать на них. До сих пор мы рассматривали специфичность стимулов; теперь мы обратимся к специфичности реагирующих клеток. Способность отвечать специфическим образом на данный стимул называется компетенцией. Мы уже видели, что на стадии ранней гаструлы имплантированная спинная губа бластопора может индуцировать нервную пластинку и осевые структуры почти в любом месте зародыша, где имеется эктодерма. Однако с возрастом эктодерма зародыша теряет способность реагировать на воздействие, и имплантация спинной губы бластопора под презумптивный эпидермис на стадии нейрулы не приводит к формированию у зародыша новой нервной пластинки. Итак, эктодермальный эпителий поздней нейрулы более не компетентен реагировать на воздействие хордомезодермы. однако он становится компетентным к реакции на новые индукторы. Например, на контакт с глазным пузырем (происходящим из переднего мозга) он отвечает образованием хрусталика. Сходным образом задний мозг может индуцировать в прилегающей к нему области эпителия образование слуховых пузырьков. Следовательно, эктодермальный эпителий приобрел способность отвечать на стимулы, получаемые от вторичных индукторов. Будет полезно рассмотреть здесь одну из схем этих вторичных индукций. (Такие индукции представляют собой наиболее важные события в развитии и будут подробно обсуждаться в гл. 16.) Если бы Шпеман никогда не выполнил описанных выше опытов, открывших явление первичной эмбриональной индукции, ему все равно была бы обеспечена слава благодаря проведенному им анализу тканевых взаимодействий в развитии глаза. Эти вторичные индукции иллюстрирует рис. 8.24. Формирование хрусталика, как уже упоминалось, начинается, когда выпячивание переднего мозга (глазной пузырь) на стадиях от средней до поздней нейрулы вступает в контакт с лежащим над ним эпителием В результате такого контакта передняя стенка глазного пузыря инвагинирует, образуя двуслойную нейральную структуру – глазную чашу Глазной пузырь ответствен за индукцию хрусталиковой плакоды в лежащем над ним эпителии. Если между глазным пузырем и лежащим над ним эпителием поместить какую-либо преграду, то хрусталиковая плакода не формируется. Глазная чаша дифференцируется на пигментную и нейральную части сетчатки (ретины). Хрусталиковый пузырек представляет собой и индуцирующую, и реагирующую ткань. Он индуцирует в новом лежащем над ним эпителии образование роговицы, и вместе с тем он отвечает на индуцирующие стимулы нейральной сетчатки, дифференцируясь в дефинитивный хрусталик. Таким образом, и при первичных, и при вторичных индукциях происходит прогрессивное ограничение потенций эктодермальных клеток. При первичных индукционных взаимодействиях изменения происходят в период гаструляции; при вторичных индукционных взаимодействиях детерминация на· ступает позже. И в этих случаях мы снова видим, что детерминация зависит от взаимодействия между группами клеток. В этой и в предыдущей главах мы обсуждали механизмы детерминации эмбриональных клеток. Мы видели, что имеются два главных способа, с помощью которых осуществляется детерминация. Первый способ состоит в распределении морфогенетических детерминантов по специфическим клеткам и последующей детерминации этих клеток в зависимости от того, какая область цитоплазмы Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ПРОГРЕССИВНАЯ ДЕТЕРМИНАЦИЯ_____________________________________________________ 63
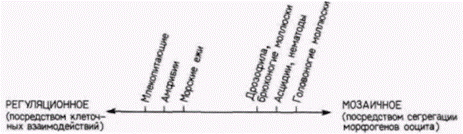
зиготы включена в них. Каждая такая клетка будет дифференцироваться автономно, независимо от окружающих ее клеток. Организмы, в развитии которых превалирует этот способ детерминации, следуют по пути мозаичного развития. Второй способ детерминации включает в себя взаимодействие клеток на более поздних стадиях развития. Клетки развиваются соответственно своему положению в зародыше. Зародыши, чьи клетки первоначально детерминируются таким способом, следуют по регуляционному типу развития. Так, любая клетка в наиболее анимальном слое раннего зародыша морского ежа будет в норме давать эктодермальное потомство, но если ее комбинировать с микромерами, то она может образовать ткань кишки, что характерно для энтодермы. Очень важно помнить о том. что оба механизма используются в развитии любого конкретного организма и что имеется непрерывный ряд между мозаичным и регуляционным типами развития (рис. 8.25). У животных с мозаичным типом развития, таких, как оболочники и улитки, некоторые ткани образуются в результате регуляционных взаимодействий, а у животных с регуляционным типом развития, таких, как лягушки, имеются области цитоплазмы, содержащие морфогенетические детерминанты (например, полярные гранулы). Следует подчеркнуть, что как мозаичный, так и регуляционный способы детерминации могут быть прослежены в обратном направлении до гетерогенно расположенных материалов в цитоплазме зиготы. Механизмы, которые обусловливают локализацию в цитоплазме определенных клеток особых молекул, влияющих на экспрессию генов, до сих пор неизвестны. ЛИТЕРАТУРА  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.64________________ ГЛАВА 8_______________________________________________________________________________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||