Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ______________ 93
ваны и что они могут продуцировать белки, специфичные для клеток других типов. Убедительные данные о реактивации неиспользуемых генов у млекопитающих были получены в лаборатории Μэри Вейс (Peterson, Weiss, 1972; Brown, Weiss, 1975) при использовании методики слияния дифференцированных клеток различных типов. Клетки могут сливаться естественным образом (как в случае развития мыши), или их можно искусственно стимулировать к слиянию, воздействуя такими агентами, как инактивированный вирус Сендай (вирус мышиной кори) или полиэтиленгликоль1. При слиянии клеток возникает ситуация, при которой два ядра оказываются в обшей цитоплазме (рис. 10.16). В благоприятных условиях оба ядра гибридной клетки одновременно войдут в митоз и в результате образуют гибридное ядро, содержащее хромосомы из родительских клеток обоих типов. В большинстве случаев, когда клетки двух различных типов сливаются друг с другом, полученный гибрид теряет свойства, характерные для родительских клеток. В результате слияния опухолевых клеток из печени крысы с фибробластами мыши Вейс смогла получить гибриды, содержащие два набора хромосом из печени на один набор из фибробластов. Эти клетки сохранили способность синтезировать белки, специфичные для печени крысы, такие, как альбумин, альдолаза и тирозинаминотрансфераза (ТАТ). Более удивительно, что кроме этих белков они синтезировали также мышиные альбумин, альдолазу и ТАТ – три белка, которые никогда не синтезируются фибробластами. Фибробласты мыши сохранили гены, специфичные для печени, в форме, которая допускает их экспрессию в определенных условиях. Эта ситуация соответствует общему правилу развития животных: в процессе дифференцировки клеток необратимых генетических изменений не происходит. Нарушение стабильности геномов: изменения в генах лимфоцитовИспользование методов молекулярной биологии позволило выявить интересное исключение из сформулированного выше правила; исключение это – дифференцировка лимфоцитов. В соответствии с общим правилом неиспользуемые гены присутствуют в дифференцированных клетках и сохраняют способность к функционированию. Набор генов одинаков во всех тканях. Геном же каждого типа лимфоцитов отличается от генома любых других типов клеток в организме, в том числе и от геномов других типов лимфоцитов. Примером такого рода являются В-лимфоциты клетки, которые синтезируют антитела. Антитела образуются, когда чужеродный субстрат (антиген) приходит в контакт с В-лимфоцитами, находящимися в лимфатических узлах и селезенке. Еще до контакта с антигеном в каждом из 1 В последнее время широко используется слияние клеток или их фрагментов в электрическом поле. – Прим. ред. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.94________________ ГЛАВА 10______________________________________________________________________________
покоящихся В-лимфоцитов синтезируются молекулы антител, однако из клеток они не выделяются, а встраиваются в клеточные мембраны лимфоцитов. Каждый B-лимфоцит продуцирует антитела, которые узнают один и только один антиген. Таким образом, антитела, узнающие белковую оболочку вирусов полиомиелита, не будут узнавать холерный токсин, мембрану клетки Е. coliили вирус гриппа. После того как связанные с мембраной антитела присоединяют молекулы определенного антигена, В-лимфоцит многократно делится и дифференцируется в плазматическую клетку, секретирующую антитела (рис. 10.17 и 10.18). (Механизм этой дифференцировки будет подробно рассмотрен в гл. 16.) К размножению и секреции антител стимулируются только те В-лимфоциты, которые обладают способ-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с._____________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ_______________________ 95
ностью связывать данный антиген. В соответствии с этой моделью, названной теорией клональной секреции (Burnett, 1959), каждый B-лимфоцит приобретает присущую ему специфичность до контакта с антигеном. Иными словами, из миллионов различных видов антител, которые каждый В-лимфоцит может производить, он «выбирает» только один вид и размещает антитела этой специфичности на своей клеточной поверхности. Механизм этой селекции по специфичности антител включает образование новых генов в ходе дифференцировки B-лимфоцитов. Белок антитела на клеточной поверхности состоит из двух пар полипептидных субъединиц (рис. 10.19): двух идентичных тяжелых цепей и двух идентичных легких цепей. Цепи связаны друг с другом дисульфидными связями. Специфичность молекулы иммуноглобулина (т.е. избирательность связывания с вирусом полиомиелита, клеткой Е. coliили какими-либо другими молекулами) определяется последовательностью аминокислот в вариабельной области. Эта область формируется из амино-концов одной тяжелой цепи и одной легкой цепи. Вариабельные области молекул иммуноглобулинов присоединены к константным областям, которые придают антителу его эффекторные свойства. Например, константная область тяжелых цепей молекул поверхностных иммуноглобулинов удерживает эти белки в клеточной мембране. ФОРМИРОВАНИЕ ГЕНОВ ЛЕГКИХ ЦЕПЕЙ АНТИТЕЛ. Гены для легких и тяжелых цепей лимфоцитов разделены на сегменты. Гены легких цепей состоят из трех сегментов (рис. 10.20). Первый сегмент гена кодирует вариабельную (V) область легкой цепи. Она содержит около 300 различных последовательностей, которые кодируют в общей сложности пер-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.96________________ ГЛАВА 10______________________________________________________________________________
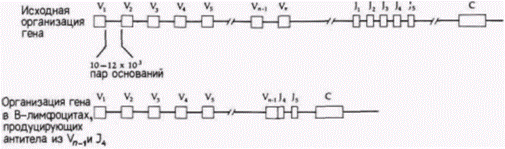
вые 97 аминокислот легкой цепи антитела. Второй сегмент, J-область, состоит из четырех или пяти возможных последовательностей ДНК для последних 15—17 остатков вариабельной части легкой цепи антитела. Третий сегмент определяет константную (С) область легкой цепи. В ходе развития В-лимфоцита одна из трехсот V-областей и одна из пяти J-областей комбинируются друг с другом и образуют вариабельную часть гена антитела. Это достигается перемещением последовательности V-области к последовательности J-области перестройки, которая сопровождается удалением промежуточной ДНК. О такой перестройке гена впервые сообщалось в работе Хозуми и Тонегавы (Hozumi, Tonegawa, 1976). Эти исследователи выделили ДНК из зародышей мыши и опухолевых B-клеток, секрети-
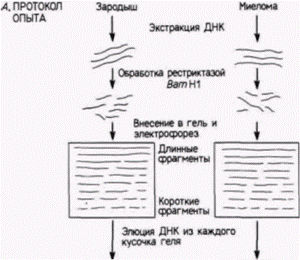
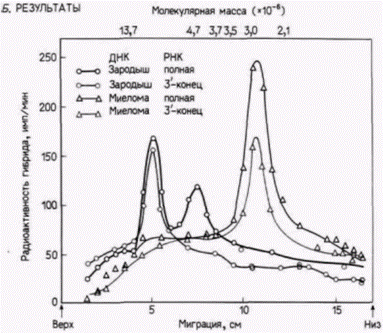
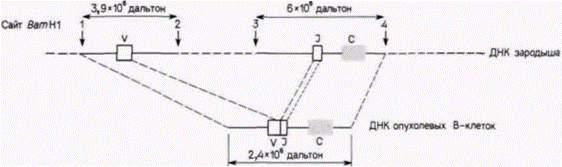
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.______________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ___________________ 97 рующих легкие цепи 1. Каждый из двух препаратов ДНК обрабатывали рестриктазой BamHI,которая расщепляет в ДНК последовательность ГГАТЦЦ, где бы она ни находилась. В результате были получены серии фрагментов ДНК. Размеры каждого фрагмента определялись длиной участка ДНК между двумя сайтами расщепления. Полученные фрагменты ДНК наносили на край желеобразного плоского геля, через который пропускали электрический ток (рис. 10.21). При миграции ДНК к положительному электроду меньшие по размеру фрагменты двигались быстрее, чем ее крупные фрагменты, за счет чего достигалось эффективное разделение фрагментов по размерам. Гель с распределенной по нему ДНК разрезали на кусочки, каждый из которых содержал фрагменты ДНК определенного размера2. Из каждого кусочка элюировали ДНК и денатурировали ее. Часть этой ДНК гибридизовали с радиоактивной РНК, которая кодирует полную легкую цепь и была изолирована из исходных опухолевых B-клеток. Другую часть гибридизовали с радиоактивной РНК, которая кодирует лишь С-область легкой цепи (фрагмент мРНК с 3'-конца). ДНК из клеток зародышей связывалась с мРНК легкой цепи в двух зонах геля. ДНК в первой зоне имела молекулярную массу около 6 млн. дальтон, тогда как ДНК во второй зоне – 3,9 млн. дальтон. При гибридизации ДНК зародышей мыши с мРНК для С-области легкой цепи эта РНК связывалась лишь с ДНК из зоны с молекулярной массой 6 млн. Таким образом, в зародышах мыши С-область кодируется внутри фрагмента ДНК с молекулярной массой 6 млн. (между сайтами BamHI). тогда как V-область кодируется внутри фрагмента с массой 3,9 млн. (рис. 10.22). Принципиально иной результат был получен для ДНК из опухолевых лимфоцитов. Единственная зона ДНК, связывающая мРНК легкой цепи, имела молекулярную массу 2,4 млн. Кроме того, эта зона связывала фрагмент мРНК, кодирующий С-область легкой цепи. Оказалось, что обе области, С и V, кодируются одним и тем же фрагментом ДНК! Простейшее объяснение, которое было многократно подтверждено в других лабораториях и с помощью иных методов (см. Brack et al., 1978; Bernard el al., 1978; Seidman ei al., 1979), заключается в том, что два фрагмента гена, один из которых кодирует С-область легкой цепи и другой – специфичную V-область легкой цепи, соединились вместе, образовав новый ген. Новый ген возник в ходе развития лимфоцита. Предложенная авторами схема образования такого гена показана на рис. 10.23. ФОРМИРОВАНИЕ ГЕНОВ ТЯЖЕЛЫХ ЦЕПЕЙ АНТИТЕЛ. Гены тяжелых цепей антител содержат даже боль-
1 Опухолевые клетки были использованы потому, что они синтезируют огромное количество определенного иммуноглобулина (и мРНК для этого иммуноглобулина). 2Размер ДНК в каждом кусочке геля определяли по миграции фрагментов ДНК с известной длиной на параллельной дорожке. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.98________________ ГЛАВА 10______________________________________________________________________________
шее число сегментов, чем гены легких цепей. Сегменты гена тяжелой цепи включают V-область (200 различных последовательностей для первых 97 аминокислот). D-область (10-15 различных последовательностей для 3-14 аминокислот) и J-область (четыре последовательности для последних 15–17 аминокислот V-области). Следующий фрагмент – это С-область. Вариабельная область тяжелой цепи формируется в результате присоединения одной V-последовательности и одной D-последовательности к одной из J-последовательностей (рис. 10.24. А, Б). Эта VDJ-последовательность вариабельной час-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ________________ 99 ти далее присоединяется к первой С-области тяжелой цепи, специфичной для антител, которые могут быть встроены в плазматическую мембрану. Таким образом, молекулы антител формируются двумя генами, возникающими в ходе антигеннезависимой стадии развития В-лимфоцита. Эти молекулы встраиваются в клеточную мембрану и служат рецепторами антигенов. ПЕРЕКЛЮЧЕНИЕ КЛАССОВ В ГЕНАХ ТЯЖЕЛЫХ ЦЕПЕЙ. После стимуляции антигеном В-клетка делится и дифференцируется в плазматическую клетку секретирующую антитела. Вначале антитела, синтезируемые этими клетками, содержат ту же С-область, что и ранее. Однако при дальнейшем синтезе антител С-область может измениться. Исходную С-область называют константной мю-областью (Cμ). Следующая С-область та, что содержится в секретирующих антителах, может остаться μ-областью (хотя и с модификацией, которая обеспечивает секрецию), но может также стать гамма(γ)эпсилон(ε)- или альфа(α)-константной областью. Таким образом, один и тот же вариабельный участок тяжелой цепи может соединяться вначале с константной μ-областью, а позже, например, с константной γ-областью. Это явление называется переключением классов. (Класс тяжелых цепей антител определяет характер их функционирования: μ- и γ-цепи стимулируют лизис, агглютинацию или разрушение антигена макрофагами: ε-цепи вызывают воспалительный процесс, а α-цепи обеспечивают выделение антител в слизь, слезы, слюну и молоко.) Переключение классов осуществляется транслокацией полного сегмента вариабельной области гена (VDJ) из положения перед константной μ-областью в участок, примыкающий к константной γ-, ε- или α-области (рис. 10.24. В, Г). Этот процесс заключается в делеции сегмента константной μ-области гена из генома (Davis et al., 1980; Cory et al., 1980; Rabbits et al., 1980; Yaoita, Honjo, 1980). Таким образом, геном плазматической клетки существенно отличается от генома любой другой клетки. Во-первых, в нем была создана последовательность вариабельной области гена посредством объединения различных сегментов ДНК. В клетках всех других органов эти сегменты ДНК разделены, а в В-лимфоцитах и плазматических клетках они собраны вместе. Во-вторых, во многих плазматических клетках часть генома (а именно ДНК из константной μ-области тяжелых цепей) элиминируется из ядер. Определенная часть генома утрачивается в ходе развития плазматической клетки: создаются новые гены, тогда как другие разрушаются. Какие выводы можно сделать? Имеющиеся данные свидетельствуют о том, что ядра дифференцированных клеток действительно сохраняют основную часть своей генетической информации в форме, которая допускает ее экспрессию в соответствующих условиях. Тем не менее очевидно, что по крайней мере при дифференцировке клеток одного типа происходит некоторая утрата генетического материала. Пока у нас нет возможности выяснить, каково разнообразие необратимых генетических изменений, которые могут происходить в процессе развития животных Однако известные нам сведения о перестройке генов в лимфоцитах указывают на то, что необратимые генетические потери являются следствием клеточной дифференцировки, а не ее причиной. Дополнительные сведения и гипотезы: Изменения геновГеном плазматических клеток дефицитен по определенным последовательностям ДНК, которые необходимы для дифференцировки. Клетки иммунной системы другого типа – Т-лимфоциты – также утрачивают часть генома при формировании рецепторов своего антигена (Fujimoto, Yamagishi, 1987). Но это лишь одна из форм генетической нестабильности. Известны и другие примеры (Borst, Greaves, 1987). Геном паразитического простейшего Trypanosomabrucei, вызывающего сонную болезнь, может меняться, чтобы продуцировать разные гликопротеины клеточной поверхности (благодаря этому паразит ускользает от иммунной системы хозяина). Сходный механизм, по всей вероятности, ответствен за изменение типа скрещивания у дрожжей (Hoeijmakers et al., 1980; Haber et al., 1980; Strathern et al., 1979). В этом случае каждая гаплоидная клетка содержит оба гена, определяющие тип скрещивания. Выбор типа скрещивания зависит от того, какой из этих генов занимает определенную позицию на хромосоме. Эти позиции переключаются в процессе деления клеток. Так, если в одном поколении ген типа скрещивания а находится в локусе «включено», то в следующем поколении в этом положении находится ген α, а ген а дожидается своей очереди по соседству. В каждом из этих трех примеров фигурируют гены, ответственные за узнавание клеточной по- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.100_______________ ГЛАВА 10_____________________________________________________________________________
верхностью. Это явление наблюдается в ходе всего развития позвоночных (часть III), поэтому не следует удивляться тому обстоятельству, что утрата тотипотентности была вызвана необратимыми изменениями генома. В дополнение к уже описанным рекомбинантным событиям разнообразие антител может создаваться также в результате соматических мутаций. Было показано, что при дифференцировке В-клетки в плазматическую клетку происходит значительное количество точковых мутаций (Crews et al., 1981). Мутации другого типа являются следствием встраивания в ген мобильных элементов (или транспозонов). Транспозоны представляют собой подвижные фрагменты ДНК, которые могут интегрироваться в различные части генома. Если мобильный элемент разрывает структурный ген, то ген инактивируется. Такая ситуация наиболее хорошо изучена на примере бактерий, кукурузы и дрозофилы. У кукурузы транспозон, встроившийся в ген окраски зерен или рядом с этим геном, вызывает образование бесцветных зерен (McClintock, 1952; Peterson, 1980). Однако после удаления транспозона из гена синтез пигмента восстанавливается. В результате наблюдается мозаичный фенотип (рис. 10.25). У дрозофилы мутация white-aprikotвызывается встраиванием мобильного элемента в область гена white(см. цветную таблицу на внутренней стороне обложки; Green, 1980; Gehring, Paro, 1980). До сих пор неизвестны случаи, когда подобные изменения в положении транспозонов управляют какими-либо процессами развития. Транспозоны могут встраиваться в геномную ДНК подобно тому, как встраиваются ретровирусы, и они могут быть использованы, подобно ретровирусам, для введения нового генетического материала в клетки дрозофилы (Spradling, Rubin, 1982). Итак, ясно, что геном представляет собой динамическое целое и не является абсолютно стабильной структурой. Способность ядер к изменению явилась сюрпризом для многих биологов, однако она была предсказана основоположником генной теории Томасом Хантом Морганом. В 1927 г. Морган письменно свидетельствует, что «наиболее общим генетическим допущением является то, что гены остаются неизменными в продолжение всего времени [развития]». Он разъясняет, что «основа строения гена остается всегда одной и той же, а постулируемые добавления или изменения гена являются событиями такого порядка, которые происходят в протоплазме. Если последняя может изменяться при дифференцировке в новой окружающей среде, не утрачивая своих фундаментальных свойств, то почему этого не могут делать гены? Совершенно очевидно, что этот вопрос выходит за пределы имеющихся данных, но в качестве возможности его не следует отбрасывать. С ответом на этот вопрос следует подождать до того времени, пока не удастся получить экспериментальные данные». Дифференциальный синтез РНКТретий постулат – то, что лишь небольшая часть генома участвует в создании тканеспецифических продуктов, – был проверен также для многих организмов. Цитоплазматическая РНК насекомых и позвоночных гибридизовалась менее чем с 10% возможных доступных сайтов ДНК, хотя были получены данные, что эта РНК содержит все тканеспецифические последовательности. При изучении дрозофилы (Becker, 1959) и личинок комара Chironomus (Beermann, 1952) было обнаружено, что в хромосомах существуют «раздутые» участки. Такие участки, или пуфы, обнаруживались в различных областях хромосом из разных тканей, и их расположение менялось в ходе развития клеток (рис. 10.26). Кроме того, образование некоторых пуфов можно было индуцировать или подавить изменени- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ__________________ 101
ем физиологических условий, например при тепловой или гормональной обработке (Clever, 1966; Ashburner, 1972; Ashburner, Berendes, 1978). В настоящее время известно, что эти пуфы представляют собой расплетание политенной хромосомы в менее компактную структуру (рис. 10.27). Впервые данные о том, что такие пуфы являются местом активного синтеза мРНК, были получены Бирманом (Beermann, 1961). Этот автор обнаружил два скрещивающихся между собой вида Chironomus, один из которых продуцировал мажорный белок слюны, а другой не продуцировал (рис. 10.28). У продуцента в определенной зоне политенных хромосом из клеток слюнной железы личинки имелся большой пуф (кольцо Бальбиани); этот пуф отсутствовал у непродуцентов. У гибридной личинки, полученной в результате скрещивания продуцента с непродуцентом, синтезировалось промежуточное количество белка слюны. После скрещивания двух гибридных особей способность продуцировать белок слюны сегрегировала в соответствии с правилом Менделя (1 хороший продуцент:2 промежуточных продуцента: 1 непродуцент). Кроме того, оказалось, что хороший продуцент имеет два пуфа (по одному на каждой гомологичной хромосоме), тогда как промежуточный продуцент имеет лишь один пуф. Исследователь пришел к выводу, что генетическая информация, необходимая для синтеза данного белка слюны, представлена в этом дистальном диске хромосомы и что синтез данного продукта зависит от превращения этого диска в пуф. Дополнительные данные о том, что хромосомные пуфы синтезируют мРНК, были получены при исследовании пуфов кольца Бальбиани 2 из клеток Chironomustentans. Исключительно большие размеры кольца Бальбиани 2 (BR2) позволяют изолировать его с помощью методов микрохирургии. Для анализа продуктов его активности используют электрофорез и радиоавтографию (Lambert, Daneholt, 1975). На рис. 10.29 показано выделение BR2 из хромосомы IV Ch. tentans. Чтобы проследить судьбу РНК кольца Бальбиани, из клеток слюнных желез можно выделить также нуклеоплазму и цитоплазму. Транскрипцию в кольце Бальбиани 2 выявляют, инкубируя изолированные слюнные железы с радиоактивными предшественниками РНК и затем экстрагируя радиоактивную РНК из участка BR2 рассеченной хромосомы (Lambert, 1972). Коэффи- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.102_______________ ГЛАВА 10_____________________________________________________________________________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ_______________ 103
циент седиментации этой РНК составляет 75 S, что указывает на исключительно большие размеры РНК (примерно 50 000 оснований). Эта 75S-PHK гибридизовалась исключительно с областью BR2 на хромосоме: следовательно, ее активная транскрипция проходила на ДНК пуфа, а не в каком-либо ином локусе (рис. 10.30). В отличие от большинства других РНК размеры 75S-PHK из кольца Бальбиани заметно не уменьшались при ее перемещении через ядро в цитоплазму. Отмеченное свойство делает эту РНК особенно ценной, поскольку если она кодирует белок, то из-за большого количества связывающихся с ней рибосом должен образовываться комплекс с исключительно высокой молекулярной массой. Поэтому слюнные железы вновь инкубировали с радиоактивными предшественниками РНК и комплексы цитоплазматических полисом осаждали в градиенте сахарозы. Некоторые полисомы характеризовались очень высоким коэффициентом седиментации. Этот результат указывает на присутствие РНК, способной связать большое количество рибосом, что и наблюдалось в действительности (рис. 10.31). Из этих гигантских полисом экстрагировали РНК (удаляя рибосомы с помощью ЭДТА) и в итоге получали 75S-PHK, которая гибридизовалась исключительно с областью BR2 хромосомы (Wieslander, Daneholt, 1977). Таким образом. РНК, транскрибируемая в области, где образуется пуф в слюнной железе личинки, затем участвует в синтезе белков на цитоплазматических рибосомах. Следовательно, пуфы на хромосомах слюнных желез активно синтезируют мРНК. Боннер и Пардью (Bonner, Pardue, 1977) на молекулярном уровне получили данные, свидетельствующие о том, что по крайней мере некоторые пуфы отражают регулируемую в развитии транскрипцию отдельных генов. Учитывая классическое наблюдение, что экдистерон вызывает появление одних пуфов и исчезновение других (рис. 10.32,.·А), эти исследователи инкубировали слюнные железы дрозофилы в среде с радиоактивными предшественниками РНК. Некоторые культуры содержали экдистерон, а другие – не содержали. Из этих культур выделяли РНК, которую затем связывали с хромо- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.104____________ ГЛАВА 10_____________________________________________________________________________
сомами слюнных желез с помощью гибридизации in situ. Гибридизация РНК с пуфами, индуцированными экдистероном, наблюдалась только в случае, если РНК была мечена в присутствии экдистерона (рис. 10.32. Б). Гибридизация с пуфами, подавляемыми экдистероном, проходила наилучшим образом, когда использовали РНК из тех желез, которые культивировали без экдистерона. Кроме того, РНК из имагинальных дисков, стимулированных экдистероном. не гибридизовалась со стимулированными экдистероном пуфами слюнных желез. Благодаря этому выяснилось, что эти пуфы являются тканеспецифичными, они меняются при изменении клеточной активности и в них синтезируются тканеспецифичные РНК. Дифференциальная активность генов регулируется во времени и в пространстве. Для определения времени транскрипции определенных генов весьма ценными оказались клонированные гены. Сарджент и Дэвид (Sargent, Dawid, 1983) из зародышей Xenopusна стадии гаструлы выделили мРНК, которая отсутствовала в яйце. К этой мРНК были получены кДНК-копии. Эти кДНК из клеток гаструлы исследователи смешивали с избытком мРНК из ооцитов. Если мРНК ооцита гибридизуется с комплементарной ДНК гаструлы, то это означает, что данная кДНК получена для фракции мРНК, которая присутствует как в ооците, так и в зародыше на стадии гаструлы. Полученные двухцепочечные гибридные молекулы удаляли с помощью фильтрации, оставляя, таким образом, популяцию молекул кДНК, специфичных для гаструлы. Затем эти кДНК делали двухцепочечными (с помощью ДНК-полимеразы) и вводили в векторы для клонирования. Этот метод называют клонированием с вычитанием. Он позволяет получить стадиоспецифичную библиотеку клонов, мРНК для которых обнаруживается на одних стадиях и отсутствует на других (рис. 10.33). Затем исследователи брали зародышей на разных стадиях развития от зиготы до головастика и для каждой стадии изолировали РНК. Эту РНК наносили в точки на нитроцеллюлозные фильтры так, чтобы на каждом фильтре была РНК со всех стадий. После того как РНК запекли на фильтре, одноцепочечную ДНК, полученную из отдельных клонов, метили радиоактивностью и инкубировали с фильтрами. В случае если ген транскрибируется на данной стадии, радиоактивная кДНК для этого гена Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.___________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ__________________ 105
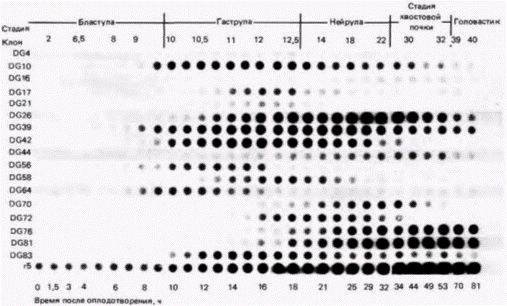
должна найти на фильтре свой комплемент среди мРНК данной стадии. Затем несвязавшуюся кДНК отмывали, а связавшуюся радиоактивную кДНК регистрировали с помощью радиоавтографии. Этот метод называют дот-блоттингом. На рис. 10.34 показаны временные зависимости экспрессии для 17 генов, которые функционируют на разных этапах гаструляции. Ни один из них не экспрессируется ранее средней бластулы на седьмом часу развития. Некоторые гены (DG64, DG39) экспрессируются сразу после этого, тогда как другие гены (например, DG72 или DG81) начинают транскрибироваться на стадии средней гаструлы примерно семью часами позже. После активации уровень активности некоторых генов (DG76, DG81) сохраняется, тогда как у других (DG56 или DG21) он существенно изменяется. Если с помощью дот-блоттинга можно выявить временную специфичность экспрессии генов, то пространственную специфичность, т.е. тканеспецифический характер экспрессии генов, можно продемонстрировать с помощью модифицированного метода Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.106_______________ ГЛАВА 10_____________________________________________________________________________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ________________ 107 гибридизации in situ. Этот метод был использован для демонстрации тканеспецифичности экспрессии определенных генов у зародышей морского ежа (Lynn et al., 1983). ДНК морских ежей разрушали с помощью рестриктазы, и ее фрагменты встраивали в плазмиды. Было обнаружено, что некоторые из этих клонов содержат ДНК, которая гибридизуется исключительно с мРНК, изолированной из эктодермы зародыша морского ежа. Затем эти специфичные для эктодермы плазмиды метили радиоактивностью с помощью ник-трансляции. Полученную радиоактивную ДНК денатурировали до отдельных цепей и гибридизовали со срезами зародышей морских ежей. На рис. 10.35 показано, что радиоактивная ДНК этих плазмид узнает РНК только в тех клетках гаструлы, которые дают начало дорсальной эктодерме плутеуса. Эта ДНК узнает также дорсальную эктодерму самой личинки. Известно, что соответствующие РНК синтезируют набор кислых белков, характерных для эктодермы. Таким образом, мы можем использовать гибридизацию in situ для визуализации пространственного распределения дифференциального синтеза РНК. РЕЗЮМЕНа основе данных, представленных в этой главе, мы можем сделать следующие выводы: 1. В дифференцированных клетках большинства типов неиспользуемые гены сохраняются в форме, которая допускает их экспрессию при соответствующих условиях. 2. В особых случаях, таких, как образование плазматических клеток, клеточная дифференцировка сопровождается утратой генетического материала. (Даже в этих примерах утрата специфических последовательностей ДНК является следствием, а не причиной дифференцировки.) 3.Существуют виды мРНК. синтез которых регулируется в ходе развития. Можно сказать, что эта мРНК продуцируется только определенными клетками на определенных стадиях развития (это не означает, что все виды мРНК регулируются подобным образом или что все развитие определяется дифференциальной транскрипцией генов). В итоге мы получаем парадигму дифференциальной экспрессии генов: дифференцированные клетки содержат одни и те же гены, но экспрессия этих генов регулируется таким образом, что разные клетки синтезируют разные белки. В оставшихся главах этой части будут рассмотрены механизмы, с помощью которых дифференциальная экспрессия генов осуществляется во времени и пространстве. ЛИТЕРАТУРА Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.108_______________ ГЛАВА 10_____________________________________________________________________________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. |