Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.84________________ ГЛАВА 10__________________________________________________________
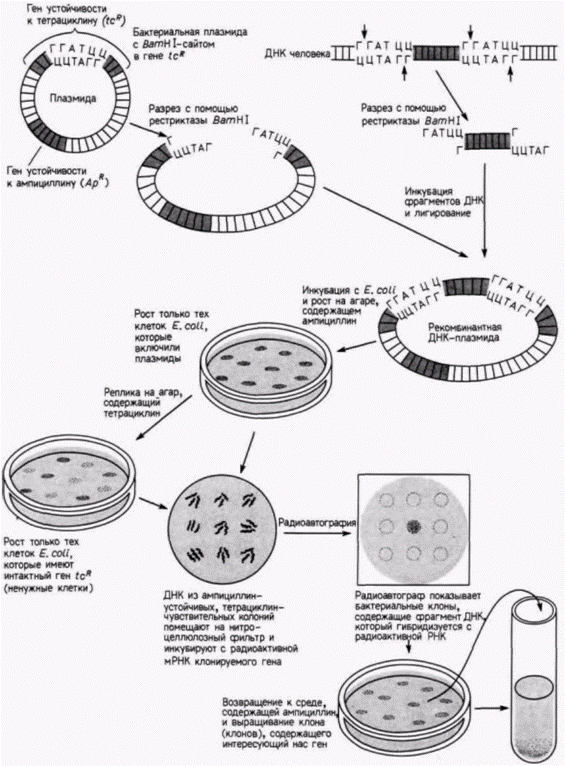
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 85 того чтобы выращивать бактерии в стандартных чашках Петри, колонии зачастую выращивают на подносах из кафетериев (Blattner et al., 1978; Slightom et al., 1980).] При альтернативном методе клонирования в качестве исходного материала используется цитоплазматическая РНК, а не геномная ДНК. Как показано на рис. 10.2. можно получить цепи ДНК, комплементарные цепям мРНК. На следующем этапе процедуры одноцепочечную ДНК с помощью ДНК-полимеразы можно перевести в двухцепочечную. Полученные цепи ДНК после присоединения к ним подходящих «концов» могут быть встроены в плазмиды. Пришивка фрагментов ГАТЦЦ/Г к срезанным концам фрагмента ДНК создает искусственный рестрикционный BamH1-сайт и позволяет фрагменту ДНК самостоятельно встроиться в плазмиду, разрезанную ферментом. Такие коллекции клонов, полученных из мРНК. называют обычно библиотеками. Можно, например, получить библиотеку для печени мыши, которая будет содержать гены, участвующие в синтезе белков печени. Можно также получить библиотеку для вегетативного полушария ооцита Xenopus, которая будет представлять мРНК, содержащуюся только в этой части клетки. Полученные подобным образом гены представляют значительный интерес, поскольку они не содержат интронов. После добавления к бактериальным клеткам эти гены могут транскрибироваться и затем транслироваться в кодируемые ими белки. Дополнительные сведения и гипотезы: Когда ген клонирован...... предстоит еще проделать большую работу. В последующих главах будет наглядно показано, что клонированные гены революционизировали наши представления о развитии. Некоторые методы использования рекомбинантных ДНК описаны ниже. СеквенированиеРезультаты секвенирования дают нам представление о структуре кодируемого белка и позволяют идентифицировать регуляторные последовательности ДНК, общие для ряда генов. (Например, в следующей главе мы увидим, что все гены, регулируемые гормоном прогестероном, содержат почти одинаковые последовательности ДНК вблизи начала участков, кодирующих белок.) Простота метода секвенирования с д2НТФ (Sanger et al., 1977) сделала этот метод обычным для многих молекулярно-биологических лабораторий. С использованием фага или плазмиды, несущих клонированный ген, выделяют одну цепь кольцевой ДНК (рис. 10.4). Затем гибридизуют радиоактивную ДНК-затравку (примерно из 20 нуклеотидов), которая комплементарна фаговой ДНК в области, непосредственно примыкающей к 5’-концу клонированного гена. (Так как эти последовательности известны, олигонуклеотидные затравки могут быть легко синтезированы или получены из коммерческих источников.) Затравка имеет свободный 3’-конец, к которому можно добавить дополнительные нуклеотиды. ДНК с затравкой и все четыре дезоксирибонуклеозидтрифосфата помешают в четыре пробирки. Каждая из пробирок содержит полимеризующую субъединицу ДНК-полимеразы и один из дидезоксирибонуклеозидтрифосфатов: одна пробирка содержит дидезокси-Г, другая - дидезокси-А и т. д. Структура дезокси- и дидезоксинуклеотидов представлена на рис. 10.5. Если дезоксинуклеотид лишен гидроксильной (ОН) группы при атоме углерода в 2-положении сахара, то дидезоксинуклеотид лишен гидроксильных групп при атомах углерода в двух положениях 2' и 3'. Поэтому, хотя дидезоксинуклеотид может присоединяться ДНК-полимеразой к растущей цепи ДНК, он останавливает дальнейший рост цепи, поскольку из-за отсутствия 3'-гидроксильной группы к нему не может присоединиться новый нуклеотид. Если ДНК-полимераза синтезирует ДНК от затравки, то новообразованная ДНК будет комплементарна клонированному гену. В пробирке с дидезокси-А каждый раз, когда ДНК-полимераза присоединяет А к растущей цепи, существует возможность, что вместо дезокси-А будет присоединен дидезокси-А. В том случае, когда это происходит, рост цепи останавливается. Аналогичным образом в пробирке с дидезокси-Г рост цепи с некоторой вероятностью останавливается каждый раз, когда присоединяется Г. (Все это напоминает греческий народный танец, где лишь небольшая группа из потенциальных танцоров одновременно участвуют в танце.) Поскольку в каждой пробирке синтезируются миллионы цепей, каждая пробирка будет содержать популяцию цепей, синтез которых остановлен в первом из возможных положений, в последнем и, наконец, в промежуточных положениях. Например, пробирка с дидезокси-А будет содержать |