Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 87
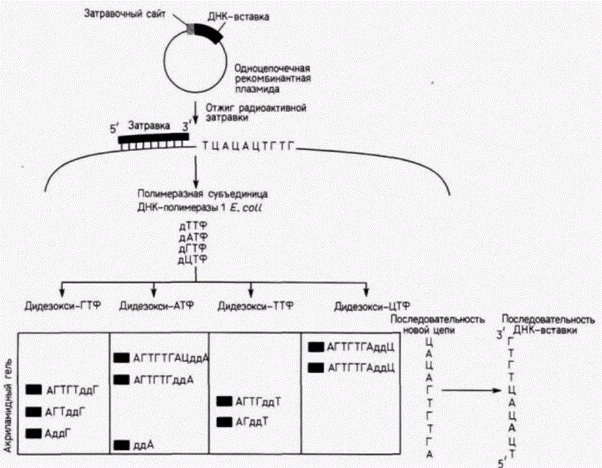
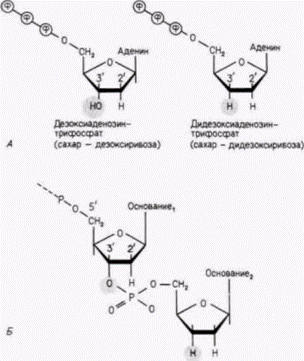
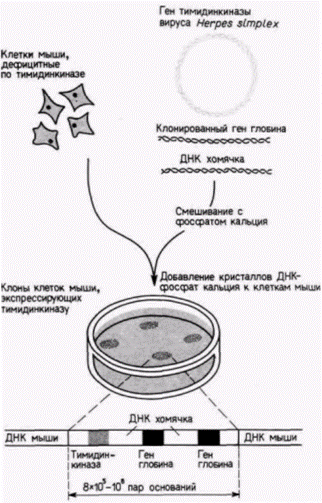
цепи различной дискретной длины, каждая из которых оканчивается остатком А. Полученные радиоактивные фрагменты ДНК разделяют с помощью электрофореза Смеси фрагментов вносят в лунки на одной стороне геля и затем пропускают через гель электрический ток. Отрицательно заряженные фрагменты ДНК мигрируют в направлении положительного полюса, при этом меньшие по размеру фрагменты движутся быстрее, чем крупные. Фрагменты с наименьшим числом нуклеотидов движутся быстрее, чем фрагменты с большим числом нуклеотидов (рис. 10.4 и 10.6). Прочитывая наборы полос, определяют последовательность ДНК, комплементарную клонированному гену. Перенос геновВо многих случаях желательно получить ген, модифицировать его и затем вернуть в эукариотический организм. Это осуществляется с помощью трансфекции - метода, посредством которого фрагменты ДНК можно ввести в хромосомную ДНК клетки. Клонированную ДНК смешивают с селективным маркерным геном (таким, как ген тимидинкиназы вируса Herpessimplex) и высокополимерной ДНК из какого-либо другого организма. Эту смесь инкубируют с фосфатом кальция: при этом образуются ДНК-содержащие кристаллы, которые фагоцитируются клетками в культуре. В случае дефицитных по тимидинкиназе клеток можно вырастить культуру в условиях, обеспечивающих выживание лишь тех клеток, которые захватили кристаллы ДНК–фосфат кальция (и потому экспрессируют ген тимидинкиназы) (Perucho et al., 1980; Robins et al., 1981). На рис. 10.7 показан опыт, в котором глобиновые гены человека смешивали с геном тимидинкиназы вируса Herpesи большими фрагментами ДНК хомячка. Селекция колоний на
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.88________________ ГЛАВА 10______________________________________________________________________________ присутствие тимидинкиназы выявила наличие в хромосоме мыши многочисленных глобиновых генов человека, чередующихся с ДНК хомячка (Watson et al., 1983). Недавно аналогичный метод был использован для переноса генов в стволовые клетки эмбриональной карциномы мыши. Эти стволовые клетки можно интегрировать в зародышей мыши, где из них впоследствии образуется часть тканей взрослой мыши (гл. 6). При последующем спаривании таких мышей новые гены могут попадать в каждую клетку их потомства (Gossler et al., 1986). Эффективность метода переноса с фосфатом кальция довольно низка, поэтому были разработаны другие методы. Один из них состоит в микроинъекции ДНК непосредственно в ядро (или пронуклеус) клетки (Capecchi, 1980; рис. 10.8). При хорошем навыке и специальном оборудовании можно инъецировать около 1000 клеток за час (в удачный день); при этом до 50% инъецированной ДНК интегрируется в хромосомы клеток. Этот метод был использован для введения генов ß-цепи глобина человека в зиготы мыши, дефицитные по ß-цепям. Развившиеся из этих зигот мыши имели функционирующие гены ß-цепи глобина человека, компенсировавшие генетическое заболевание (Constantini et al., 1986). Относительно новым методом является использование ретровирусных векторов. Ретровирусы это РНК-содержащие опухолеродные вирусы. Внутри клетки-хозяина они синтезируют свою ДНК-копию (используя собственную обратную транскриптазу): затем копия переводится в двухцепочечную форму и интегрируется в хромосому хозяина. Эта интеграция осуществляется благодаря присутствию двух идентичных последовательностей (длинных конце-
вых повторов) на концах ДНК. Ретровирусные векторы получены при помощи удаления генов, обеспечивающих упаковку вируса, из центральной части ретровируса мыши. Благодаря такому удалению создается свободный участок, куда можно поместить другие гены. Гены, которые были клонированы в плазмидах, могут быть выделены из них (с помощью подходящей рестриктазы) и встроены в ретровирусные векторы. Часть этого участка может быть занята селективным маркером (таким, как тимидинкиназа вируса Herpessimplex). Такие ретровирусные векторы инфицируют клетки мыши с эффективностью, достигающей 100%. Мышь со стабильными генами, полученными от других организмов (с помощью микроинъекции, вирусной инфекции или включения модифицированных стволовых клеток эмбриональной карциномы), называют трансгенной мышью. ДНК- и РНК-блоттингДНК-блоттинг (называемый также Саузерн-блоттингом или гибридизацией по Саузерну) представляет собой метод для выявления определенного гена (Sauthern, 1975) с последующим изучением его функций. С помощью ретровирусного вектора ген фактора, стимулирующего образование колоний гранулоцитов и макрофагов (КСФ-г,м). Вводили в клетки, которые в обычных условиях не синтезируют этот фактор, но чувствительны к нему ( Lang et al., 1985). Некоторые из клеток, обработанных рекомбинантным вирусом, начинали неконтролируемый рост, образуя после пересадки в мышь злокачественные опухоли. Получили ли все эти клетки дополнительные копии гена КСФ-г,м? Транскрибируют ли эти дополнительные гены мРНК для КСФ-г,м? На первый из этих вопросов ответ был получен с помощью ДНК-блоттинга. Ланг и его коллеги выделяли ДНК из клеток полученных злокачественных колоний и обрабатывали ее рестриктазой. Затем фрагменты ДНК разделяли с помощью электрофореза в геле. Помещая гель с фрагментами ДНК в раствор щелочи, добивались денатурации ДНК до отдельных цепей. После нейтрализации гель переносили на влажную фильтровальную бумагу на подложке из пластика (рис. 10.9). Нитроцеллюлозный фильтр (способный связывать одноцепочечную ДНК) помещали прямо на гель и накрывали его несколькими слоями бумажных полотенец. Края фильтровальной бумаги, лежащей под гелем, были опущены в сосуд с буфером высокой ионной силы. Буфер поднимался через гель и далее через нитроцеллюлозный фильтр и полотенца. При этом ДНК задерживалась на нитроцеллюлозном фильтре). После запекания ДНК на фильтре (иначе произойдет ее утечка) фрагменты |