Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ_________________ 91
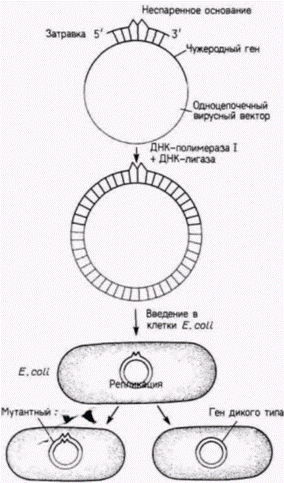
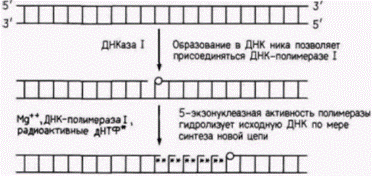
последовательность дикого типа, тогда как в половине плазмид возникает мутация с заменой одного основания (рис. 10.13). (Применив дополнительные генетические приемы, можно получить мутантных клонов больше, чем клонов дикого типа.) Мутантные клоны и клоны дикого типа различаются по эффективности гибридизации с точными копиями исследуемого участка (Gillam et al., 1980; Smith, 1985). Мутантный ген может быть изолирован из этих плазмид и транслирован в мутантный белок. Остается выяснить, функционирует ли этот белок, несмотря на замену определенной аминокислоты. При трансляции разрыва (ник-трансляции) также используют ДНК-полимеразу, но несколько иным образом. С помощью этого метода одну из цепей в клонированном гене можно заместить радиоактивными нуклеотидами, создавая таким образом высокорадиоактивные образцы для Саузерн-блотов, Нозерн-блотов и гибридизации in situ. Клонированный ген изолируют из плазмиды и обрабатывают ДНКазой I в низкой концентрации. Этот фермент надрезает ДНК в случайных местах, образуя свободные 3'-гидроксильные концы, к которым может присоединяться ДНК-полимераза I. Одна из особенностей ДНК-полимеразы I Е. coliзаключается в том, что она добавляет нуклеотиды на одном конце, одновременно удаляя нуклеотиды впереди разрыва (рис. 10.14). В результате происходит «движение» разрыва («трансляция ника») вдоль цепи ДНК (Kelly et al., 1970; Rigby et al., 1977). После замены исходных оснований на радиоактивные удельная радиоактивность фрагментов ДНК может превышать 108 имп/мин на 1 мкг ДНК. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.92________________ ГЛАВА 10________________________________________________________________________ Дифференциальная экспрессия геновБлагодаря разработке таких сложнейших биохимических методик стала возможна проверка гипотезы о дифференциальной экспрессии генов на молекулярном уровне; при этом следует выделить три постулата, которые необходимо подвергнуть проверке. 1. Ядро каждой клетки содержит полный геном, сформированный в оплодотворенном яйце. На молекулярном уровне это означает, что ДНК всех дифференцированных клеток идентична. 2. Неиспользуемые гены в дифференцированных клетках не разрушаются и не мутируют, они сохраняют способность к функционированию. 3. В каждой клетке экспрессируется лишь малая часть генома, при этом синтезируемая фракция РНК специфична для клеток данного типа.
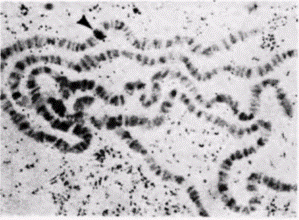
Идентичность геномовМы уже рассмотрели некоторые генетические и эмбриологические данные, свидетельствующие об идентичности геномов. Аналогичные данные были получены также в ряде биохимических работ с использованием гибридизации нуклеиновых кислот. Первое крупномасштабное молекулярное исследование идентичности ДНК в организме было выполнено в 1964 г. (McCarthy, Hoyer, 1964). Оказалось, что одноцепочечные ДНК, выделенные из мышиных клеток всех типов, с одинаковой эффективностью подавляют гибридизацию одноцепочечной ДНК с генами зародышей мыши. Это с достаточной убедительностью говорит о том, что ДНК в клетках всех типов одинакова по числу и типу последовательностей. Данные о присутствии в дифференцированных клетках определенных генов, которые не синтезируют специфический для них продукт, были получены с помощью метода, названного гибридизацией in situ (Mary Lou Pardue, Gall, 1970). Гибридизация in situ проводится с политенными хромосомами, денатурированными таким образом, что цепи множественных спиралей ДНК уже разделены, однако хромосомы все еще видны на препаратах. Радиоактивную РНК или кДНК добавляют к денатурированной ДНК и затем после соответствующего периода инкубации препарат отмывают. В ходе инкубации РНК способна связаться с кодирующими ее участками ДНК. После промывки препараты покрывают прозрачной фотографической эмульсией. Радиоактивность связанной РНК сенсибилизирует зерна серебра в эмульсии, которые при проявлении эмульсии образуют черные точки над соответствующим диском хромосомы. Следовательно, с помощью РНК для определенного продукта можно выявить диск, в котором она синтезируется. На рис. 10.15 приведен радиоавтограф, который показывает локализацию генов для одного из желточных белков у дрозофилы. ДНК дрозофилы была клонирована и скринирована с помощью частично очищенной мРНК к этому белку; было обнаружено несколько клонов, ДНК которых обладала способностью направлять синтез желточного белка. Эти клоны были выращены и гены желточного белка выделены. Один из этих клонов был использован для получения радиоактивного зонда, который гибридизовали с препаратами политенных хромосом из клеток слюнных желез. Как видно из рисунка, полученная кДНК связывается с одним определенным диском. Однако слюнные железы не синтезируют данный белок. Единственными клетками, синтезирующими желточные белки в норме, являются ооциты и клетки жирового тела взрослой самки. Таким образом, было показано, что ген, активный исключительно в клетках жирового тела взрослой особи и в ооцитах, присутствует в хромосомах слюнных желез личинки. Стабильность геновОказалось возможным показать также, что гены, неиспользуемые в дифференцированных клетках, при определенных условиях могут быть активиро- |