Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 89
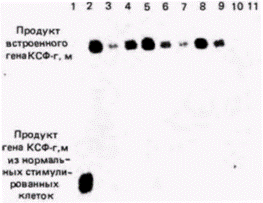
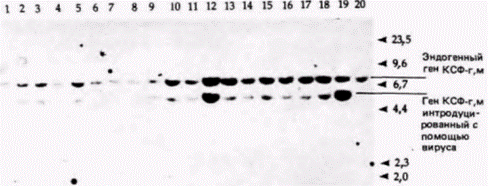
ДНК инкубировали с радиоактивной кДНК к соответствующему гену (можно использовать также и мРНК). Радиоавтограф нитроцеллюлозного фильтра показал, где радиоактивная ДНК нашла себе комплементарную ДНК. В итоге Лaнг с коллегами показали (рис. 10.10), что помимо двух обычных генов мыши, продуцирующих КСФ-г,м и расположенных в рестрикционном фрагменте длиной 7800 пар оснований, злокачественные клетки имеют ген КСФ-г,м, полученный от вируса (о чем свидетельствует наличие последовательностей вирусной ДНК) и лежащий в рестрикционном фрагменте длиной 5500 пар оснований. Для каждого из клонов злокачественных клеток был получен аналогичный результат. Экспрессию этих генов можно продемонстрировать с помощью РНК-блота (обычно называемого Нозерн-блотом). В отличие от Саузерн-блота, при котором из геля на бумагу переносят ДНК, при Нозерн-блоте (название не связано с фамилией исследователя) аналогичным образом из геля на бумагу переносят РНК. Нозерн-блоты весьма полезны при изучении накопления специфических мРНК в цитоплазме определенной клетки. В данном случае цитоплазматическую РНК изолируют из злокачественных клеток, инфицированных ретровирусом, содержащим ген КСФ-г,м, и из незлокачественных клеток, инфицированных аналогичным ретровирусом, но лишенным гена КСФ-г,м. РНК из каждого клеточного клона фракционировали в геле и переносили на нитроцеллюлозный фильтр. После инкубации фильтра с кДНК к гену КСФ-г,м было обнаружено, что во всех злокачественных клонах транскрибируется ген КСФ-г,м. Другие клетки его не транскрибируют (рис. 10.11). Ланг с соавторами пришли к выводу, что в клетках транскрибируется искусственно выделенный ген КСФ-г,м, находящийся под контролем вируса. Далее оказалось, что эти клетки, которым требуется КСФ-г,м для роста, приобрели способность синтезировать свой собст-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.90 ГЛАВА 10
венный КСФ-г,м. Таким образом, они стимулируют себя к непрерывному делению, образуя в конечном счете опухоли. [Это наблюдение подтверждало гипотезу Тодаро и др. (Todaro et al., 1977), которые предсказали подобный феномен в 1977 г. Эти опыты по индукции опухолей будут подробно рассматриваться в гл. 20.] Одним из важных применений Нозерн-блота является определение времени начала экспрессии какого-либо конкретного гена. Исследователь может выделить препараты РНК из зародышей на различных стадиях развития и разделить их с помощью электрофореза на параллельных дорожках геля. После переноса расфракционированной РНК на нитроцеллюлозный фильтр методом блоттинга фильтр со связанной РНК инкубируют в растворе, содержащем радиоактивный одноцепочечный фрагмент ДНК исследуемого гена. Эта ДНК будет связываться только с теми участками, где находится комплементарная РНК. Таким образом, если мРНК для данного гена присутствует на определенной стадии эмбриогенеза, то радиоактивная ДНК должна связываться с ней и ее можно зарегистрировать с помощью радиоавтографии. Радиоавтографы этого типа называют Нозерн-блотами развития. На рис. 10.12 показан Нозерн-блот развития для экспрессии гена алкогольдегидрогеназы у Drosophila. Можно видеть, что мРНК для этого белка синтезируется на всех стадиях зародышевого развития, кроме стадии куколки, и у взрослой особи (Savakis, Ashburner, 1985). Сайт-специфичный мутагенез и трансляция разрываОдно из наиболее продуктивных приложений методик с использованием рекомбинантных ДНК связано с возможностью изменить конкретный нуклеотид в клонированном гене и затем выяснить, влияет ли это изменение на функционирование гена. Специфическое мутирование осуществляется с помощью олигонуклеотид-направленного сайт-специфичного мутагенеза. Для этого сначала определяют последовательность ДНК и искусственно синтезируют олигонуклеотид. который имеет правильную последовательность, за исключением одной (или нескольких) замен. Затем этот олигонуклеотид длиной от 12 до 15 пар оснований смешивают с одноцепочечной рекомбинантной плазмидой, содержащей последовательности кДНК к гену дикого типа. Олигонуклеотид будет гибридизоваться с плазмидой, несмотря на то что одна из его пар оснований некомплементарна. Модифицированный олигонуклеотид можно затем использовать в качестве затравки для репликации оставшейся части плазмиды и клонированной ДНК с помощью ДНК-полимеразы 1 Е. coli. Далее концы отреплицированных плазмид связываются ковалентно с помощью ДНКлигазы и плазмиды вводятся в клетки Е. coli. Половина реплицирующихся плазмид восстанавливает |

 •
•