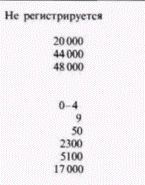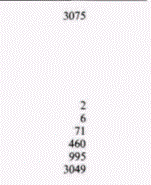Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
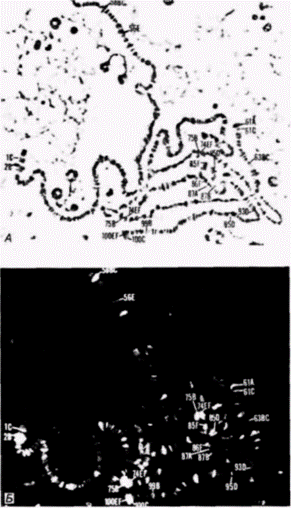
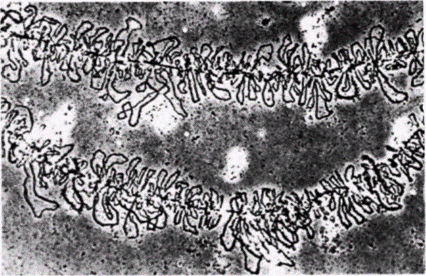
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.122____________ ГЛАВА 11_______________________________________________________ того, они, по-видимому, синтезируют продукты, которые необходимы для индукции поздних пуфов. Если к культивируемым клеткам дрозофилы добавить ингибиторы синтеза белка вскоре после того, как образовались ранние пуфы, то экдистерон не будет стимулировать формирование поздних пуфов. Очевидно, таким образом, что для образования поздних пуфов требуются и экдистерон, и продукты ранних пуфов (Ashburner, 1974). Важно отметить, что экдистерон не только стимулирует образование пуфов в определенных участках хромосом личинки, но вызывает также регрессию некоторых уже существующих пуфов. Один из таких пуфов находится в положении 68С на левом плече хромосомы III. Этот сайт содержит ген для Sgs 3, «белка клея», обеспечивающего прикрепление оболочки куколки к твердой поверхности (Korge, 1975). У личинок последнего возраста этот участок хромосомы образует пуф только в слюнных железах. Добавление экдистерона к культивируемым слюнным железам вызывает быструю регрессию этого пуфа и прекращение транскрипции с данного гена (Crowley, Meyerowitz, 1984). Таким образом. белок клея может синтезироваться, когда он нужен для прикрепления личинки к субстрату, но после этого ген выключается и происходит метаморфоз. Как будет рассмотрено более подробно в следующей главе, транскрипционная активность связана с изменениями в хроматине, и эти изменения могут быть вызваны присоединением негистоновых белков хроматина. Переваривание хроматина дрозофилы ДНКазой I приводит к высвобождению белка с молекулярной массой 63000, который связывается со всеми экдизон-чувствительными локусами личинки третьего возраста (рис. 11.17). Хотя этот белок по своим размерам больше, чем белки, предположительно отвечающие за активацию транскрипции генов у позвоночных, он может выполнять аналогичную функцию в установлении и поддержании структуры хроматина, необходимой для активности генов (Mayfield et al., 1978). Пуфы представляют собой расплетенную ДНК в определенных областях хромосом личинок насекомых. Так как эти хромосомы политенные, характерный вид пуфа создается тысячами нитей. Аналогичное расплетание ДНК в случае неполитенных хромосом наблюдается в ооцитах амфибий. Соответствующие структуры называют хромосомами типа ламповых щеток. На стадии диплотены мейоза компактные хромосомы амфибий образуют большие петли ДНК и втягивают их обратно после завершения этой стадии (рис. 11.18). Представление о том, что подобное расплетание хромосом позволяет экспрессироваться определенным генам, может быть подтверждено с помощью гибридизации in situ. Для этого следует приготовить препараты хромосом ооцитов, денатурировать их и проинкубировать с радиоактивной РНК, которая кодирует определенный белок. После того как несвязавшаяся РНК удалена отмывкой, радиоавтография позволяет точно определить местоположение гена. На рис. 11.19 показана хромосома I на стадии диплотены из ооцита тритона Trituruscristatusпосле инкубации с радиоактивной мРНК для
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 123
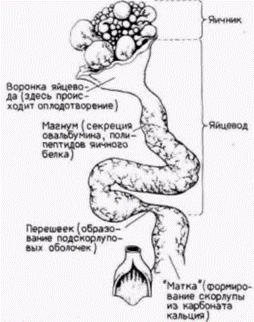
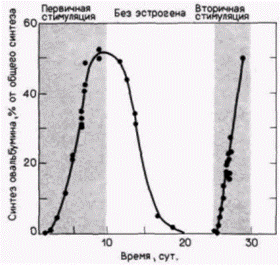
гистонов Очевидно, что ген гистона (или набор гистоновых генов) локализован на одной из петель хромосомы типа ламповой щетки (Old et al., 1977). На электронной микрофотографии транскрипты генов на хромосомах типа ламповых щеток очень напоминают транскрипты на амплифицированных генах рибосомной РНК. Та же полярность «рождественской елки», но обычно (за исключением семейств, подобных гистоновым генам) на каждой петле имеется только одна транскрипционная единица (Hill, MacGregor, 1980). Синтез овальбуминаОгромное яйцо курицы защищено многими дополнительными слоями, которые секретируются на его поверхность при прохождении яйца через яйцевод (рис. 11.20). Овулировавшее яйцо попадает в воронку левого яйцевода (правый яйцевод атрофируется у большинства птиц), где вскоре и происходит оплодотворение. Затем яйцо проходит в магнум, где секретируется овальбумин и другие полипептиды яичного белка, в перешеек, где оно одевается несколькими оболочками, и наконец, в матку, где добавляются вода, соли и скорлупа из углекислого кальция. Основным продуктом клеток стенки магнума является овальбумин, и у кур-несушек овальбумин составляет более 50% белков клеток стенки. Продукция овальбумина зависит от присутствия полового гормона эстрогена. Эстроген проникает в клетку и захватывается белком-рецептором, который доставляет его в ядро. Комплекс эстроген рецептор проходит через ядерную мембрану и связывается с хроматином, где стимулирует транскрипцию. Зависимость синтеза овальбумина от присутствия эстрогена наглядно показана в опыте, когда эстроген был инъецирован молодым курам (Palmi- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.124_______________ ГЛАВА 11______________________________________________________________________________
ter, Schimke, 1973). Эти инъекции вызывают дифференцировку пристеночных желез магнума и индуцируют синтез основных полипептидов яичного белка: овальбумина, кональбумина, овомукоида и лизоцима. За 2 нед обработки эстрогеном уровень овальбумина поднимается с исчезающе малых количеств до более чем 50% всех новосинтезированных клеточных белков (рис. 11.21). Удаление эстрогена вызывает снижение синтеза овальбумина, несмотря на то что клетки сохраняют свое дифференцированное состояние. Через две недели после удаления эстрогена зарегистрировать наличие овальбумина не удавалось. Этот опыт показывает только то, что синтез овальбумина зависит от присутствия гормона. Он не говорит нам о том, какова рабочая концентрация этого гормона. Можно представить, что гормон или усиливает транскрипцию, или стабилизирует полипептид овальбумина или его мРНК, или даже способствует транспорту овальбуминовой мРНК через
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 125
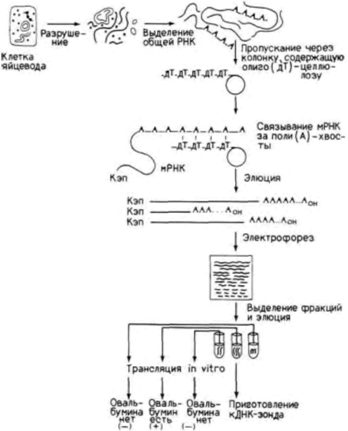
ядерную мембрану. На следующем этапе следовало найти корреляцию между уровнем эстрогена и присутствием овальбуминовой мРНК (Harris et al., 1975; McKnight, Palmiter, 1979). Чтобы осуществить это, на изолированной овальбуминовой мРНК была получена комплементарная ДНК. Овальбуминовую мРНК получали, пропуская цитоплазматическую мРНК из клеток яйцевода через колонку, содержавшую гранулы олиго(дТ)-целлюлозы (рис. 11.22). Эти гранулы связывают мРНК, поскольку цепи из дезокситимидина на гранулах присоединяют поли(А)-хвосты молекул мРНК. Все другие нуклеиновые кислоты проходят через колонку свободно. Связавшуюся мРНК затем удаляли с колонки и разделяли на фракции с помощью электрофореза. Овальбуминовую мРНК можно легко выделить (так как она преобладает среди мРНК клетки) и затем транслировать in vitro для подтверждения того, что она кодирует овальбумин. Далее овальбуминовую мРНК использовали как матрицу для обратной транскриптазы и получали кДНК-зонд. Этот зонд позволяет «выловить» любую комплементарную последовательность и может зарегистрировать единичную копию гена овальбумина. Данные табл. 11.2. А показывают, что обработка эстрогеном индуцирует образование овальбуминовой мРНК. Не менее важны другие опыты с использованием кДНК-зонда, в которых было показано, что эстроген стимулирует появление последовательностей, кодирующих овальбумин, в ядре (Roop et al., 1978; табл. 11.2. Б). Таким образом, синтез овальбумина в клетках стенки магнума регулируется в первую очередь на уровне транскрипции гена. Транскрипция глобиновых геновОдним из хорошо документированных случаев регуляции дифференцировки на уровне транскрипции является активация глобинового гена в дифференцирующихся эритроцитах. У куриных зародышей и зародышей человека в процессе развития наблюдаются изменения в синтезе гемоглобина. На примере куриных эритробластов можно проследить за наиболее ранней транскрипцией гемоглобина. В выделенной из куриного зародыша в возрасте от 20 до 23 ч задней части темного поля наблюдаются Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.126_______________ ГЛАВА 11_______________________________________________________________________________
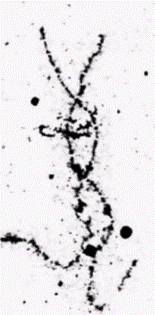
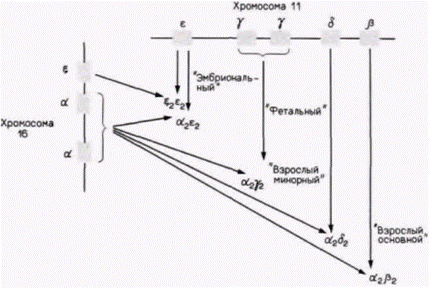
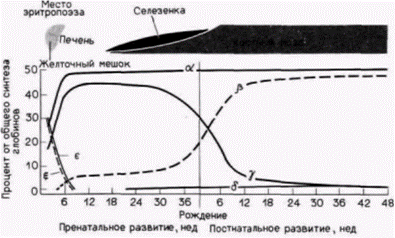
кровяные островки, содержащие предшественники эритроцитов. Зонды комплементарной ДНК к глобиновым мРНК показывают, что эти клетки-предшественники еще не транскрибируют глобиновые гены. Однако после двух последующих клеточных делений (35 ч развития) клетки (теперь называемые эритробластами) активно синтезируют гемоглобин. В течение этого периода происходит включение глобиновых генов; каким образом включаются эти гены, остается, правда, пока неясным. Другой тип регуляции на уровне транскрипции осуществляется на более поздних стадиях развития. У многих видов, включая курицу и человека, эмбриональный и фетальный гемоглобины отличаются от гемоглобина взрослых особей. Схематическая диаграмма типов гемоглобинов человека и генов, которые их кодируют, показана на рис. 11.23. Эмбриональный гемоглобин человека состоит в основном из двух дзета(ζ)-цепей глобина, двух эпсилон(ε)-цепей и четырех молекул гема. В течение второго месяца беременности синтез ζ- и ε-цепей внезапно прекращается, тогда как синтез альфа(α)и гамма(γ)-цепей глобина усиливается (рис. 11.24). Объединение двух γ-цепей с двумя α-цепями образует фетальный гемоглобин. На третьем месяце беременности активируются гены бета(ß)- и дельта(δ)цепей глобина, концентрация этих продуктов медленно возрастает, тогда как концентрация γ-цепей постепенно снижается. Это переключение существенно ускоряется после рождения, и фетальный гемоглобин заменяется на гемоглобин взрослых, α2β2. Гемоглобин взрослых людей в норме состоит на 97% из α2β2, на 2-3% из α2δ2 и на 1% из α2γ2. У человека гены ζ- и α-цепей глобина расположе-
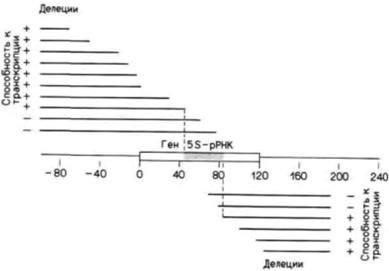
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 127 ны в хромосоме 16, а гены ε-, γ-, δ- и β-цепей сцеплены вместе в соответствии с порядком их активации на хромосоме 11. Таким образом, представляется вероятным, что существует некий механизм, управляющий последовательным переключением генов на хромосоме 11 от генов эмбриональных глобинов к фетальным и, далее, к взрослым. Этот механизм до сих пор неизвестен, но один подход к его выявлению описан. У некоторых людей, хотя и совершенно здоровых, синтез фетального гемоглобина не выключается. В таких случаях у взрослых гены γ-цепей глобина продолжают оставаться активными, а гены ß-цепей все еще не включены. В некоторых работах авторы высказывают предположение (см. Jagadeeswaran et al., 1982), что в переключении генов участвуют нуклеотиды, лежащие между генами γ- и δ-цепей глобина. Другой недавно описанный подход связан с тем. что переключение от фетальных глобинов к взрослым глобинам происходит в одной линии клеток. Предшественники клеток крови, изолированные из желточных мешков эмбрионов человека, образуют эритроциты, содержащие цепи эмбрионального гемоглобина, а также последующие стволовые клетки. Потомство этих стволовых клеток дает начало эритроцитам, содержащим цепи фетальных, а позже взрослых глобинов (Stamatoyannopoulos et al., 1987). Это было показано также с помощью метода слияния клеток, когда фетальные эритробласты человека (предшественники эритроцитов, активно синтезирующие глобины) сливали с клетками эритробластомы мыши. Вначале эти гибридные клетки синтезировали фетальный гемоглобин человека. Однако при последующих делениях в них начинали синтезироваться цепи взрослых глобинов. Эритробласты человека, полученные от плода в возрасте 15-20 нед, начинали этот переход быстрое, чем эритробласты от плода в возрасте 8-10 нед, что указывает на наличие в эритробластах наследуемых «часов», которые регулируют переход от продукции фетальных глобинов к продукции взрослых глобинов (Papayannopoulou et al., 1986). Белок-регулятор транскрипции: контроль генов 5S-рРНКЦентральный промоторный элементНа протяжении всего развития активность гена 5S-pPHK регулируется на уровне транскрипции. В гаплоидном геноме имеется 20 000 «ооцитных» 5S-генов и 400 «соматических» 5S-генов, и все они транскрибируются в течение раннего оогенеза. В позднем оогенезе все 5S-гены выключены вплоть до перехода к средней бластуле. На стадии средней бластулы экспрессируются и ооцитные, и соматические 5S-гены, но к концу стадии бластулы активны только соматические 5S-гены. РНК-полимераза III, контролирующая транскрипцию генов 5S-рРНК, имеет уникальный промотор. Если промоторы для РНК-полимераз I и II лежат в участках, фланкирующих гены с 5'-стороны (как у бактерий), то промоторы для РНК-полимеразы III находятся в центре гена. Это было показано с помощью введения делеций в различные области внутри и вокруг генов 5S-pPHK y Xenopusи последующего анализа уровня транскрипции полученных генов в смесях, содержащих рибонуклеотиды. РНК-полимеразу III и экстракты ядер. Правильная транскрипция продолжалась даже после ферментативного удаления 5’- и 3'-фланкирующих участков гена 5S-pPHK (рис. 11.25). Транскрипция прекращалась только тогда, когда удаляли нуклеотиды из положений от 50 до 83 (Sakonju et al., 1980; Bogenhagen et al., 1980). Кроме того, оказалось, что эти нуклеотиды образуют консервативный участок в генах, которые транскрибируются РНК-полимеразой III. Последовательность АГЦАГГГТ обнаружена в положении 55-62 в гене 5S-pPHK у Xenopus, похожие последовательности (с заменой не более двух пар оснований) обнаружены внутри гена тирозиновой тРНК у Bombyx mori (шелкопряд) и гена VA-I аденовирусов. Регуляция транскрипции фактором TFIIIAВ отличие от РНК-полимеразы бактерий РНК-полимеразы из клеток эукариот не присоединяются непосредственно к ДНК. Их связывание с промотором опосредовано особыми белками. Если гены 5S-pPHK, выделенные из клеток Xenopus laevis, инкубировать с РНК-полимеразой III, то правильной транскрипции генов не происходит. Однако правильная транскрипция наблюдается в случаях, когда используется хроматин, содержащий ген 5S-pPHK, или гены 5S-pPHK инкубируют в ядерном экстракте. Имеется белок с молекулярной массой 38 500 дальтон, который связывается с контролирующей областью гена 5S-pPHK и регулирует присоединение РНК-полимеразы III (Ng et al., 1979; Engelke et al., 1980). В отсутствие этого белка ген 5S-pPHK не активен. Этот белок, названный TFIIIA (т.е. первый транскрипционный фактор для РНК-полимеразы III), специфичен для гена 5S-pPHK (он не связывается с промоторами других генов, зависимых от РНК-полимеразы III), и его синтез регулируется в процессе развития. Он в огромном количестве присутствует в раннем оогенезе, когда синтезируется чрезвычайно много 5S-pPHK, но его концентрация падает до крайне низкого уровня в зрелых ооцитах (Ginsburg et al., 1984). Связь TFIIIA с внут- Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.128_______________ ГЛАВА 11______________________________________________________________________________
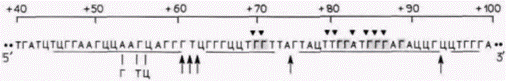
ренним промотором генов 5S-pPHK дополнительно стабилизируется двумя неспецифическими факторами TFIIIC и TFIIIB (Lasser et al., 1983; Pieler et al., 1987). Транскрипция начинается после того, как к этому комплексу присоединяется РНК-полимераза III. Кроме того, оказалось, что тип и количество 5S-pPHK зависят от концентрации TFIIIA в ядре. Каким образом осуществляется этот контроль? Браун и Шлиссель (Brown, Schlissel, 1985) инъецировали клонированные ооцитные и соматические гены 5S-pPHK в ооциты и ядра клеток бластулы; оказалось, что TFIIIA имеет существенно более высокое (более чем в 200 раз) сродство к контролирующей области соматических генов 5S-pPHK, чем к контролирующей области ооцитных генов. Это свойство означает, что при низких концентрациях фактора среди генов, связывающих TFIIIA, практически вес будут генами соматического типа, но при более высоких концентрациях фактора станут активироваться также и ооцитные гены 5S-pPHK. Инъекция очищенного TFIIIA в зародыши на стадии поздней бластулы (где активны только соматические гены 5S-pPHK) приводила к активации также ооцитных 5S-генов. Связывание и функция TFIIIAСайты связывания TFIIIA в гене 5S-pPHK были определены с помощью мутационного анализа, картирования (футпринтинга) ДНКазой I, метилирования гуанозинов и блокирования фосфатов (Sakonju, Brown, 1982; Pieler et al., 1985). По результатам мутационного анализа были установлены три Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ___________________________________ 129
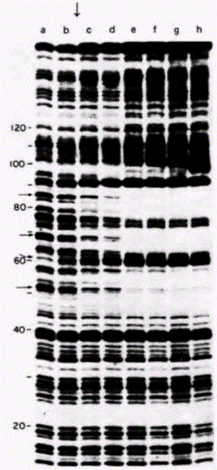
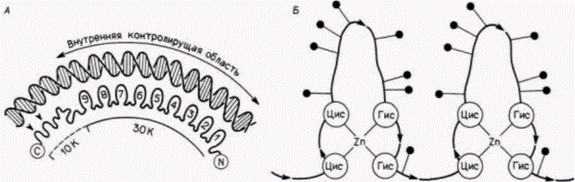
участка, необходимые для правильной транскрипции: нуклеотиды в положениях 50-61, 70-71 и 80-89. Последовательность нуклеотидов 50-61 обнаружена во всех других генах, транскрибируемых РНК-полимеразой III. В этом консервативном участке соматический 5S-ген отличается от ооцитного 5S-гена, и это различие, как полагают, обеспечивает разное сродство этих двух генов к TFIIIA. «Футпринтинг» ДНКазой 1 осуществляется путем присоединения белка (в данном случае TFIIIA) к радиоактивной ДНК и последующего переваривания ДНК с помощью этой относительно неспецифической ДНКазы. Полученную ДНК вносят в гель и разделяют электрофорезом, как при секвенировании. При этом получают ожидаемую олигонуклеотидную «лестницу», характерную для секвенирующих гелей, где каждый олигонуклеотид на одно основание короче, чем олигонуклеотид, лежащий выше его. Однако в тех участках, где ДНК защищена белком от гидролиза ДНКазой, соответствующие олигонуклеотиды отсутствуют. Результат такого опыта в случае связывания TFIIIA с геном 5S-PHK из ооцита Xenopusпредставлен на рис. 11.26. Отчетливо видны три сайта связывания. Можно выяснить, меняется ли данный характер защиты нуклеотидов в ДНК при модификации остатков гуанозина (метилированием) или фосфатных групп (этилированием). Метилирование определенных групп гуанозинов (70 и 71; 80-89) и этилирование определенных групп фосфатов (70 и 71; 80-87) подавляет связывание TFIIIA и предотвращает защиту этим белком указанных участков ДНК. Эти данные суммированы на рис. 11.27; они выявляют три сайта связывания TFIIIA на гене 5S-PHK. Если в SS-промоторе присутствуют три основных участка связывания TFIIIA, то в белке TFIIIA имеются девять доменов, связывающих ДНК. Каждый из этих «ДНК-связывающих пальцев» представляет собой глобулярный домен, в центре которого находятся преимущественно основные аминокислоты. Эти домены соединены друг с другом тандемно. и каждый стабилизирован ионом цинка, расположенным в центре домена (рис. 11.28). Предполагается, что такое строение позволяет TFIIIA удерживаться на гене при движении по нему РНК полимеразы (Miller et al., 1985). Если одни из связывающих доменов открепляются, то прикрепление к ДНК будут обеспечивать другие домены. Какая из функций TFIIIA делает его необходимым для транскрипции? Группой исследователей (Kmiec, Worcel, 1985; Kmiec et al., 1986) было высказано предположение, что роль TFIIIA заключается
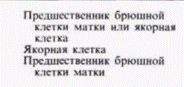
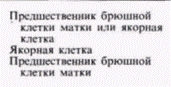
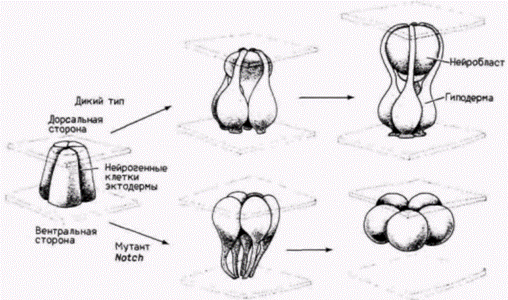
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.130_______________ ГЛАВА 11_______________________________________________________________________________ в индукции изгибов ДНК, вызывающих расхождение двух нитей спирали. Белок TFIIIA вызывает, по-видимому, изменение конформации гена 5S-pPHK. когда их добавляют друг к другу в присутствии ядерного экстракта. Хотя эти данные противоречивы (Wolffe et al., 1987), они привлекают внимание к интересному направлению в исследованиях регуляции транскрипции генов 5S-PHK. Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клетокДо сих пор при обсуждении контроля на уровне транскрипции мы рассматривали те гены, продукты которых являются следствием дифференцировки, а не их причиной. Синтез глобинов, например, не является последней стадией в дифференцировке эритроцитов. Существуют ли случаи, когда транскрипция способна заставить клетку стать клеткой крови вместо того, чтобы стать клеткой кости? Могут ли гены, активные на ранних этапах развития, определять судьбу клетки? В 1940 г. Уоддингтон, один из наиболее прозорливых теоретиков биологии развития, предсказал существование «генов-переключателей». Эти гены, по его словам, могут работать как стрелки на сортировочной станции, которые определяют, по какому нуги следовать поезду (рис. 11.29). Такие гены могли бы обеспечивать тем или иным способом активацию батареи генов для какого-то одного пути развития, а не для другого, альтернативного. Недавно была открыта группа генов, которые имеют свойства таких «генов-переключателей». Клетки, в которых экспрессируются гены-переключатели, имеют возможность дать потомство одного из двух клеточных типов, и наличие или отсутствие продуктов этого гена определяет, какое потомство будут генерировать эти клетки. Локус lin-12 у круглого червя Caenorhabditiselegans контролирует два альтернативных клеточных типа (Greenwald et al., 1983). У зародышей дикого типа имеются две соседние клетки, Zl.ppp и Z4.aaa, которые взаимодействуют друг с другом (Kimble, 1981). Любая из этих клеток может дать начало якорной клетке матки (ас), тогда как другая клетка будет формировать предшественник брюшной клетки матки (vu). У мутантов, рецессивных по локусу lin-12, соответствующий ген не транскрибируется. Обе клетки становятся якорными клетками. У мутантов, доминантных по этому локусу, у которых уровень транскрипции lin-12 очень высок, обе клетки становятся предшественниками брюшных клеток матки (табл. 11.3). Ген lin-12 контролирует, по-видимому, бинарное переключение с одного альтернативного пути развития на другой. Один из наиболее интересных аспектов функционирования гена lin-12 заключается в том, что он определяет один из двух путей развития для нескольких клеток в различных частях тела. Как указано в таблице, брюшные и спинные m(l/r)pa-клетки становятся соответственно половыми мезобластами и целомоцитами. В случае если в клетках произошла доминантная мутация по гену lin-12, обе клетки становятся половыми мезобластами; если же мутация оказывается рецессивной, то обе клетки становятся целомоцитами. Мутация Notchу дрозофилы также направляет бипотенциальную клетку по одному из двух альтернативных путей. В этом случае происходит выбор между клеткой кожи (гиподермы) или нейробластом. Вскоре после гаструляции зона приблизительно из 1800 эктодермальных клеток располагается по средней линии вдоль вентральной стороны зародыша дрозофилы. Эти клетки формируют брюш-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.___________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_________________________________________ 131
ную нервную цепочку насекомого, и примерно четверть из них становятся нейробластами, тогда как оставшиеся становятся предшественниками клеток гиподермы. Клетки, которые дают начало нейробластам, перемешаны с теми клетками, которым предопределено дать начало гиподермальным предшественникам. Таким образом, у зародыша дрозофилы каждая клетка эктодермы в области формирования нервной цепочки может дать начало предшественникам либо гиподермальных, либо нервных клеток (Hartenstein, Campos-Ortega, 1984). В отсутствие транскрипции гена Notchу зародыша клетки развиваются в предшественников нервных клеток, а не в смесь предшественников гиподермальных и нервных клеток (рис. 11.30; Lehmann et al., 1983; Artavanis-Tsakonis et al., 1983). Эти зародыши погибают из-за большого избытка нервных клеток и отсутствия брюшной и головной гиподермы (Poulson, 1937; Hoppe, Greenspan, 1986). Ген Notch был клонирован (Kidd et al., 1983; Yedvobnick et al., 1985), и было обнаружено, что он транскрибируется в течение первой половины эмбриогенеза (и позднее на стадии ранней куколки) (рис. 11.31). Последовательности обоих генов Notchи lin-12 – в значительной степени гомологичны последовательности фактора роста эпидермиса (ФРЭ) – важного регулятора роста клеток млекопитающих (гл. 20). N-концевая половина белкового продукта гена Notchсодержит 36 тандемных копий ФРЭ-подобных пептидных последовательностей, каждая
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.132_____________ ГЛАВА 11____________________________________________________________________________
из которых, как полагают, выпячивается из клеточной мембраны (Wharton el al., 1985). Сходным образом продукт гена lin-12 имеет по меньшей мере 11 ФРЭ-подобных повторов; полагают, что они также выступают за клеточную поверхность. Было высказано предположение, что многомерные ФРЭ-участки могут связывать клетки друг с другом и действовать как стимулятор митоза (Burgess, 1987). В случае мутантов Notch, у которых функция этого гена нарушена, такие агрегаты делящихся клеток не способны развиваться в клетки гиподермы, т.е. они будут предназначены для образования нейробластов. Если гены-переключатели lin-12 и Notchкодируют продукты, напоминающие связанные с мембраной факторы роста, то другой ген-переключатель – sevenless - кодирует белок, который похож на связанный с мембраной рецептор фактора роста. Этот ген активен в имагинальных дисках глаза у личинок последнего возраста дрозофилы (рис. 11.32). Он контролирует переключение, определяющее, какая клетка возникнет из клетки сетчатки: седьмой фоторецептор (ультрафиолетчувствительная нервная клетка) или ненейральная колбочка. Надлежащая транскрипция гена sevenlessнеобходима для коммитирования клетки к формированию этого нейрона, и в отсутствие полноценного функционирования гена sevenless все бипотенциальные клетки станут предшественниками колбочек (Banerjee et al., 1987; Hafen et al., 1987). Три описанных гена контролируют переключение развития, при котором бипотенциальной клетке разрешается следовать по одному из двух альтернативных путей дифференцировки. Во всех трех случаях межклеточные взаимодействия играют, по-видимому, критическую роль. Структура каждого из белковых продуктов этих генов свидетельствует о том, что этот продукт связан с мембраной и способен взаимодействовать с поверхностями других клеток. На повестке дня изучение механизмов, посредством которых такие взаимодействия контролируют судьбу клеток. Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegansВ гл. 7 мы отметили, что С. elegans был введен как экспериментальный объект, на котором исследования по биологии развития и генетике могут проводиться на одной особи одновременно. Такая программа начинает приносить плоды в изучении генетической регуляции детерминации клеток. Как отмечено ранее, индукционный сигнал для развития вульвы возникает в якорных клетках Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 133
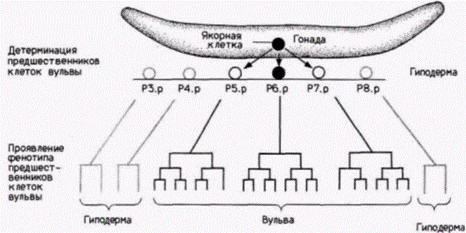
гонад. Этот сигнал (пока не идентифицирован, но полагают, что он представляет собой способную к диффузии молекулу) действует в зависимости от положения на шесть клеток (Р(3-8).р), способных формировать ткань вульвы (рис. 11.33). Клетка, ближайшая к якорной клетке (обычно Р6.р). стимулируется к трем симметричным циклам митоза для формирования клеток вульвы. Две клетки, лежащие по обе стороны от нее (Р5.р и Р7.р), подвергаются делению, незначительно отличающемуся от обычного; в результате также возникают клетки вульвы. Три других потенциальных предшественника не предназначаются для образования клеток вульвы: они делятся один раз и дают клетки, входящие в гиподерму нематоды. Обнаружено более двух десятков мутаций, нарушающих развитие вульвы. С помощью конструирования двойных мутантов, у которых один зародыш несет две отдельные мутации, влияющие на развитие вульвы, можно определить, какие гены активны ранее других, и, следовательно, постулировать генетическую программу. Возможность наблюдать деление каждой клетки, входящей в вульву, позволяет указать точное место, где данная мутация проявляется впервые, и установить соответствие между генетической программой и развитием (Ferguson et al., 1987). Первый набор генов в генетической программе и программе развития составляют те гены, которые контролируют образование предшественников клеток вульвы и якорной клетки. Как упоминалось ранее, ген lin-12 контролирует формирование якорной клетки таким образом, что у мутантов, доминантных по гену lin-12. она не образуется (оба возможных предшественника якорной клетки становятся клетками матки). В отсутствие якорной клетки возможные предшественники клеток вульвы делятся, чтобы образовать клетки гиподермы. Второй набор генов детерминирует дифференцировку предшественников клеток вульвы. У таких мутантов, как lin-12, все возможные предшественники клеток вульвы ведут себя подобно клеткам Р3.р, Р4.р и Р8.р. Иными словами, они все дают начало клеткам гиподермы, и вульвы не образуется. Напротив, у мутантов, подобных lin-15, все шесть клеток-предшественников ведут себя как предшественник Р6.р и формируют ткань вульвы. Эти мутанты имеют несколько вульв. Проявление этих мутаций детерминации не зависит от силы индукционного сигнала якорной клетки и определяется, очевидно, на уровне рецепции и ответа на этот сигнал. (До сих пор не обнаружены мутанты, у которых отсутствует сигнал якорных клеток, какой бы природы он ни был.) Третий набор генов отвечает за проявление детерминированного фенотипа. Три гена, lin-11. lin-17 и lin-18, контролируют, по-видимому, фенотип потомков клеток P5.p и Р7.р. влияя на направление, в котором следует делиться этим клеткам-предшественникам. В этих случаях дочерние клетки напоминают потомков Р6.р, а не потомков Р5.р или Р7.р. Такое изменение в характере деления может привести к распределению конкретных морфогенетических детерминантов по разным областям цитоплазмы. Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.134_______________ ГЛАВА 11_________________________________________________________ РЕЗЮМЕДифференциальная экспрессия генов может регулироваться на уровне транскрипции несколькими способами. Например, при гетерохроматизации значительные по размерам части хромосом могут стать генетически инертными: в случае глобиновых генов и генов овальбумина конкретный ген может быть активирован в клетке определенного типа и в определенное время. В некоторых случаях, когда требуются большие количества обычного продукта того или иного гена (как для рибосомных генов ооцитов амфибий), гены могут быть амплифицированы (для 40S-PHK) и могут синтезироваться позитивные транскрипционные факторы (TFIIIA для 5S-pPHK). Регуляция на уровне транскрипции может также определять судьбу клеток. Транскрипция таких «генов переключателей путей дифференцировки дочерних клеток» играет существенную роль в детерминации клеток. В этой главе мы увидели, что определенные гены находятся под дифференциальным контролем на уровне транскрипции Но как осуществляется эта регуляция? Молекулярные механизмы дифференциальной транскрипции генов будут рассмотрены в гл. 12. ЛИТЕРАТУРА  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.__________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ____________________________________ 135  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.136_______________ ГЛАВА 11________________________________________________________________________  Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||