Гилберт С. Биология развития. Т.2.doc ,БИР. Библиография Гилберт С. Биология развития в 3х т. Т. 2 Пер с англ. М. Мир, 1994. 235 с
 Скачать 19.05 Mb. Скачать 19.05 Mb.
|
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.142_______________ ГЛАВА 12_____________________________________________________________________________
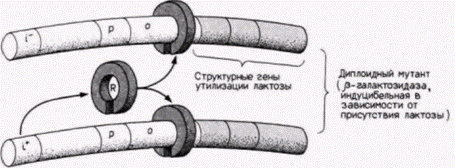
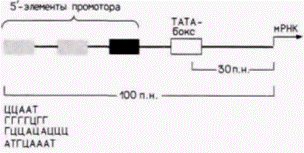
транскрипция, и длина их составляет приблизительно 100 пар оснований. Участок промотора необходим для присоединения РНК-полимеразы II и точной инициации транскрипции. Энхансер активирует утилизацию промотора, контролируя эффективность и скорость транскрипции с этого конкретного промотора. Энхансеры активируют только лежащие в цис-положении промоторы (т.е. промоторы на той же самой хромосоме), но они могут функционировать и на больших расстояниях. Кроме того, они могут находиться не только на 5'-стороне гена, но и на другой цепи ДНК (Maniatis et al., 1987). Промоторы генов, которые транскрибируют относительно большие количества мРНК, имеют сходную структуру. В них содержится последовательность АΤΑ (называемая иногда ТАТА-боксом или боксом Голдберга–Хогнесса), располагающаяся на расстоянии приблизительно 30 пар оснований с 5'-стороны от сайта, где начинается транскрипция, и один или несколько передних элементов промотора, лежащих еще дальше с 5'-стороны. Передний элемент промотора обычно представляет собой вариацию последовательности ЦААТ, но выявлены и другие промоторные элементы (Grosschedl, Birnstiel, 1980; McKnight, Tjian, 1986) (рис. 12.6). Впервые промотор β-глобинового гена исследовали в опытах по проверке специфической транскрипции клонированной ДНК. Клонированные гены могут транскрибироваться правильно, когда они введены в ядра ооцитов лягушки или фибробластов или когда они инкубируются с очищенной РНК-полимеразой в присутствии нуклеотидов надосадочной жидкости (Wasylyk et al., 1980). После того как транскрипция гена подтверждена, для получения специфических делений в этом гене или окружающих его участках используют рестриктазы. Затем можно выяснить, продолжает ли правильно транскрибироваться такой модифицированный ген. Результаты этих исследований показали, что для максимальной транскрипции ß-глобинового гена достаточно первых 109 пар оснований, предшествующих кэп-сайту (Grosveld et al., 1982; Dierks et al., 1983). Другие исследователи уточнили этот вывод с помощью клонирования участка глобинового гена мыши от 106-й пары оснований выше (с 5'-стороны) старта транскрипции (положение —106) вплоть до 475-й пары оснований (положение +475) в первом экзоне (Myers et al., 1986). Эти клоны были подвергнуты мутагенезу in vitro. Таким способом в область промотора глобинового гена было введено Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с.МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ 143
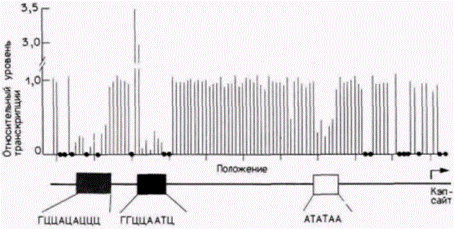
130 различных одиночных замен оснований. Полученные клонированные гены вводили в плазмиды, содержащие энхансер, и затем с помощью трансфекции – в культивируемые клетки, которые в обычных условиях не синтезируют глобин. Будут ли в таких клетках транскрибироваться усеченные глобиновые мРНК (475 оснований) с этих клонов? Результаты опытов показаны на рис. 12.7. В большинстве случаев мутации в 5'-фланкирующей области не влияли на эффективность транскрипции глобинового гена. Однако мутации в трех кластерах нуклеотидов резко снижали транскрипцию. Один кластер находился в ТАТА-боксе (боксе Голдберга–Хогнесса), другой – в переднем ЦАAT-элементе промотора, а третий – в участке ГЦЦАЦАЦЦЦ, от 95-й до 87-й пары оснований выше кэп-сайта.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||