БИЛЕТ №20 Катализаторы и их влияние на скорость реакции. Механизм их действия. Активированный комплекс и механизм его образования
Ферментативный катализ.Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ - катализаторов. Катализаторы участвуют в реакции, но в результате ее не расходуются. Катализаторы биологических процессов, протекающих в живых организмах, представляют собой белковые молекулы, которые называют ферментами, или энзимами
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (E) с реагирующим веществом (субстратом, S) и разрушение этого комплекса с образованием продуктов реакции (P):Применение квазиравновесного приближения к этой схеме (при условии k2 << k-1) с учетом уравнения материального баланса [E] = [E]0 - [ES] (индекс "0" обозначает начальную концентрацию) позволяет выразить скорость образования продукта через начальную концентрацию фермента и текущую концентрацию субстрата:
,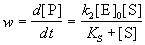 где KS = k-1 / k1 = [E]. [S] / [ES] - субстратная константа. При увеличении концентрации субстрата скорость реакции стремится к предельному значению: wmax = k2. [E]0. Скорость реакции связана с максимальной скоростью соотношением: где KS = k-1 / k1 = [E]. [S] / [ES] - субстратная константа. При увеличении концентрации субстрата скорость реакции стремится к предельному значению: wmax = k2. [E]0. Скорость реакции связана с максимальной скоростью соотношением:
. (7.1)Обычно в эксперименте измеряют зависимость начальной скорости ферментативной реакции от начальной концентрации субстрата: w0 = f([S]0). Проведение таких измерений для ряда начальных концентраций позволяет определить параметры уравнения (7.1) - KS и wmax.Чаще всего для анализа кинетических схем ферментативного катализа используют метод стационарных концентраций (k2 >> k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен:
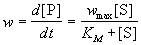 , (7.2)где wmax = k2. [E]0 - максимальная скорость реакции (при бесконечно большой концентрации субстрата),- константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1.У , (7.2)где wmax = k2. [E]0 - максимальная скорость реакции (при бесконечно большой концентрации субстрата),- константа Михаэлиса. Эта константа равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Типичные значения KM - от 10-6 до 10-1 моль/л. Константу скорости k2 иногда называют числом оборотов фермента. Она может изменяться в пределах от 10 до 108 мин-1.У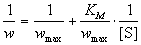 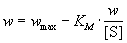 равнение (7.2) можно записать в других координатах, более удобных для обработки экспериментальных данных:(7.2а)(координаты Лайнуивера-Берка) или . (7.2б)Для определения параметров KM и wmax по уравнениям (7.2а) и (7.2б) проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 ё 1/[S]0 или w0 ё w0/[S]0.Иногда течение ферментативной реакции осложняется присутствием ингибиторов - веществ, способных образовывать комплексы с ферментом или фермент-субстратным комплексом. Различают конкурентное, неконкурентное и смешанное ингибирование.При конкурентном механизме ингибитор (I) конкурирует с субстратом за активные участки фермента. Простейшая кинетическая схема данного процесса имеет вид: равнение (7.2) можно записать в других координатах, более удобных для обработки экспериментальных данных:(7.2а)(координаты Лайнуивера-Берка) или . (7.2б)Для определения параметров KM и wmax по уравнениям (7.2а) и (7.2б) проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 ё 1/[S]0 или w0 ё w0/[S]0.Иногда течение ферментативной реакции осложняется присутствием ингибиторов - веществ, способных образовывать комплексы с ферментом или фермент-субстратным комплексом. Различают конкурентное, неконкурентное и смешанное ингибирование.При конкурентном механизме ингибитор (I) конкурирует с субстратом за активные участки фермента. Простейшая кинетическая схема данного процесса имеет вид: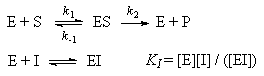 Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексу EI с учетом уравнений материального баланса [E] + [ES] + [EI] = [E]0 и [I] " [I]0 дает для скорости реакции уравнение типа (7.2): Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексу EI с учетом уравнений материального баланса [E] + [ES] + [EI] = [E]0 и [I] " [I]0 дает для скорости реакции уравнение типа (7.2):
, (7.3) 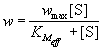 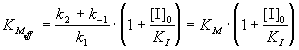 где эффективная константа Михаэлиса связана с исходной концентрацией ингибитора:; где эффективная константа Михаэлиса связана с исходной концентрацией ингибитора:;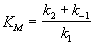 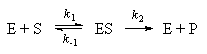 (7.3а)Величину KI = [E]. [I] / [EI], которая представляет собой константу диссоциации комплекса фермента с ингибитором, называют константой ингибирования. Таким образом, при конкурентном ингибировании увеличивается константа Михаэлиса, а максимальная скорость ферментативной реакции остается неизменной.При неконкурентном механизме ингибитор обратимо связывает промежуточный комплекс фермента с субстратом. Простейшая кинетическая схема данного процесса имеет вид: (7.3а)Величину KI = [E]. [I] / [EI], которая представляет собой константу диссоциации комплекса фермента с ингибитором, называют константой ингибирования. Таким образом, при конкурентном ингибировании увеличивается константа Михаэлиса, а максимальная скорость ферментативной реакции остается неизменной.При неконкурентном механизме ингибитор обратимо связывает промежуточный комплекс фермента с субстратом. Простейшая кинетическая схема данного процесса имеет вид:
г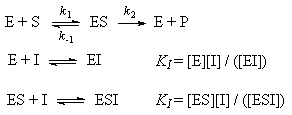 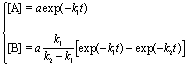 де предполагается, что константы диссоциации комплексов EI и ESI одинаковы: [E]. [I] / [EI] = [ES]. [I] / [ESI] = KI. Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексам EI и ESI с учетом уравнений материального баланса [E] + [ES] + [EI] + [ESI] = [E]0 и [I] " [I]0 дает для скорости реакции уравнение типа (7.2): де предполагается, что константы диссоциации комплексов EI и ESI одинаковы: [E]. [I] / [EI] = [ES]. [I] / [ESI] = KI. Применение квазистационарного приближения к комплексу ES и квазиравновесного приближения к комплексам EI и ESI с учетом уравнений материального баланса [E] + [ES] + [EI] + [ESI] = [E]0 и [I] " [I]0 дает для скорости реакции уравнение типа (7.2):
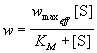 , (7.4)г , (7.4)г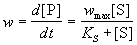 де эффективная максимальная скорость связана с начальной концентрацией ингибитора выражением:. (7.4а)При неконкурентном ингибировании максимальная скорость реакции уменьшается, а константа Михаэлиса остается неизменной. Смешанное ингибирование описывается более сложными кинетическими схемами. При смешанном ингибировании изменяются и константа Михаэлиса, и максимальная скорость ферментативной реакции де эффективная максимальная скорость связана с начальной концентрацией ингибитора выражением:. (7.4а)При неконкурентном ингибировании максимальная скорость реакции уменьшается, а константа Михаэлиса остается неизменной. Смешанное ингибирование описывается более сложными кинетическими схемами. При смешанном ингибировании изменяются и константа Михаэлиса, и максимальная скорость ферментативной реакции
|
БИЛЕТ №23 Химические реакции протекают с выделением или поглощением энергии в виде тепла Тепловой эффект зависит от природы исходных веществ и продуктов реакции, их агрегатного состояния и температуры.
Термодинамика - наука о превращении одних форм энергии в другие на основе закона сохранения энергии. Химическая термодинамика устанавливает направление самопроизвольного протекания химических реакций при определенных условиях, используя изменения термодинамических величин: внутренней энергии вещества (системы) U, энтальпии Я, энтропии S, свободной энергии Гиббса G.
Термохимия - раздел термодинамики, изучающий тепловые эффекты реакций. Тепловой эффект реакции, измеренный при постоянной температуре и давлении, называют энтальпией (Я) реакции и выражают в джоулях (Дж) и килоджоулях (кДж). Реакции, идущие с выделением тепла, называются экзотермическими и для них ДН^О. Реакции, идущие с поглощением тепла, называются эндотермическими и для них АНхр>0. Очевидно, что изменение энтальпии в хими-ческой реакции равно взятому с обратным знаком тепловому эффекту реакции при Р - const и Т - const, т. е.
Теплота образования (АН0»») - количество теплоты, которое выделяется при образовании 1 моля соединения из простых веществ при стандартных условиях . Теплоты образования простых веществ (Н2, О2, С12) условно приняты равными нулю. В качестве стандартных условий выбраны Т =298 К и /'=101,852 кПа (1 атм). Энтальпия образования зависит от агрегатного состояния вещества (газ, жидкость, кристалл), а ее значение характеризует стремление системы (вещества) к упорядочению, например, ДН0298(Н2Опар)=-241,8 кДж/моль, ДН°298(Н2ОЖИд) =-28568 кДж/моль.
В основе всех термодинамических расчетов лежит закон Гесса(1840г.):
-тепловой эффект реакции зависит только от природы и физического состояния исходных и конечных веществ, но не зависит от пути перехода. Для термохимических расчетов обычно используют следствие из закона Гесса: тепловой эффект химической реакции (АН *,,) равен сумме теплот образования (АНобр) продуктов реакции за вычетом суммы тегоют образования исходных
веществ с учетом стехиометрических коэффициентов в уравнении реакции:
- 2ДНИСХ, или для стандартных условий: ДН0^ хр = 1ЛН°Х» прод - 2ЛН°298 иск-
|
БИЛЕТ №26 Электролиты - вещества, растворы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли. Электролиты в водных растворах диссоциируют (распадаются) на ионы - катионы (+) и анионы (-). Именно ионы переносят электрический ток в растворах.
Объяснение существования подвижных ионов в растворах электролитов было впервые предложено шведским ученым Аррениусом в 1883 г. Согласно его теории электролитической диссоциации, в растворах электролитов существует равновесие между активной частью электролита, способной проводить электрический ток, и неактивной, не проводящей тока. Теория электролитической диссоциации далее была развита в работах Вант - Гоффа, Менделеева. Диссоциация электролитов происходит при их растворении и является продуктом взаимодействия растворенного вещества и растворителя. К электролитам относятся твердые вещества с ионной кристаллической ионной решеткой (ионная связь), молекулы с полярной ковалентной связью. В общем случае процесс взаимодействия растворенного вещества с растворителем называется сольватацией, а если растворителем является вода, то – гидратацией. Гидратацию можно условно разделить на два составляющих процесса, которые протекают одновременно: разрыв связей в растворяемом веществе (эндотермический процесс) и образование гидратов (экзотермический процесс). Гидраты - это соединения разной прочности между ионами растворенного вещества и полярными молекулами воды. Гидратированные ионы электролита содержат в своем окружении разное число молекул растворителя.
NaCI кр + H2O NaCI р-р Na+ * m H2O + CI- pH2O,
Твердая фаза раствор гидрат катиона гидрат аниона
где n, p – число молекул растворителя в гидратной оболочке иона. Число молекул растворителя, взаимодействующих с одним ионом, называется числом гидратации. Число гидратации зависит от заряда иона, его размера и температуры раствора. Например, для катионов щелочных металлов число гидратации, определенное по скорости перемещения ионов без воздействия электрического тока, имеют следующие значения: ион Li+ Na+ K+ Rb+ Cs+
число гидратации 120 66 16 14 13
|
БИЛЕТ №21 Принцип Ле-Шателье.При равенстве скоростей этих реакций наступает равновесие, константа которого записывается
КрМ = [С02]рав/[СО]2рИ1-
В соответствии с принципом Ле-Шателье, при повышении температуры системы, находящейся в равновесии, смещение равновесия произойдет в направлении эндотермической реакции, т.е. в сторону образования СО.
Увеличение давления в системе а) приводит к смещению равновесия влево, т.к. в этом случае увеличение концентрации СО2 и СО в молях/л не будет одинаковым (2 моля СО расходуется, 1 моль СО2 получается).
Реакция б) является гомогенной и эндотермической. Запишем выражение для константы равновесия: Крш=[802]2рав.[02]ри/[80з]2риУвеличение температуры смещает равновесие системы в направлении поглощения тепла, т.е. в сторону образования SO2 и О2.Реакция б) идет с изменением числа молей газообразных веществ. Из 2 молей исходных веществ получается 3 моля продуктов, следовательно, при протекании реакции слева направо давление в системе б) увеличивается, что приведет к сдвигу равновесия в сторону образования 8Оз-
|
БИЛЕТ №24 Энтропия (S) как функция состояния связана с числом равновероятных микроскопических состояний (W), которыми можно реализовать данное макро состояние системы, и выражается уравнением: S = klgW, где ft - коэффициент пропорциональности. Наименьшую энтропию имеют правильно построенные кристаллы. Возрастает энтропия для одного и того же вещества при переходе из кристаллического состояния в жидкое, но особенно при переходе от жидкого в газообразное. Энтропия определяет стремление системы к беспорядку и является мерой не-упорядоченности системы. Изменения энтропии при протекании химических процессов рассчитываются по уравнению:
Sxp = 15прод - LS^ , или при стандартных условиях: A^298xp=^»8npe«-^»eiiM.
Для выяснения возможности самопроизвольного протекания химической реакции в ту или другую сторону необходимо учитывать две составляющие движущей силы реакции: 1)стрем-ление к порядку ( ДН°298 хр) и 2)стремление к беспорядку (AS^xp) при постоянных давлении и температуре.
Общая движущая сила химической реакции определяется энергией Гиббса: ДО = АН - Т AS.
Энергия Гиббса, или изобарно-изотермический потенциал, также является функцией состояния системы и подчиняется следствию закона Гесса:
АО°298 хр = £AG°298 прод - £AG°298 исх (для стандартных условий). Самопроизвольно протекают процессы, если: AG ц, - LAG прод - SAG «ex < 0. При состоянии равновесия AG хр = 0, а ДНхр = Т
Пример. На основании стандартных теплот образования и абсолютных стандартных энтропии веществ вычислите ДО°298 реакции. Возможна ли эта реакция? Чем можно объяснить, что ASxp < О ? NH3(r) + НС1(г) = МН4С1(к)
Решете. АО0», хр = АН0», хр - ТДУ»,, , где AH°j98 и 5°298 - функции состояния. Поэтому
ДН°298 хр = 1ДН°298 „род - 2ДН°298 „сх, Д5°298хр= 23°298прод - LS°29S „ох-
Из таблицы стандартных теплот образования веществ и абсолютных энтропии образования веществ берем необходимые данные и рассчитываем:
АН°298ч)= -315,39 - (-46,19) - (-92,31) = -176,89 (кДж/моль), AS°298xp = 94.5 - 192,5 - 186,68 = -284,68 (Дж/моль-К). АО^ч,^ -176,89 - 298-(-0,28468) = -92,08 (кДж)
Вывод: изменение AG°298 хр <0, следовательно, при стандартных, условиях эта реакция будет протекать самопроизвольно. Энтропия в процессе реакции уменьшается (Д5°298хр < 0), так как из двух молей газообразных веществ (МНз(г) и НС1(г)), где возможность хаотического движения большая, получается 1 моль кристаллического веществ (МЬЦСКк)).
|
|
БИЛЕТ №28 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
В зависимости от содержания растворенного вещества растворы бывают разбавленные, концентрированные, насыщенные и перенасыщенные. Количественная характеристика способности вещества растворяться до образования насыщенного раствора называется растворимостью. Растворимость определяется как:
а) количество вещества в граммах, которое необходимо растворить в 100 г растворителя для получения насыщенного раствора (m(г) / 100 (г));
б) количество молей растворенного вещества, которое содержится в 1 л насыщенного раствора (моль / л).
В химической практике применяются растворы с различным содержанием растворенного вещества. Для таких растворов используют следующие способы выражения концентрации растворенного вещества: массовая доля и мольная доля растворенного вещества, молярная и моляльная концентрации, молярная концентрация эквивалента. Для представления расчетных формул в настоящем практикуме введены следующие обозначения: раствор(y) = растворенное вещество (x) + растворитель (z), тогда,
-параметры растворенного вещества - m(x) масса, M(x) молярная масса, Э(х) эквивалент, nм(х)- число молей, nэ(х) – число эквивалентов;
-параметры раствора - m(y)– масса, V(y) - объем, (y) - плотность;
-параметры растворителя - m(z) - масса, V(z) - объем, nм(z) - число молей, (z)- плотность.
2.1 Массовая доля (С%)
или процентная концентрация определяет, какую частьмасса растворенного вещества составляет от массы раствора (обычно в процентах), и рассчитывается как отношение:
С% = m(х) •100% или С% = m(х) •100%
m(у) ) m(х)+m(z)
Определение процентной концентрации можно сделать конкретной, если принять массу раствора за 100 г,
тогда С% = m(х) т.е. процентная концентрация (в %) показывает, сколько граммов растворенного вещества содержится в каждых 100 г раствора. Рассмотрим 5% раствор KCI.
в 100 г (у) раствора - содержится 5 г растворенного вещества (х) или
в 95 г (z) растворителя - содержится 5 г (х).
Очевидно, что полученный результат будет справедлив для любого растворенного веществ, независимо от его природы (соль, кислота, основание и т.д.), так как концентрация не включает индивидуальную характеристику растворенного вещества – молярную массу (М г/моль).
2.2 Молярная концентрация (См)
или молярность определяет, сколько молей растворенного вещества содержится в каждом литре данного раствора, и рассчитывается как отношение количества растворенного вещества в молях nм(х), содержащегося в растворе, к объему этого раствора:
nм(х) моль m(х) m(х) • ρ(у)
СМ = ————— = ————— = ————————
V(y) л М(х) V(y) М(х)•[(m(z)+m(х)]
Рассмотрим пример: пусть дан 0,8 молярный раствор K2SO4 , плотность которого равна 1,02 г/мл.
В соответствии с определением СМ, это значит:
в 1л раствора содержится - 0,8 моля соли, или
в 1л раствора содержится - 0,8 * 174 г/моль = 139,2 г соли, или
в (1 л *1,02 кг/л) кг раствора содержится - 0,8 моля (139,2 г) соли.
2.3 Моляльная концентрация (Cm)
или моляльность определяет, сколько молей растворенного вещества приходятся на каждый килограмм растворителя, и рассчитывается как отношение количества растворенного вещества в молях n(х) к массе растворителя: nм(х) моль m(х) m(х)
Сm ————— = ———— = ———————
m(z) кг М(х) m(z ) М(х)•[m(y)-m(х)]
Рассмотрим пример: пусть дан 0,8 моляльный раствор K2SO4 , плотность которого равна 1,01 г/мл. В соответствии с определением Сm , это значит:
на 1кг растворителя приходится - 0,8 моля соли, или
на 1кг растворителя приходится - 0,8 * 174 г/моль (139,2 г) соли, или
в [1000 г(z) +139,2г(х)] (л) раствора содержится - 0,8 моля (139,2 г) соли.
1,01 г/мл 10-3 мл/л
2.4 Молярная концентрация эквивалента (СN)
или нормальность определяет, сколько молей эквивалента растворенного вещества содержится в каждом литре раствора, и рассчитывается как отношение количества растворенного вещества в молях эквивалента nэ(х), содержащегося в растворе, к объему этого раствора:
nэ(х) моль m(х) СМ
СN = ————— = ——————— = ————
V(у) л Э(х) М(х) • V (y) Э(х)
Пример: для 1,6 N раствор K2SO4 , плотность которого равна 1,02 г/мл или 1,02 кг/л. В соответствии с определением СN , известно: в 1л раствора содержится - 1,6 эквивалентов соли, или
в 1л раствора содержится - 1,6 моль ( экв.) * ½ *174 г/моль = 139,2 г соли, или в (1 л *1,02 кг/л) кг раствора содержится - 1,6 (nэ) эквивалентов соли.
2.5 Мольная доля (С)
показывает, какую часть число молей растворенного вещества составляет от суммы числа молей растворенного вещества и растворителя в растворе. Для двухкомпонентного раствора состоящего из растворителя и одного растворенного вещества мольная доля рассчитывается по уравнению:
n(х) m(x)/M(х)
С = —————— = ———————————,
n(х) + n(z) m(х)/M(x) + m(z)/M(z)
где nм(z) - число молей растворителя, в котором растворили nм(х) молей растворенного вещества.
|
Очевидно, численное значение С всегда меньше единицы ( или 100% ).
Рассмотрим пример: рассчитать число молей K2SO4, массу K2SO4 и массу растворителя Н2О, если мольная доля соли в растворе равна 0,01. Поскольку этот способ выражения концентрации раствора является относительным, можно произвольно задать число молей растворителя, например, nм(z) = 0,99 (молей). Тогда
0,01 = nм (K2SO4) / nм(K2SO4) + 0,99 ,
число молей nм (K2SO4) равно - 0,01 моль,
масса (K2SO4) = 0,01 моль* 174 г/моль = 1,74 г;
масса растворителя (воды) равна 0,99 моль*18 г/моль=17,82 г
2.6 Закон эквивалентов в объемном анализе
Пользуясь растворами, концентрация растворенного вещества в которых выражена через нормальность СN, можно на основе закона эквивалентов рассчитать, в каких объемных отношениях должны быть смешаны растворы веществ Х1 и Х2, чтобы эти вещества прореагировали между собой без остатка.
V(x1) • CN(x1) = V(х2) • СN(х2), или V(x1)/V(х2) = СN(х2)/СN(x1).
Объемы растворов реагирующих веществ обратно пропорциональны их молярной концентрации эквивалента (нормальности). Произведение объема раствора и молярной концентрации эквивалента вещества равно числу эквивалентов, т.е. V(Х1) • CN(Х1) = nэ(Х1)
Рассмотрим пример: какой объем 0,2 N раствора нитрата серебра потребуется для осаждения хлорид – ионов, которые содержатся в 100 мл 0,01N раствора AICI3. Реакция в растворе протекает по уравнению:
AICI3 + 3AgNO3 = AI(NO3)3 + 3AgCI
По закону эквивалентов на nэ (AICI3) израсходуется nэ (AgNO3). Так как CN = nэ / V(у), можно записать:
100мл * 0,01 экв/л = 0,2 экв/л * V(AgNO3 ) мл, отсюда V(AgNO3 ) = 5 мл.
Пример. Вычислите молярную концентрацию эквивалента и молярную, моляльную концентрации раствора, в котором массовая доля СuSО4 равна 10%. Плотность раствора 1,107 г/мл.
Решение. Вычисления в задаче связаны с пересчетом концентраций из одних единиц в другие.
1. Определим молярную массу эквивалента (Мэ) CuSО4 : Мэ (CuSО4) = М• Э = 159,6 • 1/2 = 79,8 (г/моль).
2. Определим Cm (моль/кг) В растворе с мольной долей равной 10%, на каждые 10 г CuSО4 приходится 90 г воды. Отсюда
n (CuSО4) m (CuSО4) 10
Cm = —————— = ———————————— = —————— = 0,696 (моль/кг).
m (H2O) M (CuSО4) • m (H2O) 159,61•0,090
3. Молярная и эквивалентная концентрации связаны с объемом раствора. Поэтому находим объем, который занимают 100 г 10%-ного раствора CuSО4:
V(CuSО4) = m(у)/ρ(у) = 100/1,107 = 90,33 (мл) = 0,0903 (л).
4. Рассчитываем молярную концентрацию раствора См (моль/л):
n (CuSО4) m (CuSО4) 10
См = —————— = —————————— = ——————— = 0,693 (моль/л)
V(у) М (CuSО4) • V(y) 159 • 0,0903
5. Рассчитываем нормальную концентрацию раствора CuSО4 СN ( моль/л) :
nэ(CuSО4) m (CuSО4) 10
СN = ——————— = ——————————— = ——————— = l,386(моль / л).
V(v) Mэ (CuSО4) • V(у) 79.8 • 0,09
|
БИЛЕТ №29 Раствор - гомогенная система, состоящая из растворенного вещества, растворителя и продуктов взаимодействия между ними. Растворы бывают газообразные (атмосфера), жидкие (природная вода), твердые (сплавы). Свойства растворов зависят от природы растворителя (вода, ацетон, керосин и др.), от природы растворенных веществ (кислоты, основания, соли, газы и др.), а также от концентрации растворенного вещества в растворе. В настоящем практикуме рассматриваются, в основном, свойства водных растворов.Идеальные растворы – растворы, которые образуются без изменения объема растворителя и без теплового эффекта, т.е. Vр-ра = 0 и Нр-ра = 0. В этом случае предполагается, что между молекулами растворителя и молекулами растворенного вещества отсутствует межмолекулярное взаимодействие. К идеальным растворам с некоторым приближением относят разбавленные растворы органических веществ и газов в воде (растворы неэлектролитов). Реальные растворы - растворы кислот, оснований, солей в воде (электролиты), образование которых сопровождается взаимодействием молекул растворителя и растворенного вещества, изменением объема растворителя и выделением или поглощением тепла. К реальным - относятся также концентрированные растворы неэлектролитов
Законы Рауля Общим свойством всех жидких систем является давление насыщенного пара жидкости, которое определяется равновесием между жидким и газообразным состоянием вещества. Это равновесие устанавливается на границе раздела фаз жидкость- пар (газ). При растворении в жидкости (z) какого-либо нелетучего вещества (х) давление насыщенного пара этой жидкости понижается. Это происходит вследствие того, что концентрация молекул растворителя в поверхностном слое раствора становится меньше чем в чистом растворителе, а значит, равновесие может быть достигнуто при меньшем давлении насыщенного пара. При постоянной температуре величина давления насыщенного пара жидкости зависит от ее летучести и концентрации растворенного вещества. Если обозначить через P(z) и Р(у) - давление насыщенного пара растворителя над чистым растворителем и раствором, соответственно, то вышесказанное можно выразить следующими соотношениями:
-разность P(z) - P(y)>0 называется абсолютным понижением давления насыщенного пара растворителя над раствором;
-величина P(z) - Р(у) / P(z) или P(y) / P(z) называется относительным понижением давления насыщенного пара растворителя над раствором.
Первый закон Рауля (1887 г). Выражает зависимость относительного понижения давления насыщенного пара растворителя от концентрации раствора неэлектролита. Относительное понижение давления насыщенного пара растворителя над раствором нелетучих веществ равно мольной доле растворенного вещества.
С(х) = P(z) - Р(y) = Δ Р(y)
P(z) P(z)
Жидкость закипает, кода давление насыщенного пара этой жидкости становится равным внешнему атмосферному давлению, и кристаллизуется, когда давление насыщенного пара жидкости становится равным давлению насыщенного пара твердой фазы этой жидкости (для воды – лед). Исходя из первого закона Рауля, становится очевидным, что присутствие растворенного вещества понижает температуру кристаллизации раствора и повышает температуру кипения раствора по сравнению с tкp и tкип чистого растворителя.
Второй закон Рауля определяет зависимость температуры кристаллизации и кипения раствора от концентрации растворенного вещества: Повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорциональны моляльной концентрации растворенного вещества. Δtкип = Ккип·Сm, Δtкp = Ккр·Сm.
Здесь Сm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиоскопическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя.
Для воды Ккип = 0,52°С, Ккр = 1,86°С.
По своему смыслу эбуллиоскопическая и криоскопическая константы показывают повышение температуры кипения и понижение температуры кристаллизации раствора, моляльная концентрация которого равна единице. Используя вышесказанное, можно составить следующие соотношения:
tкp(у) 0С = tкp(z) 0С – Δ tкp ; где Δ tкp = tкp(z) - tкp(y) ,
tкип. (у) 0С = tкип. (z) 0С + Δ tкип , где Δ tкип = tкип(y) - tкип(z) .
Например, 1m водный раствор любого неэлектролита закипает при температуре 100,52°С , а кристаллизуется при температуре –1,86 °С.
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы C6H12O6 при О°С.
Решение. Согласно закону Вант-Гоффа, Росм = СМ *RT. Сначала рассчитаем молярную концентрацию раствора глюкозы:
n (C6H12O6) (C6H12O6) 63
СМ = ———————— = ——————————— = ——————— = 0,25 (моль/л),
V(у) М (C6H12O6) · V(у) 180,16 · 1,4
Росм = 0,25 ·8,314 · 273 · 103 = 5,67 · 105 Па
Пример 2. Определите температуры кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Температура кипения чистого бензола 80.2°С, температура кристаллизации -5.4°С. Ккр = 5,1°С. Ккип = 2,57°С.
Решение. Из закона Рауля следует:
Δtкp = Ккр · Cm = Ккр · m (C6H5NO2)·103/ [M (C6H5NO2) · m (С6Н6)],
Δtкип = Ккип · Cm = К кип · m (C6H5NO2)·103/ [M (C6H5NO2) · m (С6Н6)],
где m (C6H5NO2) и m (С6Н6) - массы нитробензола и бензола, M (C6H5NO2) - молекулярная масса C6H5NO2, которая равна 123,11 г/моль. Подставляя численные значения всех величин в формулы, находим: и т д ещё 4 строчки..
| |
 Скачать 0.71 Mb.
Скачать 0.71 Mb.