БИЛЕТ №35 Растворимость. Произведение растворимости
Растворение труднорастворимого электролита (ТРЭ) в заданном количестве растворителя происходит до состояния насыщения. В насыщенном растворе электролит находится в динамическом равновесии с твердой фазой. Растворимость электролита определяет концентрацию ионов в насыщенном растворе электролита, а значит его электропроводность. Чем меньше растворимость ТРЭ, тем он слабее.
При растворении электролита, например, соли, в раствор переходят не молекулы, а ионы. В этом случае в насыщенном растворе равновесие устанавливается между ионами соли в кристаллической фазе и ионами, перешедшими в раствор: СаСО3 кр ↔ Ca2+р-р + СО32-р-р.
Константа равновесия этого процесса:
Крав. = [Ca2+] • [СО32-]
[СаСО3кр]
[СаСО3кр] является величиной постоянной, поэтому произведение двух констант можно обозначить как ПР.
ПР = Крав. • [СаСО3кр] = [Ca2+]нас • [СО32-]нас = Р2
Р (моль/л) - растворимость, численно равная молярной концентрации насыщенного раствора электролита, Р = См(нас); ПР - произведение растворимости труднорастворимого электролита (ТРЭ). ПР рассчитывается как произведение молярных концентраций ионов (ПК) ТРЭ в насыщенном растворе в степенях равных стехиометрическим коэффициентам в уравнении диссоциации. ПР является величиной постоянной при данной температуре. Значения ПР для всех известных ТРЭ помещены в справочник.
Рассмотрим насыщенный раствор ТРЭ типа А2В3 Обозначим концентрацию насыщенного раствора электролита через Р (моль/л). Поскольку вещество малорастворимое, то степень диссоциации αдис можно принять равной 1 (100%). Тогда, используя уравнение реакции, можно записать:
начальное состояние раствора Р 0 0
А2В3 = 2А+3 + 3В2-
равновесное состояние насыщенного раствора 0 2Р 3Р
Выражение для произведения растворимости имеет вид: ПР = [Аа+]2 • [Вв-]3 = [2Р]2 • [3Р]3 = 108 Р5.
Значения ПР используются в общей химии, аналитической химии, гидрохимии, химии океана, экологии и др., т. к. позволяют количественно оценить:
- условия образования и растворения осадков;
- рассчитать растворимость труднорастворимого электролита;
- рассчитать молярную концентрацию ионов электролита в насыщенном растворе.
Условием образования осадка является превышение произведения концентраций ионов (ПК) малорастворимогоэлектролита над его произведением растворимости, т.е. ПК > ПР.
При увеличении концентрации одного из ионов ТРЭ в его насыщенном растворе (например, путем введения хорошо растворимого электролита, содержащего тот же ион) произведение концентраций ионов электролита (ПК) становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Например, если в насыщенный раствор AgCI добавить сильный электролит KCI, то появление в растворе одноименного иона (CI-) приводит к смещению равновесия в сторону образования осадка (←). Когда установится новое равновесие, то произведение концентраций (ПК) ионов электролита вновь становится равным ПР, но при этом в растворе появится осадок. В состоянии нового равновесия концентрация ионов Ag+ будет меньше, а концентрация ионов CI- больш е, чем было до добавления KCI.
AgCI↓ <=> Ag+ + CI- + КCI <=> K+ + CI-.
По принципу Ле Шаталье, если [CI-] ↑, то смещение равновесие произойдет в сторону образования осадка <----.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, и равновесие между раствором и осадком сместится в сторону растворения осадка (→).
. Сu(OH)2↓ <=> Cu+2 + 2OH- + HCI <=> H+ + CI-
При добавлении HCI происходит реакция H+ + OH- <=> H2O , при этом [OH-] ↓, смещение равновесия происходит в сторону продуктов диссоциации основания ------- .
Условием растворения осадка малорастворимого электролита является недонасыщение раствора, когда произведение концентраций его ионов меньше значения ПР, т.е. ПК < ПР.
Пример 1. Рассчитайте значение ПР для ортофосфата серебра , если в 1 л насыщенного раствора содержится 0,0065 г соли.
Решение. Растворимость Аg3РО4 или молярная концентрация соли в насыщенном растворе, равна:
т (Аg3РО4) 0.0065
Р = ——————————— = —————— = l,6 •l0-5 моль/л
М (Аg3РО4) • V(у) 418,58 • 1
Диссоциации фосфата серебра идет по уравнению: Аg3РО4 = 3Ag+ + РО43-. Видно, что из 1 моля соли образуется 3 моля ионов Ag+ и 1 моль ионов Р043-, поэтому [Р043-] = P, a [Ag+] = 3Р. Отсюда находим ПР:
ПР = [Ag+]3 • [РО43-] = (3Р)3 • Р = (4,8 •10-5) 3 •l,6•10-5 = 1,77 •10-18.
Пример 2. Произведение растворимости йодида свинца при 20°С равно 8 •10-9. Вычислите растворимость соли и содержание соли в г/л при указанной температуре.
Решение. Если искомая растворимость соли равна Р, тогда в насыщенном растворе РbI2 концентрации ионов равны: [ Рb2+] = P,
[I-] = 2Р моль/ л. РbI2 = Рb+2 + 2 I- . Отсюда ПР(РbI2) = [Рb2+] [I-]2 = Р(2Р)2 = 4 Р3
Р = ( ПР(РbI2)/4 )1/3 = ( 8 • 10-9/ 4)1/3 = 1,3 10-3 моль/л.
Молярная масса РbI2 равна 461 г/моль, поэтому растворимость РbI2, выраженная в г/л, составит 1,3 10-3 моль/ л • 461 г/ моль = 0,6 г/л.
|
БИЛЕТ №36 Ионное произведение воды. Водородный показатель (рН)
Вода является слабым электролитом и диссоциирует по уравнению: H2O H+ + OH-. Выражение для
константы диссоциации имеет вид: Кдис = [H+]рав [OH-]рав =1,8 10-16
[H2O ]рав.
Значение Кдис воды определили экспериментально по измерению удельной электропроводности при Т = 25 оС. Чистая вода практически не проводит электрический ток, т.е. άдис(H2O) << 1, поэтому можно принять, что
[H2O ]рав = [H2O]нач. Рассчитаем молярную концентрацию чистой воды, зная, что 1л воды весит 1 кг (ρ =1кг/л):
См(H2O) = m (H2O) = 1000 г = 55,6 моль/ л.
M (H2O) * V (H2O) 18 г/моль* 1 л
Подставим полученное значение См(H2O) в уравнение для Крав::
Крав * 55,6 = Кw = [H+] [OH-] = 10-14 , где Кw – ионное произведение воды.
В чистой воде [H+] [OH-] = 1 10-14 , тогда [H+] = [OH-] = 10-7 моль/л.
В водных растворах кислот [H+] > [OH-] или [H+] > 7 моль/л, среда кислая.
В водных растворах щелочей и оснований [H+] < [OH-], [H+] < 7 моль/л, среда основная или щелочная.
При растворении в воде любых по природе веществ остается неизменным - [H+] [OH-] = 1 10-14 .
Для удобства выражения реакции среды водных растворов был введен специальный термин, который назвали водородным показателем (рН). рН – отрицательный десятичный логарифм молярной концентрации ионов водорода:
рН = - lg [H+].
Иногда пользуются также показателем рОН – отрицательный десятичный логарифм молярной концентрации ионов гидроксила. рОН = - lg [ОH-]
В нейтральной среде рН = 7 ; рОН = 7, рН + рОН = 14
В кислой среде рН < 7 ; рОН < 7, рН + рОН = 14
В щелочной среде pH > 7 ; рОН < 7, рН + рОН = 14
ШКАЛА рН
0―――――――――――――――――――7―――――――――――――――――――14
←―― кислая среды нейтральная среда щелочная среда ――→
растворы кислот чистая вода растворы оснований, щелочей
Кислотность и щелочность (рН) является важнейшей характеристикой всех водных растворов и естественных водных объектов (реки, озера, моря, океаны ). рН контролирует скорость многих химических, биологических и биохимических процессов, играет важную роль в медицине, в технологии пищевой и перерабатывающей промышленности.
Пример 1 Рассчитайте рН раствора, в 500 мл которого содержится 0,245 г серной кислоты. Степень диссоциации кислоты равна 1.
Решение: Уравнение диссоциации кислоты: H2SO4 <=> 2H+ + SO4-2
Выражение для расчета рН: рН = -lg CM (H+), где CM (H+) = n (H+) * άдис * CM (кислоты).
Рассчитаем CM (кислоты) = 0,245 / 98 * 0,5 = 0,05 моль/л
Тогда рН = -lg ( 1 * 2 * 0,05) = -lg 0,1 = 1.
Пример 2 Рассчитайте рН 5,6% раствора КОН, степень диссоциации щелочи в растворе составляет 0,9. Плотность раствора равна 1,02 мл/л.
Решение: Уравнение диссоциации щелочи: КОН <=> К+ + ОН-
Выражение для расчета рН в растворах щелочей : рН = 14 – рОН = 14 – (-lg (ОH-) * άдис *CM (КОН)).
Рассчитаем CM (КОН) = 12 * 1,02 / 56 * 0,1 = 1,02 моль/л
Тогда рН = 14 -lg ( 0,9 * 1 * 1,02) = 13.
|
БИЛЕТ №39 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию, как в кристаллическом, так и в растворенном состоянии.
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число σ-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу σ-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди- и более дентатные лиганды.
Рассмотрим строение комплексной соли на примере гексацианоферрата (2) калия:K4[Fe+2(CN-)6]4-: ион Fe+2 – центральный ион или комплексообразователь; анион CN- - лиганд или аденд; 6 – координационное число; [Fe+2(CN)6]4 – комплексный отрицательно заряженный анион или внутренняя сфера; ионы K+ являются противоионами комплексного иона, и составляют внешнюю сферу. Внешняясфера содержит положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ионы (если комплексный ион заряжен положительно); в случае незаряженной внутренней сферы внешняя сфера отсутствует. При вычислении заряда комплексного иона следует исходить из того, что этот заряд равен алгебраической сумме зарядов комплексообразователя и лигандов; при этом заряд комплексообразователя равен степени окисления (–1 * 6) - +2 = -4.
Ионы, находящиеся во внешней сфере, связаны с комплексным ионом, в основном, силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов по уравнению.
K4[Fe(CN-)6] ↔ 4К+ + [Fe(CN)6]4- , αдис≈1 .
первичная диссоциация ------------ равновесие
Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется, как правило, в незначительной степени, подобно слабым электролитам по уравнению:
[Fe(CN)6]4- ↔ Fe+2 + 6CN- αдис <<1 вторичная диссоциация <----------- равновесие
|
|
БИЛЕТ №38 ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей - это реакция обмена ионов соли с водой, в результате которой изменяется кислотность раствора. Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый. Реакция нейтрализации 2KOH + H2SO3 = K2SO3 + 2H2O (сильный слабый сильный слабый) 2OH- + H2SO3 = 2H2O + SO32
Реакция гидролиза K2SO3+ H2O = KOH + KHSO3 SO32- + HOH = HSO3- + OH-
При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ее ионов (Н+ или ОН-) в слабый электролит соли. При связывании ионов Н+ в растворе накапливаются ионы ОН−, реакция среды будет щелочная, а при связывании ионов ОН− накапливаются ионы Н+ - среда будет кислая.
Разберем случаи гидролиза, пользуясь понятиями "слабый" и "сильный" электролит.
Соль образована сильным основанием и слабой кислотой (гидролиз протекает по аниону). Это имеет место при гидролизе соли СН3СООК. Ионы соли СН3СОО− и К+ взаимодействуют с ионами Н+ и ОН− из воды. При этом ацетат-ионы (СНзСОО−) связываются с ионами водорода (Н+) в молекулы слабого электролита - уксусной кислоты (CHзCOOH), а ионы ОН− накапливаются в растворе, сообщая ему щелочную реакцию, так как ионы К+ не могут связать ионы ОН− (КОН является сильным электролитом), pH >7.
СН3СООК + H2O ↔ КОН + СН3ООН молекулярное уравнение
К+ + СН3СОО− + НОН ↔ K+ + ОН− + СН3СООН полное ионное уравнение
СН3СОО− + НОН ↔ ОН− + СН3СООН сокращенное ионное уравнение
Гидролиз соли Na2S протекает ступенчато. Соль образована сильным основанием и слабой двухосновной кислотой. В этом случае анион соли S2− связывает ионы Н+ воды, в растворе накапливаются ионы ОН−. Уравнение в ионной и молекулярной форме по первой ступени имеет вид
1-я ступень S2− + НОН ↔ HS− + ОН− сокращенное уравнение
Na2S + Н2О ↔ NaHS + NaOH молекулярное уравнение
Вторая ступень гидролиза практически не проходит при обычных условиях, так как, накапливаясь, ионы ОН− сообщают раствору с и л ь н о щ е л о ч н у ю реакцию, что приводит к реакции нейтрализации, сдвигу равновесия влево.
2-я ступень HS− + НОН ↔ H2S + ОН− сокращенное уравнение
NaHS + Н2О ↔ NaOH + H2S молекулярное уравнение
Соль образована слабым основанием и сильной кислотой (гидролиз протекает по катиону). Это имеет место при гидролизе соли NH4Cl (NH4ОH - слабое основание, НСl - сильная кислота). Отбросим ион Сl−, так как он с катионом воды дает сильный электролит, тогда уравнение гидролиза примет следующий вид:
NH4+ + НОН ↔ NH4OH + Н+ сокращенное уравнение
NH4Cl + Н2О ↔ NH4OH + НСl молекулярное уравнение
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н+ накапливаются в растворе и cреда становится кислой pH <7.
Гидролиз соли Zn(NO3)2 протекает ступенчато по катиону слабого основания.
1-я ступень Zn2+ + НОН ↔ ZnOH+ + H+ сокращенное уравнение
Zn(NO3)2 + Н2О ↔ ZnOHNO3 + HNO3 молекулярное уравнение
ионы ОН− связываются в слабое основание, ионы Н+ накапливаются.
Вторая ступень гидролиза практически не происходит при обычных условиях, так как в результате накопления ионов H+ в растворе создается с и л ь н о к и с л а я среда и гидроксид цинка растворяется .
2-я ступень ZnOH+ + НОН ↔ Zn(OH)2 + H+ сокращенное уравнение
ZnOHNO3 + Н2О ↔ Zn(OH)2 + HNO3 молекулярное уравнение
Соль образована слабым основанием и слабой кислотой (гидролиз протекает по катиону и аниону). Это имеет место при гидролизе соли СН3СООNH4 . Запишем уравнение в ионной форме, pH ≈ 7:
NH4+ + CH3COO− + НОН ↔ NH4OH + СН3СООН
Образуются слабое основание и слабая кислота, степень диссоциации которых примерно одинакова, поэтому при протекании гидролиза среда раствора будет нейтральная.
Необратимый гидролиз протекает для солей, которые образованы слабым основанием и слабой кислотой. В этом случае гидролиз протекает по всем ступеням до конца, т.е. до образования слабого труднорастворимого основания и слабой кислоты. Именно гидролиз является причиной того, что водные растворы некоторых солей приготовить нельзя, например CuCO3, AI2S3 и др. Необратимо протекает гидролиз, если одновременно ввести в раствор соль, образованную тяжелым металлом, и соль, образованную слабой летучей кислотой, например,
2AICI3 +3Na2S + H2O = Al2S3 +6NaCI
Гидролиз соли Al2S3 протекает полно и необратимо, так как в продукты реакции выделяются из раствора в виде осадка и газа: Al2S3 + 6Н2О → 3Н2S↑ + 2Аl(ОН)3↓
Разбавление и нагревание растворов усиливает гидролиз солей, т.е. происходит активизация последующих ступеней гидролиза, что в конечном счете приводит к образованию слабого основания и слабой кислоты: Пример 1. Гидролиз Fе(СНзСОО)3 на холоде протекает с образованием FеОН(СН3СОО)2, а при кипячении получается осадок Fе(ОН)2СН3СОО и даже Fе(ОН)3. Пример 2. Если в раствор Fe2(SO4)3 добавить раствор карбоната калия, то в результате гидролиза выпадет осадок Fе(ОН)3 и будет выделяться углекислый газ.
Fe2(SO4)3 + 3К2СО3 + 3Н2О → 2Fе(ОН)3↓ + 3СО2↑ + 3K2SO4 молекулярное уравнение
|
2Fe+3 + 3СО32- + 3НОН = 2Fе(ОН)3↓ + 3СО2↑ сокращенное уравнение
Соль образована сильным основанием и сильной кислотой (гидролизу не подвергается). При растворении в воде нитрата калия среда раствора не меняется, т.е. остается нейтральной, рН=7.
КNО3 + H2O ↔ КОН + HNO3, K+ + NО3− + НОН ↔ К+ + ОН− + Н+ + NО3−.
Степень гидролиза. Константа гидролиза
Количественными оценками способности соли подвергаться гидролизу являются степень гидролиза άгид и константа гидролиза Кгид. Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид) и рассчитывается как отношение:
άгид = СМ гид / СМ (100%). Очевидно, что для обратимого процесса гидролиза άгид < 1 (<100%), а для необратимого гидролиза άгид = 1 (100%). Степень гидролиза зависит от концентрации соли, температуры раствора άгид увеличивается при разбавлении раствора соли и при увеличении температуры раствора: если СМ ↓, то άгид ↑, если Т↑, то άгид ↑. Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кгид, тем необратимее гидролиз. Кгид имеет свое выражение для каждого случая гидролиза. Соль образована сильным основанием и слабой кислотой (на примере NaCNS). Сокращенное уравнение гидролиза: CNS- + HOH <=> HCNS + OH-
Крав = Кгид = [HCNS][OH-] * [H+]
[CNS-] [HOH] * [H+]
В этом выражении для Крав числитель и знаменатель дроби умножили на [H+]. Очевидно, что выражение для Кгид принимает вид: Кгид = К-w / Кдис (HCNS). Поскольку К-w величина постоянная и равна 10-14 , очевидно, что чем меньше Кдис слабой кислоты, анион которой входит в состав соли, тем больше Кгид.
Соль образована слабым основанием и сильной кислотой ( на примере NH4CI)
Сокращенное уравнение гидролиза: NH4+ + HOH <=> NH4OH + H+
Крав = Кгид = [NH4OH]* [H+] * [OH-] / [H+] * [HOH] * [OH-],
В этом выражении для Крав числитель и знаменатель дроби умножили на [OH-], поэтому выражение для Кгид принимает вид: Кгид = К-w / Кдис (NH4OH).
Очевидно, что чем меньше Кдис слабого основания, катион которого входит в состав соли, тем больше Кгид.
Соль образована слабым основанием и слабой кислотой (на примере NH4CNS).
Сокращенное уравнение гидролиза: NH4+ + CNS- + HOH <=> NH4OH + HCNS
Крав = Кгид = [NH4OH]* [HCNS]* [OH-]* [H+] / [NH4+]*[CNS-]*[HOH]*[OH-]*[H+],
В этом выражении для Крав числитель и знаменатель дроби умножили на [H+]*[OH-], поэтому выражение для Кгид принимает вид: Кгид = К-w / Кдис (NH4OH) * Кдис (HCNS).
Между Кгид и άгид соли существует связь, которая выражается уравнением закона Оствальда.
άгид = (Кгид / СМ соли)1/2.
Концентрацию ионов OH- или H+, которые накапливаются в растворе при гидролизе солей, а также рОН и рН можно рассчитать по следующим формулам.
а) для соли образованной сильным основанием и слабой кислотой: [OH-] = άгид * СМ соли
Тогда рН = 14 – рОН = 14 – Ig(άгид * СМ соли) или рН = 14 – lg [(Кw / Кдис слаб..кисл. * СМ соли)1/2]
б) для соли образованной слабым основанием и сильной кислотой [H+] = άгид * СМ соли .
Тогда рН = – Ig[H+] = -Ig(άгид * СМ соли) или рН = – lg [(Кw / Кдис слаб.основ. * СМ соли)1/2]
|
БИЛЕТ №44 Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu, где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:Правый электрод: Cu2+ + 2e = Cu Левый электрод: Zn2+ + 2e = Zn Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле Нернста:
,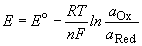 где aOx и aRed - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo- стандартный потенциал электрода (при aOx = aRed =1); n - число электронов, участвующих в полуреакции; R - газовая постоянная; T - абсолютная температура; F - постоянная Фарадея. При 25o C где aOx и aRed - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo- стандартный потенциал электрода (при aOx = aRed =1); n - число электронов, участвующих в полуреакции; R - газовая постоянная; T - абсолютная температура; F - постоянная Фарадея. При 25o C
С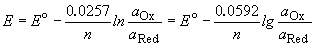 тандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов: E = EП - EЛ. Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. Стандартная ЭДС равна разности стандартных потенциалов: тандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов: E = EП - EЛ. Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. Стандартная ЭДС равна разности стандартных потенциалов:
Д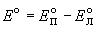 ля элемента Даниэля стандартная ЭДС равна Eo= Eo(Cu2+/Cu) - Eo(Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.ЭДС элемента связана с ля элемента Даниэля стандартная ЭДС равна Eo= Eo(Cu2+/Cu) - Eo(Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.ЭДС элемента связана с  G протекающей в элементе реакции: G протекающей в элементе реакции: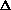 G = - nFE. Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции: G = - nFE. Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции: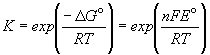 .Константа равновесия реакции, протекающей в элементе Даниэля, равна .Константа равновесия реакции, протекающей в элементе Даниэля, равна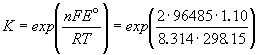 = 1.54. 1037.Зная температурный коэффициент ЭДС = 1.54. 1037.Зная температурный коэффициент ЭДС 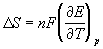 , можно найти другие термодинамические функции: , можно найти другие термодинамические функции: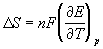 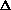 H = H = 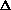 G + T G + T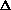 S = - nFE + S = - nFE + 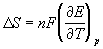 . .
|
| |
 Скачать 0.71 Mb.
Скачать 0.71 Mb.