|
|
Шпора по химии №1(ULTIMATE). Билет 1 Химический элемент
БИЛЕТ №9 Бутлеров выдвинул три основных положения:
- Атомы в молекулах соединены друг с другом в строго определенной последовательности. Изменение этой последовательности приводит к образованию новых веществ.
- Атомы соединяются друг с другом строго согласно их валентности.
- Свойства веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле и характера их взаимного влияния друг на друга.
Квантово-механическая модель образования хим. связей.
1916 г. – Джон Льюис – хим. связь образуется путем образования общей электронной пары, (одновременно принадлежат атомам).
В том же году Коссель Хим связь образуется путем передачи е одним атомом другому, при этом образуется «+», «-» заряженные ионы которые притягиваются друг к другу силами электромагнитного взаимодействия.
Изучение и прогнозирование свойств молекул методами решения уравнения Шрейденгера является отдельным разделом химии – квантовой химией. В зависимости от типов атомов, различают 3 типа хим связей: ковалентную, ионную, металлическая.
Хим связь возникает путем взаимодействия электро полей созданный е и ядрами атомов, участвующих в образовании молекулы или кристалла. Хим связь образуется если е взаимодействующих атомов получают возможность двигаться одновременно вблизи «+» зарядов нескольких ядер.
Метод валентных связей основан на предположении, что хим связь обеспечивается двумя е, движущихся в ограниченном пространстве электростатического поля двух ядер. Fот=e^2/d^2 (закон кулона). Fприт=e^2/((d/2)^2). Fот=Fприт => e^2/d^2= e^2/((d/2)^2)
e- =1/4e+, e+=4*e-.
Система устойчива, если электронная пара будет находится в этом пространстве более ¼ своего времени.
Валентные связи м/у атомами осуществляются одиночными неспаренными е. Кол-во валентных связей которые может образовать атом определяется числом неспаренных электронов.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположено направленными спинами, причем это электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы получили название валентных схем.
2. Ковалентная связь тем прочнее чем в большей степени перекрываются взаимодействующие электронные облака
Химическая связь. Валентность.
Атомы разных элементов в составе простых и сложных веществ удерживаются друг возле друга посредством химической связи. Тип химической связи зависит от характера распределения в молекуле электронной плотности. В обычных условиях молекула как система энергетически более устойчива, нежели атом. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Внешние уровни атомов, содержащие восемь электронов (октет), называются завершенными и характеризуются большой прочностью. Таковы внешние уровни атомов инертных (благородных) элементов, находящихся в группе VIIIA периодической системы, кроме атома гелия, находящегося в первом периоде и, соответственно, имеющего всего лишь один подуровень (s) на внешнем энергетическом уровне, заполненный двумя s- электронами. Внешние энергетические уровни атомов остальных элементов незавершенные. В соединении такие атомы, присоединяют либо отдают валентные электроны, образуя химическую связь с другими атомами, и их внешние энергетические уровни становится завершенными.
Валентными, т.е. участвующими в химической связи, являются электроны внешнего электронного слоя, а также электроны предвнешнего достраивающегося слоя. Свойство атомов элемента образовывать химическую связь называется валентностью. Величина валентности определяется числом связей, образованных атомом. Различают следующие типы химической связи: ковалентная, ионная, металлическая, водородная.
Ковалентная связь. Свойства . Гибридизация. Непол и пол.Полярность молекул, диполи.
Ковалентная химическая связь образуется двумя электронами (общая электронная пара) с противоположно направленными спинами и принадлежащими двум атомам. Общая электронная пара может образоваться в результате спаривания двух неспаренных электронов, принадлежащих различным атомам, а также за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора). В первом случае механизм образования ковалентной связи называют обменным, во втором случае ковалентная связь называется донорно- акцепторной или координационной связью. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором перекрывание электронных облаков максимально. Характерные свойства ковалентной связи – это ее длина, энергия, насыщаемость, направленность. Длина связи- это расстояние между ядрами атомов, образующих связь. Энергия связи- это количество энергии, которое необходимо, чтобы разорвать связь, измеряется в кДж/моль. Насыщаемость- способность атомов образовывать определенное число ковалентных связей. Направленность ковалентной связи определяет пространственную структуру молекул, их геометрию, форму.
Электроны, участвующие в образовании ковалентной связи могут иметь различную форму, однако образуемые ими связи могут быть равноценными вследствии их гибридизации- выравнивании различных орбиталей по форме и энергии.
Рассмотрим гибридизацию на примере молекулы метана. У атома углерода на внешнем энергетическом уровне 4 электрона: 2 спаренных s- электрона и 2 неспаренных р- электрона. Переход атома углерода в возбужденное состояние сопровождается разъединением спаренных s- электронов и переходом одного s- электрона на свободную р- орбиталь. Все четыре орбитали (одна s- и 3р- орбитали ) в результате смешиваются и принимают одинаковую форму объемной восьмерки. Происходит sp3- гибридизация. Образованные гибридными электронными орбиталями связи с s- электронами четырех атомов водорода будут равноценны по прочности и энергии.
Ковалентная связь между двумя атомами может быть одинарной (одна общая электронная пара), двойной (две общие электронные пары), тройной (три общие электронные пары). Например, в молекуле азота между атомами существует тройная связь, образование которой есть результат перекрывания рх, ру и рz орбиталей обоих атомов. Ковалентная связь между рх орбиталями, расположена вдоль прямой, соединяющей ядра двух атомов. Такая связь называется -связью. Все одинарные связи являются - связями. Оставшиеся ру и рz орбитали перекрываются в пространстве над и под плоскостью -связи с образованием p -связи.
Ковалентная связь может быть полярной и неполярной. Когда электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов, то ковалентная связь называется неполярной. Примером могут служить двухатомные молекулы простых веществ.
В случае, когда ковалентная связь образуется между атомами двух разных элементов, то электронное облако связи смещается к атому с большей электроотрицательностью. В результате, у атома с большей электроотрицательностью появляется отрицательный заряд, а у атома с меньшей электроотрицательностью- положительный заряд. В молекуле образуется как бы два полюса- положительный и отрицательный. Такая молекула носит название полярной молекулы или диполя. Связь между атомами в такой молекуле носит название ковалентной полярной связи.
В парообразном состоянии атомы всех веществ связаны в молекулы посредством ковалентной связи.
БИЛЕТ №10 Насыщаемость ковалентной связи. Ковалентность элементов. Теория гибридизации атомных орбиталей. sp-, sp2- и sp3- гибридизация атомных орбиталей и геометрия молекул.
Важными характеристиками ковалентной связи, влияющими на свойства вещества, являются длина, энергия, насыщаемость, направленность, полярность, поляризуемость связи, валентный угол, гибридизация орбиталей.
Эти характеристики помогают понять свойства как неорганических, так и органических веществ.
Межъядерное расстояние между химически связанными, атомами называется длиной связи. Например, в молекуле Н2О расстояние между ядрами атомов водорода и кислорода составляет 0,096 нм. Угол между воображаемыми прямыми, проходящими через ядра двух химически взаимосвязанных соседних атомов, называется валентным углом. Так, в молекуле воды этот угол равен 104,5°:
Мерой прочности связи является энергия связи, определяемая затратой энергии, необходимой для разрушения связи. Например, энергия связи Н–Н в молекуле Н2 равна 435 кДж/моль, в молекуле F2 –159 кДж/моль, в молекуле азота – 940 кДж/моль. Из этих примеров следует, что при образовании 1 моль Н2, F2 и N2 из изолированных атомов выделяется 435 кДж/моль для Н2, 159 кДж/моль для F2 и 940 кДж/моль для N2. Такое же количество энергии должно быть поглощено при распаде 1 моль указанных простых веществ до атомарных (энергия атомизации молекулы).
|
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Например, в молекуле водорода химическая связь осуществляется парой электронов, имеющих противоположные спины. Присоединение третьего атома к молекуле Н2 исключается ввиду того, что его спин обязательно совпадает со спином одного из двух электронов в двухатомной молекуле.
Таким образом, химическая связь в молекуле Н2 осуществляется парой электронов, имеющих противоположные спины. Ковалентные связи в других молекулах (например, N2, HC1, Н2О и т. д.) образованы так, что для формирования одной связи каждый предоставляет один неспаренный электрон. Следовательно, если в атоме имеется п неспаренных электронов, то он может образовать ковалентные связи с и другими атомами, имеющими но одному неспаренному электрону. Таким образом, между валентностью и числом неспаренных электронов имеется прямая зависимость.
Поскольку орбитали имеют различную симметрию, их взаимное перекрывание может осуществляться разными способами, чем и определяется пространственная направленность ковалентных связей. Данное свойство ковалентной связи определяет геометрию молекул (пространственную структуру). В зависимости от способа перекрывания орбиталей и симметрии образующегося электронного облака различают σ (сигма) - и π (пи) - связи. Рассмотрим некоторые примеры.
При рассмотрении ковалентной связи в молекуле Н2 было показано, что она формируется за счет перекрывания сферически симметричных s-орбиталей (s–s-взаимодействие).
Атомы с s-валентными электронами способны образовывать одинаково простые связи в любом направлении, и все направления при этом будут равноценны.
В НС1 ковалентная связь образуется при перекрывании s-орбитали атома водорода и одной р-орбитали хлора (s–p-взаимодействие). Молекула имеет линейную форму.
В молекуле воды каждый из двух неспаренных 2р-электронов кислорода взаимодействует с s-электроном водорода. Орбитали 2p-электронов кислорода взаимно перпендикулярны, поэтому следовало бы ожидать, что при максимальном перекрывании валентный угол между связями должен быть равен 90°. Однако экспериментально найденный валентный угол между связями равен 104,5°. Такое отклонение можно объяснить взаимным отталкиванием не связанных непосредственно между собой атомов водорода. Молекулы, подобные воде, называются угловыми.
В молекуле NH3 три ковалентные связи сформированы в результате перекрывания трех 2р-орбиталей атома азота и s-орбиталей трех атомов водорода. Связи располагаются вдоль трех осей p-орбиталей, поэтому молекула имеет пирамидальную форму, где в вершине располагается атом азота, а в углах основания – атомы водорода.
Ковалентные связи, образованные вследствие перекрывания орбиталей вдоль линии, проходящей через центры ядер взаимодействующих атомов, называются σ-связями. На рис. 11 показаны пути формирования σ-связей при взаимодействии двух s- (a); s- и р- (б) и двух р-орбиталей (в).
Если связи формируются при перекрывании орбиталей по обе стороны от линии, соединяющей центры взаимодействующих атомов, то они называются π-связями рис. 11, г).
Электроны s-орбиталей могут участвовать лишь в σ-связывании, p-электроны – в σ- и π-связывании.
Если атомы в молекуле связаны не одинарной, а кратной связью (двойной или тройной), го только одна из этих связей является σ-связью.
В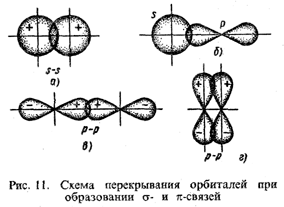 молекуле азота N≡N из трех связей одна σ-связь (рх-рх) и две π-связи (pz-pz, py-py). молекуле азота N≡N из трех связей одна σ-связь (рх-рх) и две π-связи (pz-pz, py-py).
Поскольку в формировании связей между атомами участвуют электроны различных энергетических состояний, то возникает вполне обоснованный вопрос, касающийся равноценности и прочности этих связей. Так, в возбужденном состоянии у атома бериллия (1s22s12p1) на внешней оболочке имеется два неспаренных электрона. Нужно было ожидать, что в молекуле ВеС12 связи неравноценны, ибо одна из них образуется за счет взаимодействия 2s-электрона бериллия с 3p-электроном хлора, а вторая связь – за счет взаимодействия 2p-электрона бериллия с 3p-электроном второго атома, хлора. Однако экспериментальные данные показывают, что валентный угол в BeCl2 равен 180°, т. е. молекула линейна, а обе связи одинаково прочны.
У возбужденного атома углерода (1s22sl2p3) имеется один 2s-электрон и три 2p-электрона, однако в молекуле ССl4 все четыре связи равноценны, а валентный угол равен 109,5°. Может показаться противоречивым, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Полинг ввел понятие о гибридизации орбиталей, согласно которому химические связи формируются электронами не "чистых", а "смешанных", или гибридных, орбиталей.
Г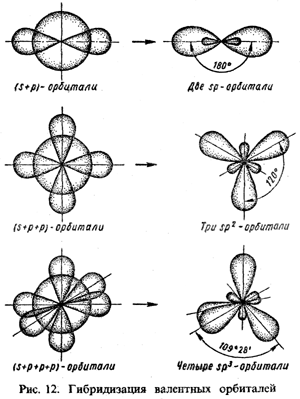 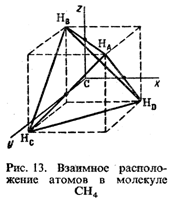 ибридизация – это смешение атомных орбиталей с разными (но близкими) энергетическими состояниями, вследствие которого возникает такое же число одинаковых по форме и энергии орбита лей. ибридизация – это смешение атомных орбиталей с разными (но близкими) энергетическими состояниями, вследствие которого возникает такое же число одинаковых по форме и энергии орбита лей.
При гибридизации взаимно изменяются первоначальная форма и энергия орбиталей, поэтому образовавшиеся гибридные орбитали отличаются от исходных. На рис. 12 показаны различные типы гибридизации атомных орбиталей.
Связь, осуществляемая электронами гибридных орбиталей, значительно прочнее, поскольку перекрывание происходит в большей степени, чем при участии негибридных орбиталей.
Рассмотрим молекулу метана СН4, в которой химическая связь формируется за счет гибридных орбиталей. Выше было показано, что при возбуждении одного электрона углеродного атома из состояния 2s в состояние 2р образуется четыре неспаренных электрона, которым соответствуют четыре гибридные орбитали. Поэтому в данном случае комбинация одной s- -и трех p-орбиталей приводит к sp3-гибридизации. Гибридные орбитали симметрично направлены под углом 109,5°, что соответствует тетраэдрической форме. Перекрывание гибридных орбиталей с 1s-орбиталями водорода приводит к тетраэдрической молекуле метана (рис. 13).
Аналогичное строение имеют СС14, CF4, NH4+ и т. д.
Полярность проявляется, как уже говорилось, при образовании ковалентной связи между атомами с разной электроотрицательностью. При этом следует различать полярность связи и полярность молекул, Не всякая полярная связь приводит к образованию полярной молекулы. Двухатомные молекулы сложных веществ НС1, НВr, СО и т. п. всегда полярны. Для появления полярности необходимо, чтобы центры распределения положительных и отрицательных зарядов не совпадали. В молекуле СО2 связи углерод–кислород полярны, причем на атоме углерода находится некоторый положительный заряд, а на каждом из атомов кислорода–такой же отрицательный заряд. Следовательно, на атоме углерода сосредоточен центр положительного заряда. Поскольку атомы кислорода расположены на одной прямой по обе стороны от атома углерода (молекула линейная) на равных расстояниях, положительный заряд нейтрализуется. Таким образом, несмотря на полярность каждой связи в СО2, вся молекула в целом является неполярной и причиной этого является ее линейное строение. Наоборот, молекула Н–C≡N полярна, так как связи углерод–водород и углерод–азот имеют различную длину и различную полярность.
Следует различать также полярность связи и ее поляризуемость.
Поляризуемость связи – это способность становиться полярной или еще более полярной. Этот процесс происходит как под воздействием внешнего электрического поля, так и под влиянием другой молекулы, являющейся партнером по реакции. Результатом этих воздействий может быть поляризация связи, сопровождающаяся ее полным разрывом. Связующая пара электронов при этом остается у более электроотрицательного атома, что приводит к образованию разноименных ионов. Такой тип разрыва связи называется гетеролитическим.
Например:Вследствие такого ассиметрического разрыва связи образуется ион Н+, а хлор переходит в анион Cl-.
В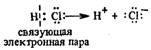 некоторых молекулах с ковалентными связями соединяющиеся атомы поставляют на образование связей неодинаковое число электронов. Поэтому числовое значение валентности не совпадает с числом неспаренных электронов. Подобное несоответствие наблюдается, когда один из взаимодействующих атомов имеет свою пару электронов, а другой – свободную орбиталь, иными словами, у одного атома имеются неподеленные пары электронов, а у второго – вакантные орбитали. Рассмотрим взаимодействие аммиака с хлороводородом: NH3 + HCl = NH4Cl некоторых молекулах с ковалентными связями соединяющиеся атомы поставляют на образование связей неодинаковое число электронов. Поэтому числовое значение валентности не совпадает с числом неспаренных электронов. Подобное несоответствие наблюдается, когда один из взаимодействующих атомов имеет свою пару электронов, а другой – свободную орбиталь, иными словами, у одного атома имеются неподеленные пары электронов, а у второго – вакантные орбитали. Рассмотрим взаимодействие аммиака с хлороводородом: NH3 + HCl = NH4Cl
или: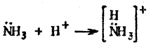 Неподеленная пара электронов азота смещается к иону водорода Н+ (протону), у которого имеется вакантная ls-орбиталъ. Атом азота как поставщик двухэлектронного облака называется донором, а Н+-ион, имеющий свободную, вакантную, орбиталь и принимающий эту электронную пару, – акцептором. Таким образом, электронная пара донора переходит в общее пользование между ним и акцептором. Такой механизм образования ковалентной связи называют координационно-ковалентным или донорно-акцепторным. Неподеленная пара электронов азота смещается к иону водорода Н+ (протону), у которого имеется вакантная ls-орбиталъ. Атом азота как поставщик двухэлектронного облака называется донором, а Н+-ион, имеющий свободную, вакантную, орбиталь и принимающий эту электронную пару, – акцептором. Таким образом, электронная пара донора переходит в общее пользование между ним и акцептором. Такой механизм образования ковалентной связи называют координационно-ковалентным или донорно-акцепторным.
В образовавшемся ионе аммония атому азота принадлежит на один электрон меньше, чем в несвязанном. Он заряжен положительно, а валентное состояние аналогично состоянию углерода в метане.
Связи N–Н, образованные по различным механизмам, равноценны по своим характеристикам
|
БИЛЕТ № 11 Ионная связь. Ненаправленность и ненасыщаемость. Свойства веществ с ионной связью. Примеры.
Ионная связь. Ионная связь образуется между атомами элементов, сильно отличающихся по электроотрицательности, например между атомами элементов IА- IIА и VIА- VIIА групп. Один из этих атомов с легкостью отдает валентные электроны, превращаясь в положительно заряженный катион, другой атом эти электроны принимает, превращаясь в отрицательно заряженный анион. Противоположно заряженные ионы притягиваются согласно закону Кулона силами электростатического притяжения.
Ионы, образованные в результате перехода электронов от одного атома к другому при их химическом взаимодействии, имеют электронную конфигурацию благородных (инертных) газов. Соединения, образованные посредством ионной связи называются гетерополярными или ионными соединениями. Ионных соединений сравнительно немного, в твердом состоянии они состоят из закономерно расположенных катионов и анионов, т.е. имеют ионную кристаллическую решетку. Ионная связь не обладает направленностью и насыщаемостью.
Различие в электроотрицательности взаимодействующих атомов приводит к образованию полярной связи вследствие смещения электронной плотности связующего электронного облака к более электроотрицательному атому. Если же различие между атомами очень велико, то можно говорить о полном переходе электронной пары к более электроотрицательному атому. Упрощенно это сводится к переходу электрона от одного атома к другому, например, при образовании хлорида натрия NaCl. Взаимодействие атомов натрия и хлора в соответствии с теорией ионной связи сопровождается переносом электрона от натрия к хлору. Нейтральный атом натрия, теряя электрон, превращается в положительно заряженный ион (катион), а атом хлора, приобретая электрон, – в отрицательно заряженный ион (анион). Известно, что на внешнем уровне щелочные металлы содержат по одному s-электрону. У них на один электрон больше, чем у атомов предшествующих благородных газов. Поскольку щелочные металлы характеризуются малой энергией ионизации, они легче всего образуют катионы. Аналогично ведут себя и щелочно-земельные металлы.
У галогенов – элементов главной подгруппы VII группы – электронные конфигурации внешних оболочек одинаковые и выражаются формулой s2p5.Это значит, что до восьмиэлектронной оболочки у галогенов не хватает по одному электрону. Поэтому при образовании соединения атомов щелочного металла и галогена перенос электрона схематически может быть показан так:
Na0 – e–→Na+
Cl–+e–→Cl–
Вследствие этого процесса образуются противоположно заряженные ионы, которые далее взаимодействуют друг с другом за счет электростатического притяжения.
Химическая связь, в основе которой лежит электростатическое взаимодействие ионов, называется ионной.
Для натрия характерно образование устойчивого иона Na+, обладающего электронным строением предшествующего ему благородного газа неона. У иона же хлора строение внешней оболочки соответствует конфигурации благородного газа аргона.
При образовании ионной связи все же не происходит идеально полного перехода электронов, что служит подтверждением единой природы ковалентной и ионной связи. Поэтому последнюю считают предельным случаем полярной связи.
Экспериментально доказано, что при взаимодействии наиболее электроположительных и электроотрицательных элементов возникает связь преимущественно ионного характера.
Все устойчивые одноатомные анионы имеют электронное строение соответствующего для данного периода благородного газа, а простейшие катионы имеют электронное строение благородного газа, предшествующего данному периоду (сравните, например, Na+ и Ne, К+ и Ar и т. д.). В отличие от ковалентной ионная связь не обладает ни направленностью, ни насыщаемостью. Силы притяжения между зарядами не зависят от направления, по которому эти заряды сближаются (отсутствие направленности). Кроме того, два разноименных иона, связанные силами притяжения, не теряют своей способности взаимодействовать с ионами противоположного знака. В этом и проявляется отсутствие насыщаемости у ионной связи. Следствием этой особенности ионной связи является ассоциация всех ионов с образованием ионного кристалла, в котором каждый ион окружен ионами противоположного знака. Число ионов противоположного знака, удерживающихся данным ионом на ближайшем расстоянии, получило название координационного числа данного иона. Ионы могут удерживать также и нейтральные молекулы. При большом размере катиона и малом радиусе аниона (соотношение rкат. : rан. > 0,73) вокруг катиона (аниона) координирует 8 анионов (катионов). В результате образуется кристалл так называемой кубической структуры – 8 ионов одного знака располагаются в вершинах куба, в центре которого находится ион противоположного знака (тип CsCl; рис. 14).
При соотношении rкат. : rан. < 0,73 реализуется так называемая октаэдрическая координация ионов: каждый ион окружен 6 противоионами (тип NaCl; рис. 15).
К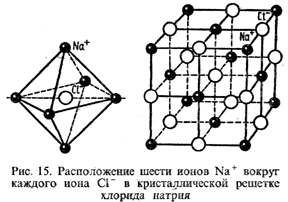 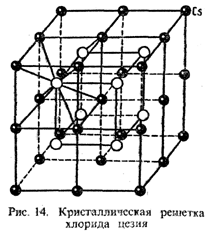 ак правило, ионные связи очень прочны, а поскольку они простираются по всему объему кристалла, твердые кристаллические вещества ионного типа оказываются весьма тугоплавкими, высокопрочными, но хрупкими. Они растворяются только в наиболее полярных растворителях (например, воде). Формулы, которые обычно приписывают ионным веществам (NaCl, CaF2, A12(SO4)3, LiF и т.д.), отражают лишь состав, но ничего не говорят о строении кристалла, о расположении ионов в веществе. ак правило, ионные связи очень прочны, а поскольку они простираются по всему объему кристалла, твердые кристаллические вещества ионного типа оказываются весьма тугоплавкими, высокопрочными, но хрупкими. Они растворяются только в наиболее полярных растворителях (например, воде). Формулы, которые обычно приписывают ионным веществам (NaCl, CaF2, A12(SO4)3, LiF и т.д.), отражают лишь состав, но ничего не говорят о строении кристалла, о расположении ионов в веществе.
|
БИЛЕТ № 12 Водородная связь. Межмолекулярные взаимодействия. Атом водорода в соединении с атомом элемента с высокой электроотрицательностью (F, O, N и др.), способен к образованию водородной связи. В такой молекуле электронная пара сильно смещена от водорода и он, в отсутствии электронов, представляет собой положительно заряженный протон, который притягивается отрицательно заряженными концами диполей или анионами. В результате образуется более слабая, чем ковалентная (в 10- 15 раз) связь, называемая водородной. Для этой связи характерны насыщаемость и направленность. Эта связь обозначается тремя точками. Водородная связь существует между молекулами многих органических соединений (фенолов, карбоновых кислот, спиртов, альдегидов и др.) и играет важную роль в жизненно важных биохимических процессах.
В веществах с молекулярной структурой проявляются силы межмолекулярного взаимодействия - Ван-дер-Ваальсовы силы. В основе этих сил лежит электростатическое взаимодействие молекулярных диполей….
Существование веществ в различных агрегатных состояниях свидетельствует о том, что между частицами (атомами, ионами, молекулами) имеет место взаимодействие, обусловленное ван-дер-ваальсовыми силами притяжения. Они названы, в честь голландского физика Ван-дер-Ваальса (1837–1923), который предложил уравнение состояния газов, учитывающего межмолекулярное взаимодействие.Наиболее важной и отличительной чертой ван-дер-ваальсовых сил является их универсальность, так как они действуют без исключения между всеми атомами и молекуламиИсходя из современных представлений о строении атома, можно обосновать невозможность существования гипотетической молекулы Не2, однако это еще не говорит о том, что между атомами гелия вообще отсутствует всякое взаимодействие, Так как гелий и вообще благородные газы удается перевести в жидкое и даже твердое состояние, то уже это свидетельствует о наличии между атомами благородных газов сил притяжения. Чрезвычайно низкие температуры, необходимые для перевода благородных газов в жидкое состояние, подтверждают, что эти силы весьма незначительны.Существует несколько объяснений природы ван-дер-ваальсовых сил, важнейшим из которых является электростатическое взаимодействие, которое основывается на том, что хотя атомы или молекулы в целом электронейтральны, все же в них вследствие орбитального движения электронов постоянно возникают мгновенные электрические дипольные моменты. Взаимодействие мгновенного и индуцированного дипольных моментов называется дисперсионным.Существуют молекулы, обладающие постоянным электрическим дипольным моментом. Они могут взаимодействовать как с аналогичными молекулами, так и с неполярными, но способными к поляризации. Это явление называется ориентационным взаимодействием.Если полярная и неполярная молекулы приходят в соприкосновение, то под влиянием полярной молекулы неполярная поляризуется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы. Такое взаимодействие называется индукционным.Рассмотренные типы взаимодействия относятся к электростатическому взаимодействию.Одной из разновидностей взаимодействия между полярными молекулами является водородная связь. Данная связь формируется между молекулами типа НХ, где X – F, О, N, C1, Вr, I или группа атомов, например, ОН. Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполей взаимодействуют между собой так, что ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы (рис. 16):
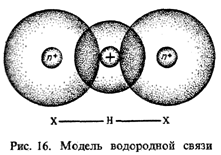
Рассмотрим образование водородной связи на примере воды. Здесь водород оказывается одновременно стянутым к кислороду второй молекулы:
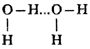 водород второй молекулы стянут к кислороду третьей молекулы и т д.: водород второй молекулы стянут к кислороду третьей молекулы и т д.:
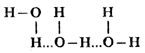 Водородную связь обозначают тремя точками. Водородную связь обозначают тремя точками.
Рассмотренный на примере воды вид водородной связи называется межмолекулярной водородной связью.
Образование водородных связей играет важную роль, как в химических, так и в биологических системах. Существование водородных связей в воде чрезвычайно важно для биологических процессов, так как свойства воды (температура кипения и кристаллизации) в значительной мере определяются наличием системы связей О–Н...О–Н. Благодаря водородным связям вода имеет температуру кипения гораздо выше, чем следовало бы ожидать по ее молекулярной массе, а температура плавления воды почти на 200° С превышает ожидаемую на основании ее молекулярной массы.
| |
|
|
 Скачать 0.71 Mb.
Скачать 0.71 Mb.