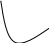Билет 13
 Скачать 104.01 Kb. Скачать 104.01 Kb.
|
Билет №131) Для обратимой реакции  А А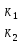 В + Q В + QК1 и Е1 константа скорости и энергия активации прямой реакции К2 и Е2 константа скорости и энергия активации обратной реакции Какое заключение справедливо А) Е2> Е1 Б) Е1< Е2 В) Энергии активации Е1 и Е2 равны Г) Правильных ответов нет 2) На рисунке приведены зависимости скорость – степень превращения для реакций А ↔ В и А → В. Какой график соответствует обратимой реакции.    Г Г2 1  1 Х 1 ХА) 2 Б) 1 В) Правильного ответа нет Пояснение: Обратимая реакция будет протекать не до полного превращения исходного вещества, а до равновесной степени превращения 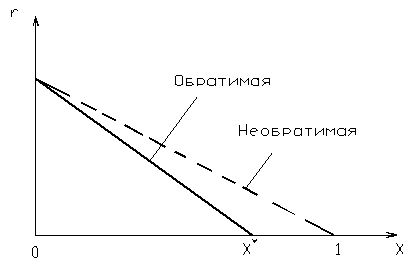 Зависимость скорости обратимой и необратимой реакции первого порядка от степени превращения. 3) В процессе водоподготовки на химическом предприятии метод ионного обмена применяется для: А) обеззараживания воды Б) коагуляции взвешенных частиц В) дегазации Г) правильных ответов нет Пояснение: Метод ионного обмена представляет собой обратимую химическую реакцию, в процессе которой ионы загрязнителя заменяются на нейтральные. Это самый эффективный и экономичный способ умягчения жёсткой воды. В качестве фильтрующей среды используются специальные полимерные смолы, которые заменяют ионы солей кальция и магния на ионы натрия. 4) На каком графике приведена зависимость константы равновесия Кр от температуры для обратной эндотермической реакции А⇄ В – Q
1 2 3 4 Варианты ответа: А) 1 Б) 2 В) 3 Г) 4 Пояснение: По уравнению изобары Вант-Гоффа возможны следующие случаи: -если 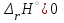 , то , то 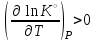 , значит, с повышением температуры константа равновесия увеличивается и химическое равновесие смещается в сторону образования продуктов; , значит, с повышением температуры константа равновесия увеличивается и химическое равновесие смещается в сторону образования продуктов;-если 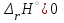 , то , то 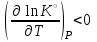 , следовательно, с ростом температуры константа равновесия уменьшается и равновесие смещается в сторону образования исходных веществ; , следовательно, с ростом температуры константа равновесия уменьшается и равновесие смещается в сторону образования исходных веществ;-если 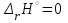 , то константа равновесия не зависит от температуры. , то константа равновесия не зависит от температуры.Как как данная реакция эндотермическая, ей отвечает возрастающий график. 5) Какое из приведенных уравнений можно использовать для расчета мгновенной селективности φ для сложной параллельной реакции :  А К1 В – целевая А К1 В – целевая 2А К2 В 2А К2 ВК1 [мин-1], K2 [л/(моль·мин)] А) 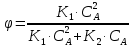 Б) 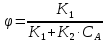 В) 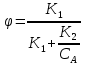 Г) Правильных ответов нет Пояснение: Для анализа соотношения скоростей целевого и побочных процессов пользуются мгновенной, или дифференциальной, селективностью, равной отношению скорости расходования реагента А на целевую реакцию к общей скорости расходования реагента и на целевую, и на побочные реакции. По размерностях констант скоростей реакций определяем, что целевая реакция имеет по исходному реагенту А порядок n=1, а побочная реакция – п=2, тогда 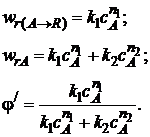 6) Как связаны технологические параметры селективность Ф, выход продукта ƞ и степень превращения исходного вещества 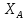 в сложной реакции в сложной реакции 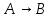 – целевая – целевая 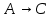 А) ƞ = Ф · 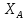 Б) Ф = ƞ · 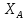 В) 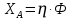 Г) Правильного ответа нет Пояснение: Выход определяется двумя параметрами — степенью превращения (конверсии) исходного реагента и селективностью. Степень превращения показывает, какая доля исходного реагента была израсходована в ходе проведения процесса. Селективность же определяет, какая доля израсходованного реагента пошла на образование целевого продукта. Между выходом продукта , селективностью процесса Ф в отношении образования В и степенью превращения (конверсии) 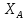 исходного реагента A существует простая взаимосвязь: исходного реагента A существует простая взаимосвязь:ƞ = Ф · 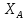 7) Степень превращения (конверсия) сырья это: А) отношение количества превращенного сырья (исходных реагентов) к количеству введенного в процесс сырья Б) отношение количества исходного реагента, превратившегося в целевой продукт к количеству реагента введенного в процесс В) отношение количества исходного сырья, превратившегося в целевой продукт, к общему количеству прореагировавшего сырья Г) отношение количества поступившего в процесс сырья к количеству сырья Пояснение: Степень превращения - это отношение количества вещества, вступившего в реакцию, к его исходному количеству. Допустим, протекает простая необратимая реакция типа 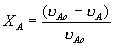 Чем выше степень превращения, тем большая часть исходного сырья вступила в реакцию, и полнее прошёл процесс химического превращения 8) Как выглядит зависимость мгновенная селективность φ степень превращения исходного реагента ХА для сложной параллельной реакции:  А К1 В  2А К2 С – целевая К1[мин-1] К2[л/моль *мин]
9) Первой стадией в процессе водоподготовки на химическом предприятии является стадия А) осветвление Б) удаление крупных механических примесей В) дегазация Г) обеззараживание 10) Для обратимой реакции А ↔ В известна константа равновесия Кр=0,87. Возможно ли протекание реакции при температуре Т = 600 ̊ К. А) Да Б) Нет В) Требуется Т = 400 ̊ К Г) Правильных ответов нет 11) Для реакции 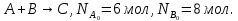 Количество продукта С Количество продукта С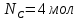 . Оцените выход продукта . Оцените выход продукта 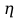 и степень реагента А. и степень реагента А. А) 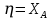 Б) 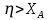 В) 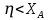 Г) Правильного ответа нет 12) Гетерогенный процесс в системе газ (А) – жидкость (В). Каким законом описывается газожидкостное равновесие на межфазной поверхности? 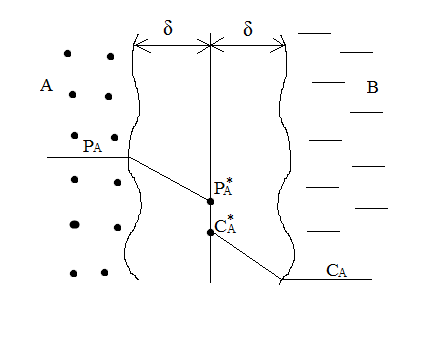 А) Законом Дальтона Б) Законом Генри В) Законом Аррениуса Г) Правильного ответа нет 13) Константа скорости жидкофазной реакции с размерностью [ 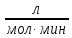 ] соответствует реакции с порядком ] соответствует реакции с порядком1) 0 2) 1 3) 2 Пояснение: Размерность константы скорости реакции зависит от порядка реакции. Если концентрация реагирующих веществ измерена в моль/л (M): Для реакции первого порядка k имеет размерность 1/t; Для реакции второго порядка k имеет размерность л/(моль·t) или 1/(M·t); Для реакции третьего порядка k имеет размерность л2/(моль2·t) или 1/(M2·t). Где t – единицы измерния времени. 14) Реакция протекает в газовой фазе А ↔2В, при известной константе равновесия Кр и давлением Р в системе рассчитана равновесная степень превращения 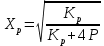 , как увеличить , как увеличить 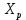 ? ?А)Увеличить давление Б)Увеличить температуру В)Понизить давление Г)Понизить температуру 15) В основе процесса лежат основная и параллельная побочная реакции, необратимые в широком диапазоне условий. Энергии активации реакций практически одинаковы. Порядок основной реакции меньше порядка побочной. Каков путь реализации принципа наилучшего использования сырья? А) повышение температуры Б) понижение температуры В) повышение давления Г) понижение давления |