Билеты по микробиологии
 Скачать 17.11 Mb. Скачать 17.11 Mb.
|
Биологическое значение сверхспирализации ДНКСвехспирализация является важным свойством ДНК, от которого зависит протекание практически всех ДНК-зависимых процессов в клетке, таких какрепликация ДНК, транскрипция и рекомбинация. ДНК в клетках большинства исследованных мезофильных организмов отрицательно сверхспирализована[2]. Отрицательная сверхспирализация способствует облегчению локального плавления двойной спирали, что обеспечивает нормальную инициацию транскрипции и репликации. Напротив, положительная сверхспирализация может препятствовать инициации транскрипции и продвижению репликативной вилки. Особые белки и ферменты поддерживают ДНК в состоянии отрицательной сверхспирализации. В эукариотических клетках ДНК закручена в отрицательные сверхвитки вокруг гистоновых комплексов, у большинства мезофильных архей есть гистоноподобные белки, которые выполняют ту же функцию, а у бактерий за это отвечают белки, ассоциированные с нуклеоидом (например, HU и HNS). Кроме того, существуют специальные ферменты класса изомераз, которые могут изменять топологическое состояние ДНК. Они получили названиетопоизомераз, или ДНК-топоизомераз, и были обнаружены у прокариот, эукариот, а также у некоторых вирусов. Топоизомеразы могут вносить в замкнутую ДНК положительные и отрицательные сверхвитки, а также обеспечивать её релаксацию. Клостридиальные нейротоксины, механизмы действия.     Билет 8. Горизонтальный перенос генов у прокариот. Механизмы. Роль плазмид и транспозонов. Горизонтальный перенос генов (ГПГ) — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. В отличие от горизонтального, о вертикальном переносе генов говорят, если организм получает генетический материал от своего предка. В области интересов генетики основное место занимает вертикальный перенос генов. Однако в настоящее время горизонтальному переносу уделяется всё больше внимания. Искусственный горизонтальный перенос генов используется в генной инженерии. Горизонтальный перенос генов можно выявить по ряду показателей. Во-первых, по нуклеотидному составу ДНК. Отличие в нуклеотидном составе отдельного сегмента от остальной части генома является указанием на присутствие "чужих" генов. Во-вторых, по частоте встречаемости в гене определенных кодонов. Третий важный критерий – существенное отличие в положении анализируемого гена на филогенетическом (эволюционном) дереве от большинства других генов. О "чужеродном" происхождении гена может говорить высокая степень его сходства с гомологичным (т.е. соответствующим) геном из отдаленного таксона при отсутствии подобного гена у близких "родственников". Некоторые общие закономерности горизонтального переноса у прокариот: · Доля латерально полученных генов варьирует у разных видов и может достигать 10-15%. По последним данным, может быть и больше. · Наибольшее количество переносов характерно для свободноживущих бактерий с широкими экологическими ареалами. · Наименьшее число переносов обнаружено у патогенных бактерий, живущих в узких эконишах. · Реже всего в горизонтальные переносы вовлечены гены информационных систем (транскрипции, трансляции, репликации), составляющие базовый геном. Продукты этих генов входят в сложные белковые комплексы, где "чужие" белки не встраиваются или не функционируют. · Чаще всего в горизонтальном переносе участвуют гены, связанные с метаболизмом, транспортными путями и передачей сигналов. · В составе приобретенных сегментов ДНК часто обнаруживаются профаги, плазмиды, гены белков, участвующих в процессах рекомбинации. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации.      Мембранотоксины бактерий, механизмы действия, примеры бактерий-продуцентов. Методы выявления мембранотоксинов in vitro.   Билет 9. Паразитические генетические элементы бактерий: транспозоны, плазмиды, бактериофаги.    Токсины, нарушающие внутриклеточную передачу сигнала: холерный токсин, коклюшный токсин, отечный фактор возбудителя сибирской язвы.    Билет 10. Трансформация у бактерий, естественная и искусственная компетентность реципиентных клеток.      Суперантигены бактерий. Механизм действия. Примеры бактерий-продуцентов.   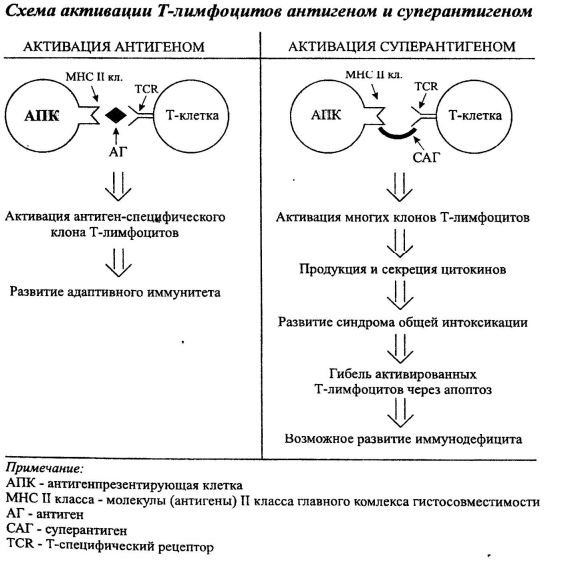  Билет 11. Конъюгация у бактерий, механизм, ее значение для бактериальных популяций.    Эндотоксины. Примеры бактерий, обладающих эндотоксином. Механизм действия.     В отличие от экзотоксинов, эндотоксины характеризуются меньшей специфичностью действия. Эндотоксины всех грамотрицательных бактерий (E.coli, S.Typhi, N.meningitidis, Brucella adortus) угнетают фагоцитоз, вызывают падение сердечной деятельности, гипотонию, повышение температуры тела, гипогликемию. Некоторые бактерии образуют одновременно как экзо-, так и эндотоксины (холерный вибрион, некоторые патогенные кишечные палочки). Билет 12. Трансдукция как вид горизонтального переноса генов, ее виды.    Молекулярные механизмы действия бактериальных токсинов. АДФ-рибозидирующие токсины. Токсины-протеазы.          Билет 13. Бактериофаги, их взаимодействие с бактериальными клетками. Умеренные бактериофаги, фаговая конверсия.       Молекулярные мишени действия бактериальных токсинов. Ингибиторы синтеза белка. Ингибиторы внутриклеточной передачи сигнала.      Билет 14. Генная инженерия прокариот.Ферменты, используемые для создания генетических конструкций: ДНК-лигаза, эндонуклеазы рестрикции.   Ферменты генетической инженерии - это ферменты, позволяющие проводить различные манипуляции с молекулами ДНК: разрезать в определенных местах, соединять различные по происхождению фрагменты, синтезировать новые, не существующие в природе последовательности, и т.д. Рассмотрим основные свойства ферментов, наиболее часто используемых в генно-инженерных работах. ДНК-лигаза В 1961 г. М. Мезельсон и Дж. Вейгл на примере л показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. Эта работа дала импульс поиску ферментов, участвующих в процессе рекомбинации. Вскоре при изучении фагов л и Т4 были выявлены фагоспецифичные нуклеазы, необходимые для осуществления фаговой рекомбинации. Это указывало на правильность предложенной гипотезы о механизме кроссинговера. Начались интенсивные поиски фермента, участвующего в воссоединении расщепленных нуклеазами молекул ДНК. В 1967 г. Независимо в нескольких лабораториях был открыт фермент, названный ДНК-лигазой, который катализирует синтез фосфодиэфирной связи в двухцепочечной ДНК. Удалось обнаружить два типа ДНК-лигаз: фермент, синтезируемый в клетках E.coli, и фермент, появляющийся в клетках E.coli, инфицированных фагом Т4. Они различались по потребностям в кофакторах. ДНК-лигаза E.coli в качестве кофактора требует дифосфопириидиддуклеотид, в то время как лигаза фага Т4- аденозинтрифосфат. Кроме того, ДНК-лигаза фага Т4 в отличии от ДНК-лигазы E.coli способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами, т.е. фрагментов без перекрывающихся одноцепочечных комплементарных участков. Поэтому в настоящее время в генно-инженерных экспериментах предпочитают использовать ДНК-лигазу фага Т4, как более универсальный фермент. ДНК-лигаза фага Т4 является мономерным полипептидом с молекулярной массой 68 кДа и катализирует образование фосфодиэфирной связи между прилегающими 5-фосфатным и 3- гидроксильным концами цепей ДНК. При этом возможны два типа реакций: 1) легирование липких концов; 2) легирование тупых концов. Особенности формирования микрофлоры новорожденных. Влияния типа вскармливания на состав микрофлоры и здоровья ребенка.     Билет 15. Генная инженерия прокариот. Используемые векторы и механизмы доставки генетических конструкций в клетки.     Сравнительная характеристика экзотоксинов и эндотоксина. Структура экзотоксинов.
 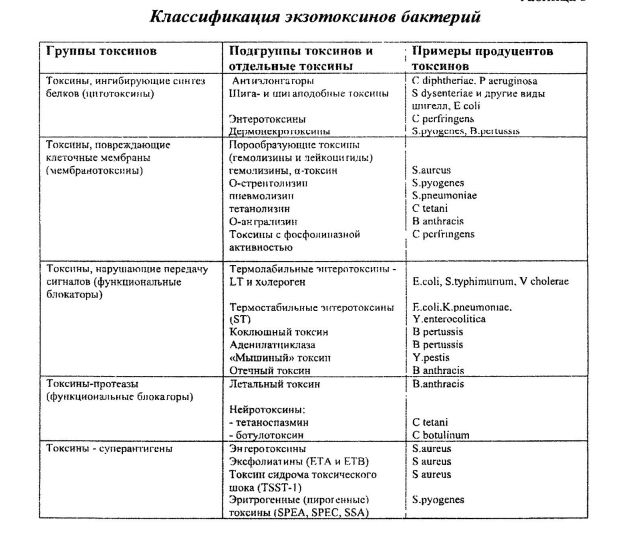   Билет 16. Полимеразная цепная реакция: реакционная смесь, этапы реакции. Праймеры, применяемые для ПЦР.       Структурные элементы бактериальной клетки, принимающие участие в развитии инфекционного процесса.   Билет 17. Полимеразная цепная реакция: применение в диагностике инфекционных заболеваний, достоинства и недостатки.       Исследование методом ПЦР (полимеразной цепной реакции) в диагностике инфекционных заболеваний обладает следующими преимуществами: 1. Прямое определение возбудителей инфекционных заболеваний Метод ПЦР-анализа дает прямое указание на присутствие в забранном у пациента материале специфического участка ДНК возбудителя болезни. В процессе проведения анализа в исследуемом материале выделяется фрагмент ДНК, специфичный, т. е. присущий только конкретному возбудителю - только определенной бактерии или вирусу. Данный участок ДНК уникален и не характерен ни для одной инфекции на земле. 2. Высокая чувствительность ПЦР Обнаружение инфекции возможно даже в том случае, если в забранном у пациента материале содержится лишь одна клетка бактерии или вируса. По сравнению с другими иммунологическими и микробиологическими методами диагностики: чувствительность ПЦР-анализа — 10-100 клеток в пробе, другие методы - 103-105 клеток. 3. Универсальность ПЦР-анализа Для ПЦР-исследования может применяться практически любые материалы, в том чиле недоступные для исследования другими методами: слизь, моча, кровь, сыворотка, мокрота, эякулят, соскоб эпителиальных клеток - поскольку инфекция может содержаться в любых биологических выделениях и тканях. 4. Высокая скорость получения результата ПЦР-анализа Единый для всех метод обработки забранного на анализ у пациента материала, детекции продуктов реакции, автоматизированная ПЦР-амплификация позволяются провести полную ПЦР-диагностику за 4-5 часов. В тоже время, на культуральные методы исследования затрачивается гораздо больше времени — от нескольких дней до нескольких недель, поскольку необходимо выделение, а затем и выращивание возбудителя на культуре клеток. 5. Возможность диагностики любого вида инфекции Высокая чувствительность метода ПЦР позволяет диагностировать инфекцию не только на острой стадии заболевания, но и хронические инфекции и даже наличие единичных бактерий или вирусов. Мазок методом ПЦР позволяет выявить инфекции, которые невозможно обнаружить в мазке на флору: хламидиоз , уреаплазмоз , микоплазмоз , генитальный герпес. К недостаткам ПЦР-диагностики можно отнести: 1. Возможность получения ложноположительного результата ПЦР-анализ может показать положительный результат даже в том случае, если инфекция уже мертва, «убита» антибиотиками, но ее мертвые клетки все еще содержатся в тканях пациента. В действительности же анализ может являться ложноположительным. Неспособность ПЦР «отличить» мертвую инфекцию от живой налагает определенные требования при использовании ПЦР и для контроля эффективности лечения. Основное правило, конечно же, дождаться полного выведения мертвых остатков инфекции из организма, что у среднего человека происходит в течение 4—8 недель. По истечении этого срока после приема последней таблетки антибиотика метод ПЦР можно и нужно использовать для контроля эффективности проведенного лечения. На более ранних сроках контроль излеченности можно произвести только с помощью культурального метода, или посева: признаком неизлеченности могут служить только жизнеспособные размножающиеся микроорганизмы. 2. Особенности диагностики некоторых микроорганизмов Нежелательно использовать ПЦР-анализ для диагностики гарднереллеза , так как гарднереллы — возбудители этого заболевания в небольшом количестве в норме живут во влагалище. ДНК этих бактерий же при использовании ПЦР будет раз за разом находиться. Гарднерелл не должно быть в мазке, и бактериоскопия в данном случае — достаточный метод для диагностики гарднерелллеза и контроля лечения. 3. Изменчивость микроорганизмов Любой микроб обладает способностью изменяться, причем на уровне ДНК. Наиболее яркий пример из этой области — это вирус гриппа. Переболев однажды, на вирус у человека вырабатываются антитела. Чисто теоретически, если мы переболели гриппом хоть один раз, то как и ветряной, второй раз мы болеть не должны. Но болеем мы практически каждый год. В чем причина? Вирус «мутирует», немного «изменяя» свой геном, и наша иммунная система, наши антитела уже «не узнают» старого гостя в новом обличии. Инфекция. Этапы развития инфекционного процесса.     Билет 18. Полимеразная цепная реакция: модификации, способы визуализации результатов.     Визуализация результатов  Основные представители нормальной микрофлорыкишечника человека, их характеристика, Препараты для поддержания нормальной микрофлоры.       Билет 19. Методы секвенирования ДНК (секвенирование по Сэнгеру, высокопроизводительное секвенирование) Секвенирование биополимеров (белков и нуклеиновых кислот — ДНК и РНК) — определение их аминокислотной или нуклеотидной последовательности (от лат. sequentum — последовательность). В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 пар нуклеотидов (next-generation sequencing) и 1000 пар нуклеотидов при секвенировании по Сенгеру. В результате секвенирования перекрывающихся участков ДНК, получают последовательности участков генов, целых генов, тотальной мРНК и даже полных геномов организмов. |
