|
|
Билеты по микробиологии
Билеты по микробиологии
Билет 1.
Реализация генетической информации у прокариот: транскрипция, трансляция. Оперонная структура.
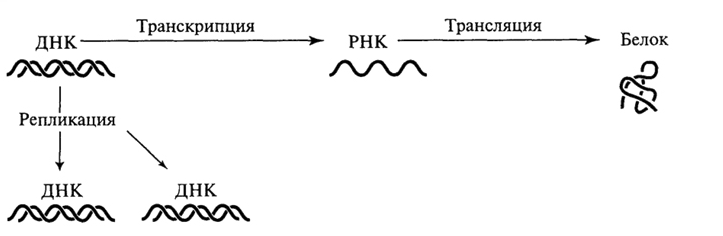
Принципиально важным свойством генетической информации является ее способность к переносу (передаче) как в пределах одной клетки, так и от родительской клетки к дочерним либо между клетками разных индивидуумов в процессах клеточного деления и размножения организмов. Что касается направлений внутриклеточного переноса генетической информации, то в случае ДНК-содержащих организмов они связаны с процессами репликации молекул ДНК, т.е. с копированием информации, либо с синтезом молекул РНК (транскрипцией) и образованием полипептидов (трансляцией). Как известно, каждый из указанных процессов осуществляется на основе принципов матричности и комплементарности.
Сложившиеся представления о переносе генетической информации по схеме ДНК → РНК → белок принято называть "центральной догмой" молекулярной биологии. Наряду с этим (наиболее распространенным) направлением переноса, который иногда обозначают как "общий перенос", известна и другая форма реализации генетической информации ("специализированный перенос"), обнаруженная у РНК-содержащих вирусов. В этом случае наблюдается процесс, получивший название обратной транскрипции, при котором первичный генетический материал (вирусная РНК), проникший в клетку-хозяина, служит матрицей для синтеза комплементарной ДНК с помощью фермента обратной транскриптазы (ревертазы), кодируемой вирусным геномом. В дальнейшем возможна реализация информации синтезированной вирусной ДНК в обычном направлении. Следовательно, специализированный перенос генетической информации осуществляется по схеме РНК → ДНК → РНК → белок.
Транскрипция является первым этапом общего переноса генетической информации и представляет собой процесс биосинтеза молекул РНК по программе ДНК. Принципиальный смысл этого процесса состоит в том, что информация структурного гена (либо нескольких расположенных рядом генов), записанная в форме нуклеотидной последовательности кодирующей нити ДНК в ориентации 3'→ 5', переписывается (транскрибируется) в нуклеотидную последовательность молекулы РНК, синтезируемой в направлении 5' → 3' на основе комплементарного соответствия дезоксирибонуклеотидов матричной нити ДНК рибонуклеотидам РНК (А-У, Г-Ц, Т-А, Ц-Г).
Транскрипция подразделяется на три основные стадии — инициацию (начало синтеза РНК), элонгацию (удлинение полинуклеотидной цепочки) и терминацию (окончание процесса).
Трансляция как очередной этап реализации генетической информации заключается в синтезе полипептида на рибосоме, при котором в качестве матрицы используется молекула мРНК (считывание информации в направлении 5' → 3'). В клетках прокариот, не имеющих настоящего ядра с оболочкой, хромосомный генетический материал (ДНК) практически находится в цитоплазме, что определяет непрерывный характер взаимосвязи процессов транскрипции и трансляции. Иными словами, образовавшийся лидирующий 5'-конец молекулы мРНК, синтез которой еще не завершен, уже способен вступать в контакт с рибосомой, инициируя синтез полипептида, т.е. транскрипция и трансляция идут одновременно.
Как и в случае транскрипции, процесс трансляции можно условно подразделить на три основные стадии — инициацию, элонгацию и терминацию.
Для инициации трансляции принципиально важное значение имеет специфичность структурной организации группы идентичных рибосом (полирибосомы, или полисомы), которая может участвовать в синтезе первичной структуры определенной белковой молекулы (полипептида), кодируемой соответствующей мРНК.
В процессе трансляции участвуют также молекулы тРНК, функции которых состоят в транспортировке аминокислот из цитозоля (цитоплазматического раствора) к рибосомам.
Одной из особенностей трансляции у прокариот является включение в пептидную цепь в качестве первой аминокислоты модифицированного метионина - формилметионина, с которого начинаются все вновь синтезированные пептиды. Даже в том случае, когда роль стартового кодона выполняет кодом ГУГ, в обычных условиях шифрующий валин, в первом положении пептида оказывается формилметионин. Стартовый кодон АУГ или ГУГ следует за лидерным участком, который экранируется рибосомой в момент инициации трансляции.
Соединение рибосомы с мРНК обусловлено комплементарным взаимодействием нуклеотидов одной из рРНК с нуклеотидной последовательностью лидера мРНК.
Эта последовательность (Шайна-Дальгарно) располагается на расстоянии 4-7 оснований перед кодоном АУГ и обнаруживается повсеместно в лидерных участках у прокариот.
При соединении 5'-конца мРНК с малой субчастицей рибосомы стартовый кодон обычно оказывается почти в середине экранированного рибосомой фрагмента мРНК, в области, соответствующей ее П-участку.
Оперон — функциональная единица генома у прокариот, в состав которой входятцистроны (гены, единицы транскрипции), кодирующие совместно или последовательно работающие белки и объединенные под одним (или несколькими) промоторами. Такая функциональная организация позволяет эффективнее регулировать транскрипцию этих генов.
Концепцию оперона для прокариот предложили в 1961 году французские ученые Жакоб и Моно, за что получили Нобелевскую премию в 1965 году.
Опероны по количеству цистронов делят на моно-, олиго- и полицистронные, содержащие, соответственно, только один, несколько или много цистронов (генов).
Характерным примером оперонной организации генома прокариот является лактозный оперон, триптофановый, пиримидиновый и bgl опероны уEscherichia coli
Начинается и заканчивается оперон регуляторными областями — промотором в начале и терминатором в конце, кроме этого, каждый отдельный цистрон может иметь в своей структуре собственный промотор и/или терминатор.
Пути передачи инфекции и механизмы заражения. Виды инфекций в зависимости от источника инфекции.
Пусковым элементом эпидемиологического процесса является источник инфекции.
Источник инфекции – это экологическая система, в которой возбудитель нашел естественную среду обитания, где он способен размножаться и выделяться в окружающую среду в жизнеспособном состоянии. Инфекции, источником которых является только человек, называются антропонозными (например, брюшной тиф), а если источником являются животные – зоонозными (например, бруцеллез). Инфекции, источником которых является окружающая среда, называются сапронозными.
Механизм передачи (заражения) – способ перемещения возбудителя от источника инфекции в восприимчивый организм.
Механизм передачи включает 3 этапа:
- выведение возбудителя из источника инфекции;
- пребывание возбудителя в объектах окружающей среды, которые называются факторами передачи;
- проникновение возбудителя в чувствительный организм.
Различают следующие механизмы передачи:
- фекально-оральный;
- аэрогенный (респираторный);
- кровяной;
- контактный;
- вертикальный (трансплацентарный).
Факторы передачи обеспечивают путь передачи возбудителя в чувствительный механизм, т.е. третий этап механизма передачи (МП).
Для фекально-орального МП возможны водный, пищевой (алиментарный) и контактно-бытовой (через предметы перехода).
Для аэрогенного – воздушно-капельный и воздушно-пылевой.
Для кровяного – через укусы кровососущих членистоногих (трансмиссивный).
Для контактного – контактно-бытовой и контактно-половой.
Для вертикального – трансплацентарный.
Инфекции в зависимости от механизма передачи подразделяются на:
Инфекции с фекально-оральным механизмом;
Респираторные инфекции;
Инфекции с кровяным механизмом передачи;
Инфекции наружных покровов;
Инфекции, передаваемые половым путем.
Билет 2.
Генотипическая и фенотипическая изменчивость бактерий. Регуляция экспрессии генов.



В 1961 году Жакоб и Моно установили, что у бактерий под контролем гена-регулятора синтезируется белок-репрессор, который регулирует активность других генов. Белок-репрессор связывается с геном-оператором и блокирует его, вследствие чего транскрипция (считывание информации) становится невозможной и клетка не может синтезировать соответствующие белки. Но если в клетку проникает какой-либо субстрат, для расщепления которого необходимо синтезировать ферменты, то происходит следующее: субстрат присоединяется к репрессору и лишает его способности блокировать ген-оператор.
К ДНК присоединяются РНК-синтезирующие ферменты и начинается транскрипция генов. Синтез белка-фермента прекращается, если субстрат полностью расщепляется, белок-репрессор освобождается и снова блокирует гены-операторы. Это пример регуляции по типу индукции. Также существует регуляция по типу репрессии: когда конечные продукты биохимической реакции, соединяясь с неактивным белком-репрессором, образуют комплекс, блокирующий работу гена-оператора.
Антитерминация – заключается в том, что происходит игнорирование терминальных кодонов, процесс экспрессии продолжается.
Изучение регуляции генной активности у прокариот привело французских микробиологов Ф. Жакоба и Ж. Моно к созданию (1961) оперонной модели регуляции транскрипции. Оперон — это тесно связанная последовательность структурных генов, определяющих синтез группы белков, которые участвуют в одной цепи биохимических преобразований. Например, это могут быть гены, которые детерминируют синтез ферментов, участвующих в метаболизме какого-либо вещества или в синтезе какого-то компонента клетки. Оперонная модель регуляции экспрессии генов предполагает наличие единой системы регуляции у таких объединенных в один оперон структурных генов, имеющих общий промотор и оператор.
Особенностью прокариот является транскрибирование мРНК со всех структурных генов оперона в виде одного полицистронного транскрипта, с которого в дальнейшем синтезируются отдельные пептиды.
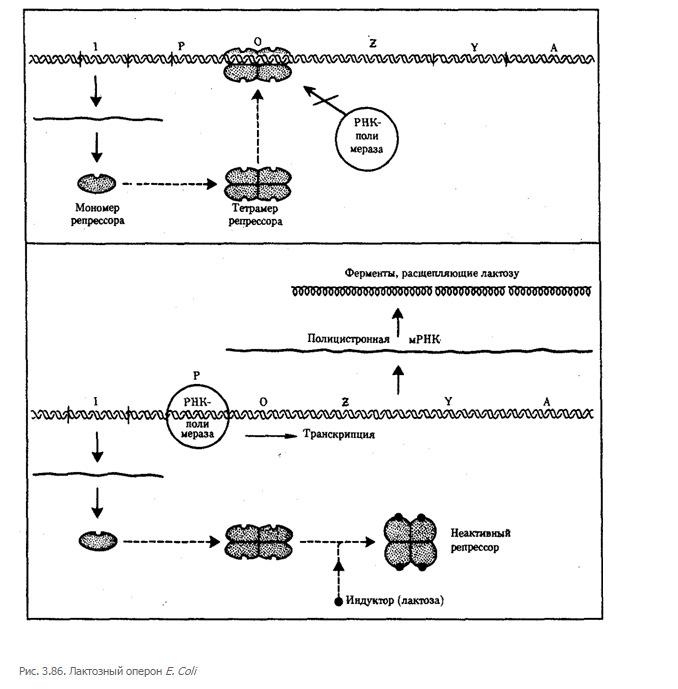
Примером участия генетических и негенетических факторов в регуляции экспрессии генов у прокариот может служить функционирование лактозного оперона у кишечной палочки Е. colt (рис. 3.86). При отсутствии в среде, на которой выращиваются бактерии, сахара лактозы активный белок-репрессор, синтезируемый геном-регулятором (I), взаимодействует с оператором (О), препятствуя соединению РНК-полимеразы с промотором (Р) и транскрипции структурных генов Z, Y, А. Появление в среде лактозы инактивирует репрессор, он не соединяется с оператором, РНК-полимераза взаимодействует с промотором и осуществляет транскрипцию полицистронной мРНК. Последняя обеспечивает синтез сразу всех ферментов, участвующих в метаболизме лактозы. Уменьшение содержания лактозы в результате ее ферментативного расщепления приводит к восстановлению способности репрессора соединяться с оператором и прекращению транскрипции генов Z, Y, А.
Таким образом, регуляция экспрессии генов, организованных у прокариот в опероны, является координированной. Синтез полицистронной мРНК обеспечивает одинаковый уровень синтеза всех ферментов, участвующих в биохимическом процессе.
Патогенность и вирулентность бактерий. Факторы патогенности.





Билет 3.
Генетические основы резистентности к антибактериальным препаратам.
Известно, что резистентность микроорганизмов к антибиотикам может быть природной и приобретенной . Природная резистентность является постоянным видовым признаком микроорганизмов . Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика либо недоступностью мишени вследствие первично низкой проницаемости или ферментативной инактивации . При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Встречаются ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. При этом приобретенная резистентность не всегда сопровождается снижением клинической эффективности антибиотика . Формирование резистентности во всех случаях обусловлено генетически, за счет приобретения новой генетической информации или изменения уровня экспрессии собственных генов.
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
1.Модификация мишени действия.
2.Инактивация антибиотика.
- Активное выведение антибиотика из микробной клетки (эффлюкс).
- Нарушение проницаемости внешних структур микробной клетки.
- Защита мишени.
.Модификация мишени действия антибиотика. Структура мишеней действия антибиотика подвержена изменчивости в результате мутаций в кодирующих их генах. Часть таких изменений может привести к снижению (или утрате) способности мишени связываться с антибиотиком.
. Инактивация антибиотика. Механизмы инактивации (ферментативного разрушения) существовали у бактерий задолго до начала использования этих веществ в качестве антибактериальных препаратов. Скорее всего, они выполняли функции защиты от собственного антибиотика. В последующем детерминанты резистентности распространились среди возбудителей инфекционных болезней.
. Активное выведение антибиотика из микробной клетки (эффлюкс). Известны, как минимум, четыре больших семейства транспортных систем, обеспечивающих активное выведение экзогенных веществ (в том числе и антибиотика) из бактериальной клетки. «Базовая» активность этих систем во многом определяет уровень природной чувствительности бактерий к антибиотику. При активации выведения отмечают формирование приобретенной резистентности.
. Нарушение проницаемости оболочки микробной клетки. Этот механизм распространен, в основном, среди грамотрицательных бактерий, обладающих внешней мембраной и является наименее специфичным в отношении антибиотиков разных групп. Транспорт гидрофильных антибиотиков внутрь микробной клетки осуществляется через пориновые каналы. При нарушении структуры пориновых каналов или их утрате эффективность транспорта антибиотика резко снижается, что проявляется в формировании устойчивости к нескольким классам препаратов.
. Защита мишени. Защита мишени относится к наименее изученным механизмам антибиотикорезистентности. Установлено, что бактерии способны синтезировать белки, предотвращающие связывание антибиотика с мишенью, причем известно, что указанные белки связываются не с антибиотиком, а с мишенью действия и каким-то образом модифицируют ее. Ранее этот механизм был известен только для тетрациклинов, однако сравнительно недавно он был описан и для хинолонов.
Мутации приводят к изменениям структурных белков (например, в структуре 30 S субъединиц рибосом, поринов или пенициллин-связывающих белков клеточной стенки) и ферментов (например, ДНК-зависимых РНК-полимераз или ДНК-гираз). Также возможны мутации в локусе гена, кодирующего чувствительность к ЛС.
Спонтанные мутации, наблюдаемые с частотой от 107 до 10"1г, играют очень незначительную роль в формировании резистентности.
Селекция штаммов. На фоне применения антибактериального средства часто происходит селекция штаммов, способствующая выживанию и последующему доминированию в популяции бактерий с резистентностью к ЛС. Подобным путём ряд штаммов золотистого стафилококка вырабатывает устойчивость к метициллину. Эти штаммы известны как MRSA [от англ. methicillin resistant S. aureus].
Факторы и механизмы антифагоцитарной защиты, примеры бактерий.



Билет 4.
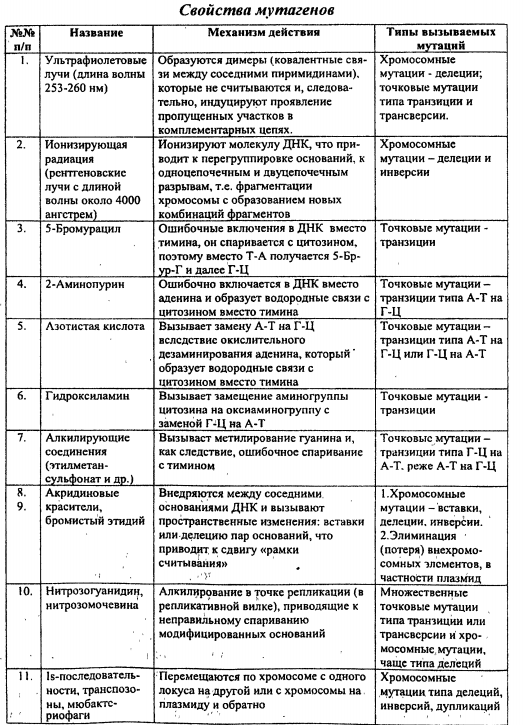
Типы мутаций, механизмы действия физических и химических мутагенов.


Факторы адгезии и инвазии бактерий, примеры. Механизмы инвазии.




Билет 5.
Нарушение структуры ДНК как причина мутаций. Дезаминирование азотистых оснований, пиримидиновые димеры, интеркаляция.
Основные процессы,приводящие к возникновению мутаций - репликация ДНК, нарушения репарации ДНК и генетическая рекомбинация.
Связь мутаций с репликацией ДНК
Многие спонтанные химические изменения нуклеотидов приводят к мутациям, которые возникают прирепликации. Например, из-за деаминирования цитозина напротив него в цепь ДНК может включаться урацил(образуется пара У-Г вместо канонической пары ЦГ). При репликации ДНК напротив урацила в новую цепьвключается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то естьпроисходит транзиция.
Связь мутаций с рекомбинацией ДНК
Из процессов, связанных с рекомбинацией, наиболее часто приводит к мутациям неравный кроссинговер. Онпроисходит обычно в тех случаях, когда в хромосоме имеется несколько дуплицированных копий исходногогена, сохранивших похожую последовательность нуклеотидов. В результате неравного кроссинговера водной из рекомбинантных хромосом происходит дупликация, а в другой - делеция.
Связь мутаций с репарацией ДНК
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке.Для устранения последствий подобных повреждений имеется специальные репарационные механизмы(например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутациивозникают лишь тогда, когда репарационный механизм по каким-то причинам не работает или несправляется с устранением повреждений. Мутации, возникающие в генах белков, ответственных зарепарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению(антимутаторный эффект) частоты мутирования других генов. Так, мутации генов многих ферментов системыэксцизионной репарации приводят к резкому повышению частоты соматических мутаций у человека, а это, всвою очередь, приводит к развитию пигментной ксеродермы и злокачественных опухолей покровов.
Известны четыре основных типа повреждений в ДНК: повреждение одиночных нуклеотидов; повреждение пары нуклеотидов; разрыв цепей ДНК; образование поперечных сшивок между основаниями одной цепи или разных цепей ДНК. Система репарации способна противостоять всем типам повреждений в ДНК, однако механизмы репарации наиболее изучены только в отношении первых двух типов, в основе которых лежат изменения структуры гетероциклических азотистых оснований.
Устранение разрывов в цепях ДНК, вероятно, достигается прямым лигированием с участием ДНК-лигаз, либо в процессе рекомбинации молекул ДНК, а механизмы устранения поперечных сшивок пока не изучены.
Наиболее часто наблюдаемые повреждения нуклеотидов включает окисление, дезаминирование и алкилирование азотистых оснований, образование пиримидиновых димеров, а также вставку нуклеотидов или включение оснований-аналогов (образование неканонических пар оснований), гидролиз N-гликозидных связей между основанием и дезоксирибозой (апуринизация).
Пиримидиновый димер — дефект ДНК, возникающий в результате образования ковалентной связимежду двумя соседними пиримидиновыми основаниями (тимином или цитозином) под действием ультрафиолетовых лучей. Ультрафиолетовые лучи вызывают разрыв двойной связи и образование в этом месте ковалентной связи между двумя нуклеотидами. Образование димера приводит к нарушению транскрипции ДНК на данном участке и возникновению мутаций. Образование димеров является главной причиной возникновения меланомы у человека.
Интеркаляция — это обратимое включение молекулы или группы между другими молекулами или группами.
Существует несколько способов, которыми молекулы (в данном контексте называемые лигандами) могут взаимодействовать с ДНК. Лиганды могут ковалентно, электростатически связываться либо интеркалировать. Интеркаляция возможна в случае, если лиганд имеет подходящие размеры и химическую природу и может поместиться между основаниями ДНК.
Классификация бактериальных токсинов. Химическая природа токсинов.




Билет 6.
Репарация повреждений ДНК у прокариот. Гомологичная рекомбинация.


Генетическая рекомбинация – это взаимодействие между двумя ДНК, обладающими различными генотипами, которое приводит к образованию рекомбинантной ДНК, сочетающей гены обоих родителей.
По молекулярному механизму генетическая рекомбинация у бактерий делится на 3 вида:
- гомологичную;
- сайтспецифическую;
- незаконную.
При гомологичной рекомбинации в процессе разрыва и воссоединения ДНК происходит обмен между участками ДНК, обладающими высокой степенью гомологии. Процесс гомологичной рекомбинации находится под контролем генов, объединенных в REC-систему, состоящую из генов recA, В, С. D. Продукты этих генов производят расплетание нитей ДНК и их периориентацию с образованием полухиазмы, структуры Холидея, а также разрезают структуру Холидея для завершения процесса рекомбинации.
Бактериальные цитотоксины, механизмы действия, примеры бактерий-продуцентов.




Билет 7.
Структура ДНК прокариот. Суперспирализация ДНК. Ферменты, участвующие в ее поддержании.





Сверхспирализация ДНК — явление пере- или недоскручивания топологически замкнутых цепей ДНК, в результате которого ось двойной спирали ДНК сама закручивается в спираль более высокого порядка. Под «топологически замкнутыми» понимают молекулы, свободное вращение концов которых затруднено (кольцевые молекулы ДНК либо линейные молекулы, концы которых зафиксированы белковыми структурами)[1]. Образующаяся в результате сверхспирализации ДНК иногда называется суперскрученной.
Сверхспирализация важна во множестве биологических процессов, таких как, например, компактизация ДНК. Определённые ферменты, в частноститопоизомеразы, обладают способностью изменять топологию ДНК, например для репликации ДНК или транскрипции.
|
|
|
 Скачать 17.11 Mb.
Скачать 17.11 Mb.