Биохимия и ее задачи
 Скачать 1.3 Mb. Скачать 1.3 Mb.
|
Гниение белков и обезвреживание его продуктовГниение белков – это бактериальный распад белковых веществ и АК под действием микрофлоры кишечника. Идет в толстой кишке, однако может наблюдаться и в желудке – при снижении кислотности в нем. Образуются такие продукты: а) токсичные: сероводород H2S, углекислота CO2, аммиак NH3, метан CH4, меркаптаны (CH3SH и его гомологи), бензол C6H6, крезол, индол, скатол и др. б) нетоксичные: спирты (в т.ч. этиловый), амины, жирные к-ты, кетокислоты, витамины (напр., витамин B6). Основные процессы гниения: 1. Декарбоксилирование (–СО2) обычно характерно для диаминомонокрбоновых кислот. Напр., орнитин COOH-CH(NH2)-CH2-CH2-CH2-NH2 превращается в путресцин (то же, но без СООН-группы). Или лизин (ЛИЗ) – в кадаверин (это вроде первой реакции, но в цепи на одну CH2-группу больше). Путресцин, кадаверин входят в состав трупных ядов. Они всасываются и частично выводятся с мочой и обезвреживаются в печени диаминооксидазой. 2. Дезаминирование. При гниении главным образом протекает восстановительное дезаминирование. Напр., аланин (АЛА) NH2-CH(CH3)-COOH + 2Н → СН3-СН2-СООН (пропионовая к-та) +NH3. 3. Десульфирование (тоже восстановительное). Напр., цистеин (ЦИС) NH2-CH(CH2SH)-COOH + 2Н → АЛА + H2S. Напр., метионин (МЕТ) NH2-CH(CH2-СН2-S-CH3)-COOH + 2Н → NH2-CH(CH2-CH3)-COOH (альфа-аминомасляная к-та) + НS-CH3 (метил-меркаптан). 4. Разрушение боковой цепи АК (ТИР, ТРИ). Напр., тирозин (ТИР) + 4Н → крезол (пара-метилфенол) + NH3 + CO2 + CH4; крезол + 2Н → фенол + СН4. Напр., триптофан (ТРИ) + 4Н → скатол (метилиндол) + NH2 + CO2 + CH4. Скатол +2Н→ индол + СН4. Т.о., в процессе гниения АК образуются различные токсичные вещества, которые должны быть обезврежены в печени. В обезвреживании участвуют две системы: 1) УДФГК – уридиндифосфоглюкуроновая к-та (активная форма глюкуроновой к-ты) 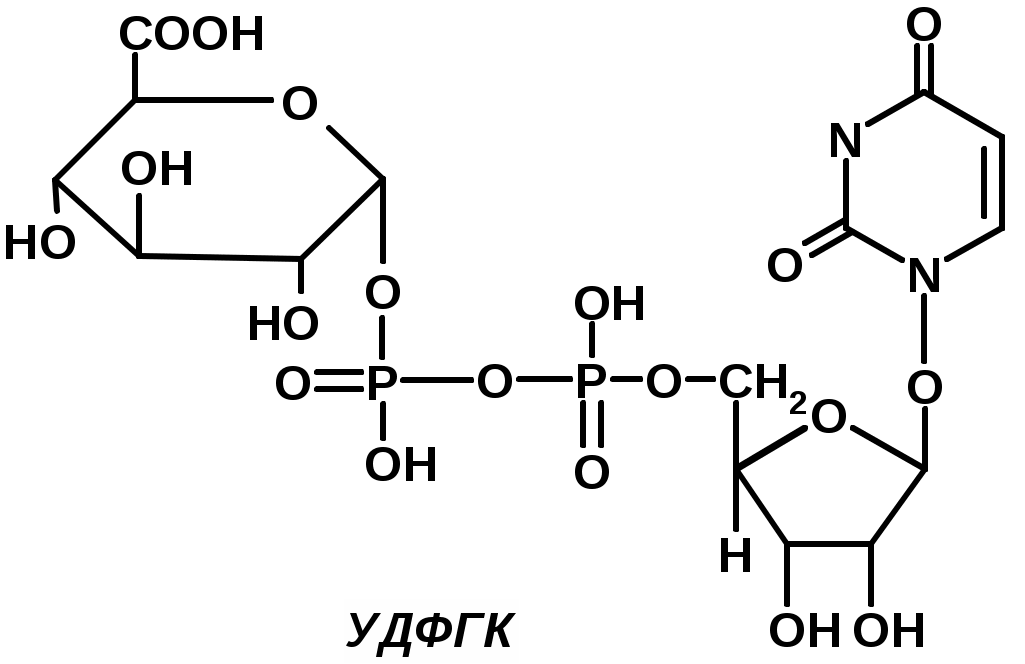 2) ФАФС – 3'-фосфоаденозин-5’-фосфосульфат (активная форма серной к-ты) [рис. этого соединения]. Механизм обезвреживания – конъюгация (связывание) токсина с активной формой серной или глюкуроновой к-ты. Продукты конъюгации – нетоксичные вещества, которые могут выделяться с мочой. Напр., обезвреживание фенола под действием УДФ-глюкуронил-трансферазы: фенол + УДФГК → (ТФ) фенилглюкуронид (фенил присоединяется по первому положению) + R-OH. Напр., обезвреживание индола: Индол окисляется кислородом по 7-му положению, получается индоксил (это типа 7-оксииндол). Индоксил взаимодействует с ФАФС под действием арилссульфо-трансферазы с образованием индоксилсерной к-ты, которая с ионами калия дает индикан (калиевая соль индоксилсульфата). Определение индола и индикана в моче имеет диагностическое значение. Так, если отсутствует индол, то обезвреживающая функция печени в норме, а если при этом обнаруживается индикан, то в кишечнике активное гниение. Если же есть индол в моче, то имеется нарушение обезвреживающей функции печени. Метаболизм аминокислотФонд АК организма пополняется за счет процессов: 1) гидролиза белков пищи, 2) гидролиза тканевых белков (под действием катепсинов лизосом). Расходуется АК-фонд на процессы: синтез заменимых АК, синтез собственных белков, синтез азотсодержащих веществ (урины, пиримидины, холин, креатин и т.д.), синтез углеводов (глюконеогенез), синтез липидов из кетогенных АК, распад до NH3, NH2-CO-NH2, мочевой к-ты и др. Условно метаболизм АК в тканях можно распределить на общие пути и индивидуальные пути обмена АК. Общие пути обмена веществ1. Переаминирование (открыто в 1937 г. Браунштейном и Крицмом). Роль: синтез заменимых АК, участие в непрямом дезаминировании АК. Определение АлАТ и АсАТ в крови имеет большое диагностическое значение. Так, через 5 часов после инфаркта миокарда АсАТ увеличивается в 20-30 раз, через 48 часов – АлАТ и АсАТ снижаются до нормы, еще через 24 часа повышается АлАТ. Также АлАТ повышается при патологии печени. 2. Дезаминирование (ДА) АК: восстановительное ДА – под действием микрофлоры кишечника, гидролитическое ДА – с участием воды, внутримолекулярное ДА – с образованием непредельной к-ты, окислительное ДА – характерно для тканей организма. Оно бывает прямым и непрямым. Прямое ДА идет с участием дезаминаз (оксидаз). NH2-CHR-COOH → NH=CR-COOH (иминокислота), при этом ФМН→ФМН·Н2, который затем восстанавливает кислород до пероксида водорода; последний расщепляется каталазой. А иминокислота гидролизуется до альфа-кетокислоты и аммиака. Непрямое ДА (или транс-ДА) идет в два этапа: 1) переаминирование (см. выше); 2) дезаминирование ГЛУ α-КГ + NH3, над стрелочкой глутамат-ДГ, под стрелочкой – НАД→НАД·Н2. 3. Декарбоксилирование АК – процессы образования биогенных аминов, обладающих биологической активностью: ГИС → (гистидил-ДК, ПФ) гистамин, ТИР → (оксигеназа, +1/2О2) ДОФА (диоксифенилаланин) → (ДК, ПФ, -СО2)дофамин, ТРИ → (оксигеназа, +1/2О2) 5-окситриптофан → (ДК, ПФ, -СО2) серотонин, ГЛУ → гамма-аминомасляная к-та (ГАМК). Дофамин и ГАМК – тормозные нейромедиаторы, гистамин – тканевой гормон. Серотонин является местным регулятором в функции периферических органов. |
