Биохимия и ее задачи
 Скачать 1.3 Mb. Скачать 1.3 Mb.
|
Строение коферментовКоферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами: - ковалентными связями; - ионными связями; - гидрофобными взаимодействиями и т.д. Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента. Все коферменты делят на две большие группы: витаминные и невитаминные. Коферменты витаминной природы – производные витаминов или химические модификации витаминов. 1 группа: тиаминовые – производные витамина В1. Сюда относят: - тиаминмонофосфат (ТМФ); - тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза; - тиаминтрифосфат (ТТФ). ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, -кетоглутаровая кислота. Этот фермент катализирует отщепление СО. Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла. 2 группа: флавиновые коферменты, производные витамина В2. Сюда относят: - флавинмононуклеотид (ФМН); - флавинадениндинуклеотид (ФАД). Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД. [рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ] 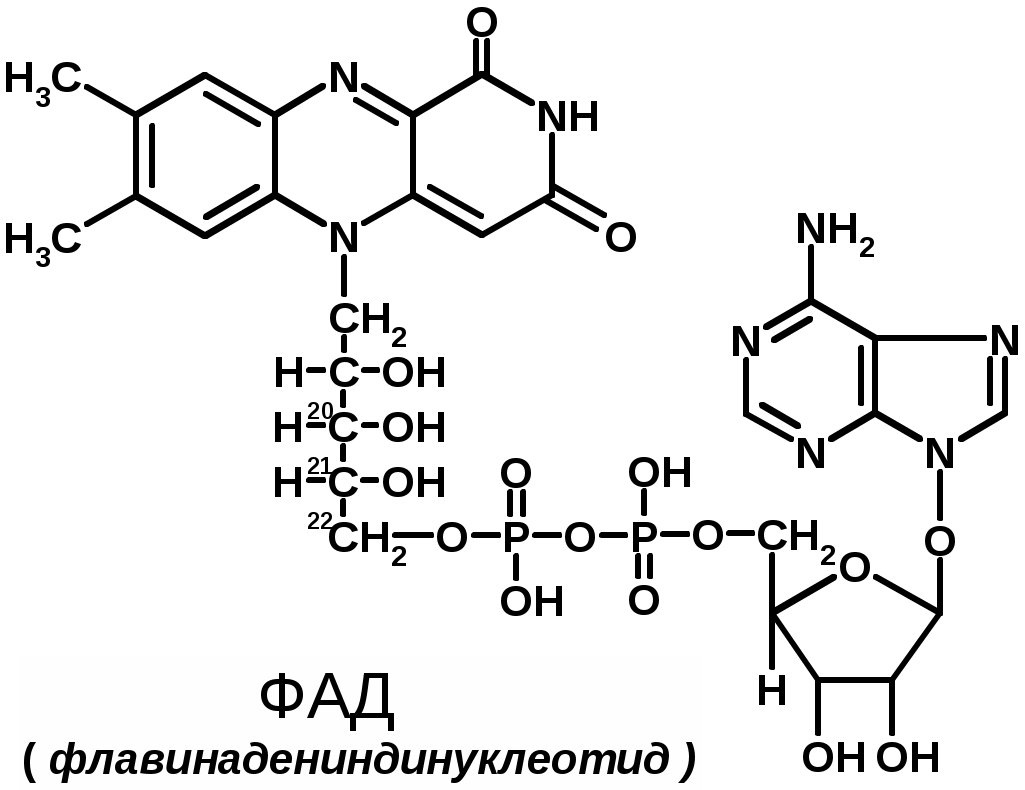 ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах. 3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую. 4 группа: никотинамидные, производные витамина РР - никотинамида: Представители: - никотинамидадениндинуклеотид (НАД); - никотинамидадениндинуклеотидфосфат (НАДФ). Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2. 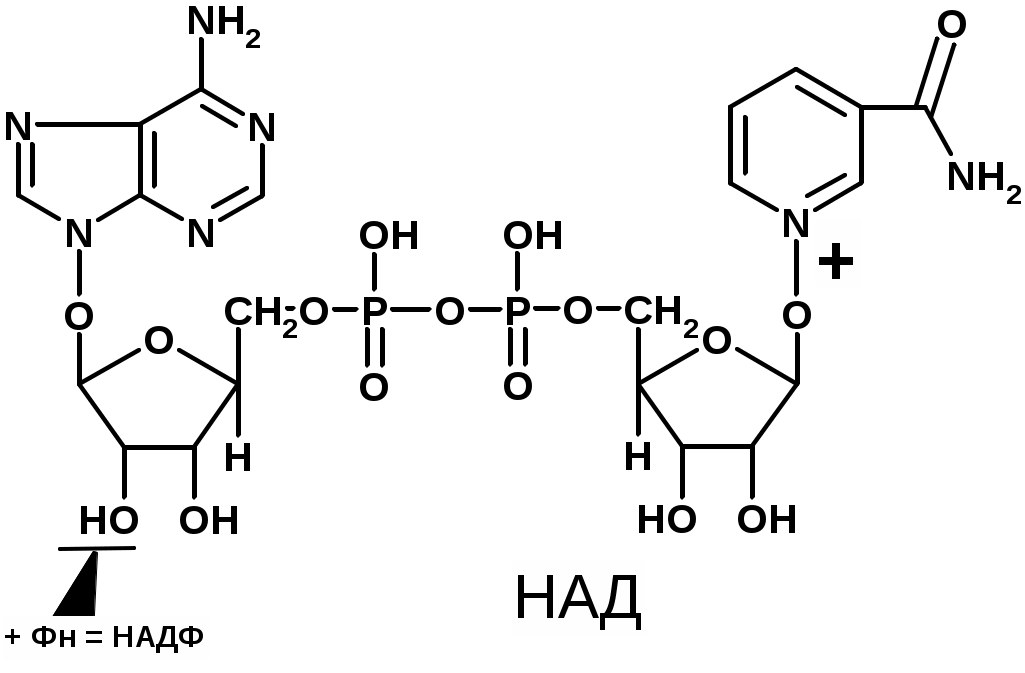 Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+] 5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат] - пиридоксин; - пиридоксаль; - пиридоксамин. Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ). ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК. Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма. 1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза). 2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д. 3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной. 4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы). Могут участвовать в: -присоединении субстратного комплекса фермента; -в катализе; -стабилизация оптимальной конформации активного центра фермента; -стабилизация четвертичной структуры. |
