БИОХИМИЯ НЕРВНОЙ ТКАНИ. Биохимия нервной ткани
 Скачать 371.33 Kb. Скачать 371.33 Kb.
|
SkoA→(АТФ) вЦТК
SkoA + HOOC-CH2-CH2-COOHМиозин представляет собой две полипептидные цепи, свернутые в двойную спираль. Конец (головка) молекулы миозина имеет глобулярное строение и связан нековалентно с четырьмя дополнительными короткими полипептидными цепями. При обработке трипсином миозин распадается на 2 фракции: легкий меромиозин и тяжелый меромиозин Н. Миозин – высокомолекулярный белок (более 440 000). Имеет участки, обладающие АТФ-азной активностью, проявляющейся в присутствии Са2+ .  Структура миозина Структура миозинаЛегкий мирозин отличается от тяжелого по аминокислотному составу свойствами. Тяжелый миозин обладает ферментативной активностью. Он является аденозинтрифосфотазой и гидролитически расщепляет АТФ. Это можно описать: АТФ + H2O→АДФ + H3PO4 + W (энергия). Актин – белок с более низкой молекулярной массой (42000). Может быть в двух формах: глобулярной (G) или фибриллярной (F). После прибавления солей G-актин легко переходит в F-актин. F-актин является полимером G-актина. Этот переход осуществляется под влиянием ионов К+: актин глобулярный →актин фибрилярный F. Актин F легко соединяется с миозином и образует новый белок-актомиозин. F-актин состоит из двух филаментов скрученных в спираль. 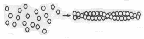 Структура актина Для актомиозина характерны следующие свойства:
Тропомиозин – состоит из двух полипептидных цепей образующих двойную спираль, располагается в бороздке на поверхности – F актина по длине соответствует 7 субъектам - G-актина. Комплекс тропонина состоит из трех субъединиц с глобулярной структурой и расположен примерно на концах Тm. Tропонин Т (TnT) обеспечивает связь с Тm. Tропонин С (TnC) образует связь с ионами Са2+ на поверхности Тm, в результате чего изменяется его конформация. Тропонин I (TnI) может предотвращать взаимодействие актина с миозином. Положение ТnI переменно и зависит от концентрации Са2+. В присутствии Са2+ изменяется конформация ТnC. Это приводит к изменению положения TnI по отношению к актину, в результате он может взаимодействовать с миозином. 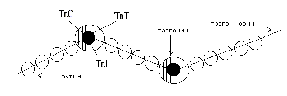 Тропомиозин и тропонин Тропомиозин и тропонин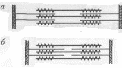 Точное пространственное расположение главных белков сократительной мышцы - необходимое условие сокращения и расслабления, а также регуляции этих процессов. Сокращение связано с образованием комплекса между актином и миозином, в котором каждая субъединица актина взаимодействует с сегментом, содержащим головку миозина (F1). Расслабление происходит при сокращении этого взаимодействия. Взаимодействие А и М регулируется T, который находится в бороздке актина. Изменение конформации Т передается на T, который погружается глубже в бороздку разрешая взаимодействие актина с головкой миозина. Точное пространственное расположение главных белков сократительной мышцы - необходимое условие сокращения и расслабления, а также регуляции этих процессов. Сокращение связано с образованием комплекса между актином и миозином, в котором каждая субъединица актина взаимодействует с сегментом, содержащим головку миозина (F1). Расслабление происходит при сокращении этого взаимодействия. Взаимодействие А и М регулируется T, который находится в бороздке актина. Изменение конформации Т передается на T, который погружается глубже в бороздку разрешая взаимодействие актина с головкой миозина. Состояние миофибриллы: а) покой; б) сокращение Миоглобин – сложный белок хромопротеин, по строению близок к гемоглобину, находится в красных мышцах, способен связывать и отдавать кислород, способствуя снабжению мышечных волокон кислородом. В состав белков протоплазмы входят ферменты гликолиза с высокой ферментативной активностью. Ферменты биологического окисления сосредоточены в митохондриях, где осуществляется окислительное фосфорилирование. В рибосомах, лизосомах содержатся ферменты, осуществляющие превращение белков и липидов. Оксимиоглобин отдает кислород только при значительном снижении парциального давления. Миоглобин извлекается из тканей аммиачным раствором. Соединительнотканные белки входят в состав оболочек клетки и субклеточных образований, стенок сосудов, нервов. Их содержание составляет до 20% от общего количества мышц. Это главным образом коллаген; они не извлекаются даже растворами солей. В мышце имеются аминокислоты, полипептиды, а также азотосодержащие вещества, которые легко извлекаются водой. Их называют экстрактивными веществами. К ним относятся креатин и креатинфосфат, на долю которых приходится до 60% всего небелкового азота. В покое весь креатин мышц представлен в виде креатинфосфата. Его концентрация в мышце довольно высокая (0,2-0,55%), в связи с тем, что он играет важную роль в передаче макроэргических связей внутри клетки, и обеспечивает ресинтез АТФ. Креатинфосфат (КрФ) - макроэргическое соединение, способное отдавать фосфорную группу на АДФ; реакцию катализирует креатинфосфаткиназа по схеме: АДФ + Крф →креатинфосфаткиназаАТФ–Кр (креатин)  Креатин синтезируется в почках из аргинина. 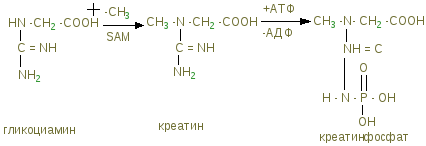 В мышцы креатин доставляется с кровью. Креатинфосфат (Крф) резерв макроэргических связей в мышце. 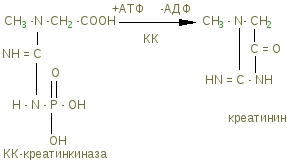 В мышцах можно обнаружить и некоторое количество креатинина, образующегося при разрушении Крф (креатинфосфата). К числу азотосодержащих экстрактивных веществ относится ансерин, карнитин, карнозин (β-аланин-гистидин). В мышцах высоко содержание адениловых нуклеотидов, которые относятся к экстрактивным веществам (до 0,4 %) АТФ, АМФ, АДФ. Углеводы представлены в основном гликогеном (0,5-0,8%). Основная масса гликогена организма сосредоточена в мышцах, хотя в печени его концентрация выше (5%). Моносахариды представлены преимущественно в виде гексозофосфатов, их концентрация не превышает концентрацию глюкозы в крови. Минеральные вещества – (зола) составляет 1-1,5% массы мышц. Наряду с К+ и Na+ в мышцах содержится Ca2+ и Мg2+, которые играют важную роль в механизме мышечного сокращения. В условиях покоя Са2+ сосредоточен преимущественно в трубочках и пузырьках саркоплазматического ретикулума. Основная масса фосфора (около 80%) мышечной ткани входит в состав макроэргических соединений (АТФ и креатинфосфат), 10% представлено в виде солей неорганического фосфата, 5% связано с гексозами и 5% входит в состав АДФ, АМФ и других нуклеотидов. Химический состав гладких мышц включает те же вещества, что и поперечно-полосатые мышцы, но в других количественных соотношениях. В них меньше актомиозина и миозина, но больше миоальбумина и нерастворимых белков стромы (коллагена). Содержание гликогена менее 0,5%, меньше и экстрактивных веществ. Содержание Са2+ в гладких мышцах ниже. Химизм мышечного сокращения Обмен веществ покоящихся мышц незначителен, при работе он повышается более чем в 100 раз. Для сокращения мышц необходимы: 1)гликоген, 2) миозин, 3) актин, 4) АТФ, 5) креатинфосфат, 6) ионы калия. Химизм мышечного сокращения в настоящее время рассматривается как результат взаимодействия между собой двух сократительных белков - актина и миозина за счет расщепления АТФ АТФ-азой миозина. Энергия, выделяющаяся при расщеплении АТФ, превращается из химической в механическую, нити актина вытягиваются между нитями миозина, саркомер укорачивается или напрягается. В условиях покоя АТФ не расщепляется, так как АТФ-азная активность миозина подавлена присутствием ионов магния. Роль магния – тормозить в условиях покоя гидролиз АТФ, при этом головки миозина получают энергию, которая обеспечивает смещение тропонина С и последующее зацепление ее за актиновую нить. Стимулом для включения сложного механизма служит нервный импульс, при его поступлении в синапс (на окончание двигательного нерва), выделяется медиатор - ацетилхолин – это создает разность потенциалов между наружной и внутренней мембраной. Вследствие этого выходит кальций из саркоплазматического ретикулума, где он находится в связи с белком кальсеквестрином, что обеспечивает увеличение его содержания в саркоплазме. Кальций действует, как антагонист магния, создает условие для проявления АТФ-азной активности миозина. АТФ расщепляется, сократительные белки взаимодействуют, мышца (саркомер) сокращается. Сокращение продолжается до тех пор, пока не поступают нервные импульсы и есть запасы АТФ. За счет энергии АТФ ионы кальция связываются саркоплазматическим ретикулумом, удаляется из саркоплазмы, их концентрация снижается. Происходит расслабление мышц. Поддержанию АТФ в должной концентрации обеспечивает высокий уровень содержания дыхательных ферментов. Увеличение кровоснабжения мышц при работе, ведет к увеличению притока кислорода, и питательных веществ. В начальный период может быть использован кислород, миоглобин, креатинфосфат, затем глюкоза, гликоген, липиды. Это обеспечивается высокой концентрацией гликогена и активностью ферментов гликолиза. Метаболизм в мышечной ткани Обмен веществ в состоянии покоя находится на относительно низком уровне, так как мышцы функционируют непостоянно. Метаболизм работающей мышцы направлен только на обеспечение мышечной работы и его специфика в первую очередь состоит в производстве молочной кислоты из гликогена, содержание которого достигает 1% от общего веса мышц. Здесь идет захват глюкозы, регулируемый инсулином и задерживаемый клеткой в виде глюкозо-6-фосфата гексокиназой с Кm = 10-5моль/л. Таким образом этот фермент фосфорилирует глюкозу до тех пор, пока глюкозо-6-фосфат не вступит во внутренний цикл: гл-6-ф↔гликоген. Известно, что гликоген распадается при увеличении концентрации глюкагона и адреналина в крови, однако сарколемма не имеет рецепторов для глюкагона и гликоген распадается при действии адреналина, причем аденилатциклаза обладает более высокой чувствительностью, нежели в печени. При расщеплении количества гликогена, находящегося в 1г мышцы до лактата освобождается 1-2 ккал энергии могущей быть использованной в сокращении мышцы. Интенсивная мышечная работа ведет к образованию большого количества молочной кислоты, которое может достигнуть 100 г. Накопление лактата ограничивает гликогенолиз и для ликвидации молочной кислоты требуется значительный период повышенного обмена. Происходит переход на аэробное окисление, благодаря увеличению транспорта кислорода в работающую мышцу и лактат окисляется до пирувата, который даст глюкозу и затем гликоген (в период отдыха), или в сердечной мышце окисляется до СО2 и Н2О при ликвидации “кислородной задолженности” с выделением большого количества энергии в цикле Кребса. Таким образом, молочно-кислое брожение идет в саркоплазме, а терминальное окисление – в митохондриях. В мышечной ткани особенно активны изоферменты лактатдегидрогеназы, причем ЛДГ1 сдвигает равновесие между лактатом и пируватом в сторону пирувата (в сердечной мышце) – начального метаболита аэробной стадии, а ЛДГ5 – в сторону лактата – конечного продукта анаэробного гликолиза (в скелетной мускулатуре). Дефекты в структуре ферментов, расщепляющих гликоген, приводят к гликогенозам. Так, в результате отсутствия или дефекта α1-4 гликозидазы (болезнь Помпе) вызывает слабость скелетных мышц, расширение сердца и смерть в раннем возрасте. Наиболее из гликогенозов распространена болезнь Мак-Ардля – следствие дефекта мышечной фосфорилазы, приводящего к судорогам при тяжелой мышечной работе. Симптомы выражены незначительно, так как мышца переходит на потребление энергии β-окисления жирных кислот при интенсификации липолиза. Т.к. β-окисление идет в митохонжриях, для транспорта жирных кислот из саркоплазмы необходим карнитин, концентрация которого в мышцах очень велика. β - окисление жирных кислот очень выгодный аэробный процесс, который доминирует при работе красных волокон сердечной мускулатуры. Здесь же хорошо сгорают кетоновые тела, сохраняя чистую глюкозу для питания мозга, куда не поступают жирные кислоты через гематоэнцефалический барьер. Катехоламины ускоряют липолиз и β-окисление, в результате увеличения содержания жирных кислот в крови. Кетоновые тела, образующиеся при неполном окислении жирных кислот в печени, в мышцах (особенно сердечной) тоже являются источником энергии. Для сердечной мышцы характерна реакция превращения ацетоацетата в энергетический продукт: митохондриальный фермент внепеченочных тканей CH3-CO-CH2-COOH + НOOС-СН2-СH2-CO |
ацетоацетил koA сукцинат
НSkoA
CH3-CO-CH2-СO

 SR + Ca++ - Выход Са++ из саркоплазматического
SR + Ca++ - Выход Са++ из саркоплазматического  A + T – Ca++ - активация актина
A + T – Ca++ - активация актина М – АТФ – А – образование актомиозина
М – АТФ – А – образование актомиозина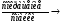 М – АДФ – А + Фн + работа – изменение угла соединения головки миозина с 90˚ до 45˚
М – АДФ – А + Фн + работа – изменение угла соединения головки миозина с 90˚ до 45˚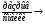 М – АТФ + А + АДФ
М – АТФ + А + АДФ 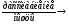 Т + SR – Ca++ + АДФ + Фн – связывание Са++
Т + SR – Ca++ + АДФ + Фн – связывание Са++