Мутации. Биологическая мембрана
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
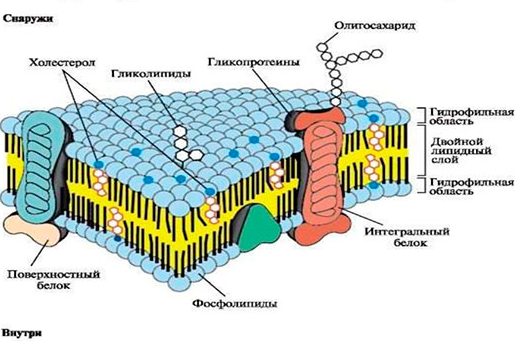
10–2 Н/м).Биологическая мембрана Основная единица живой материи, клетка, окружена мембраной. Биологические мембраны возникли в момент возникновения жизни, когда первичный "организм" отделился от окружающей среды. Биологические мембраны являются теми барьерами, которые отделяют клетки от внешней среды и разделяют различные органеллы и компартменты внутри клетки. Биологическая мембрана играет ключевую роль в организации и функционировании всех типов клеток. Плазматическая мембрана, окружающая каждую клетку, обеспечивает сохранение существенных отличий между содержимым клетки и внешней средой. Прокариоты, строение клеток которых является наиболее простым, окружены единственной плазматической мембраной и не имеют в своём составе других компартментов. Эукариоты, размер клеток которых намного больше, имеют сложное строение внутриклеточных мембран. Плазматическая мембрана, или плазмалема, является наиболее постоянной, основной, универсальной для всех клеток системой поверхностного аппарата. Субклеточные мембраны обеспечивают изоляцию от цитоплазмы клеточных компонентов и поддерживают содержание различных соединений (белков, углеводов, липидов, ионов). Мембраны участвуют в регулировании клеточной адгезии, транспорта молекул, передачи информации, катализа различных реакций, клеточных процессов (репликация ДНК, биосинтез белка, биоэнергетика, транспортные процессы и т. Д.). Мембраны определяют связи как внутри клеток, так и между клетками, участвуют в формировании клеточных транспортных систем и обеспечивают передачу клеточных сигналов. Биологические мембраны образуют физиологический и физический барьер между содержимым клетки и окружающей средой. То есть можно сказать, что мембрана образует селективный барьер между клеткой и окружающей средой, который регулирует и поддерживает ее гомеостаз. Можно условно выделить следующие пять основных групп функций, связанных с биомембранами: барьерная, транспортная, сигнальная, антигенная, коммуникативная. Структура биологических мембран Плазматические и субклеточные мембраны имеют структурные и функциональные особенности, но они также имеют много общих черт. Все мембраны примерно на 95% состоят из молекул липидов и белков, другие компоненты - углеводы (гликопротеины и гликолипиды) составляют около 5%. Все биологические мембраны имеют сходную структуру: мембранные липиды организованы в двойной слой толщиной около 60-100 Å, белки встроены в липидный бислой. Понимание того, что плазматическая мембрана представляет собой вполне определённую структуру, было достигнуто в середине XIX столетия. В конце XIX столетия Овертон обратил внимание на связь между скоростью, с которой небольшие молекулы проникают в растительные клетки, и их коэффициентом распределения между маслом и водой; это привело его к мысли о липидной природе мембран. В 1925 г. Гортер и Грендел предположили, что липиды в мембране эритроцитов образуют бимолекулярный слой (липидный бислой) Модель Гортера и Грендела возникла на основе результатов эксперимента. Липиды эритроцитов экстрагировали ацетоном и затем в кювете Лэнгмюра получали из них тонкую пленку на поверхности воды. С помощью поплавка сжимали слой липидных молекул на границе раздела вода-воздух до тех пор, пока этот слой не начинал оказывать сопротивление дальнейшему сжатию; это явление было объяснено образованием плотноупакованной мономолекулярной липидной пленки. Измерение площади, занимаемой липидами, и сравнение её с площадью поверхности эритроцитов, из которых эти липиды были экстрагированы, дали соотношение 2:1. Отсюда был сделан вывод, что мембрана эритроцитов состоит из липидных молекул, расположенных в два слоя. В историческом плане эта работа имела большое значение, поскольку с тех пор концепция липидного бислоя как структурной основы биологических мембран стала доминирующей и на самом деле оказалась верной. Эту гипотезу подтвердили в 1935 г. Коул и Кертис. Были определины электрические параметры биологических мембран. Мембраны обладают высоким электрическим сопротивлением и большой удельной ёмкостью (ёмкость, приходящаяся на единицу площади). Кроме липидов в состав мембраны входят белковые молекулы. Так, коэффициент поверхностного натяжения клеточных мембран значительно ближе к коэффициенту поверхностного натяжения на границе раздела белок-вода ( | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название кислоты | Обозна чение | Строение (химическая формула) | Тплавления (ºС) |
| Насыщенные жирные кислоты | |||
| Лауриновая | С12:0 | СН3(СН2)10СООН | 44,2 |
| Миристиновая | С14:0 | СН3(СН2)12СООН | 53,9 |
| Пальмитиновая | С16:0 | СН3(СН2)14СООН | 63,1 |
| Стеариновая | С18:0 | СН3(СН2)16СООН | 69,6 |
| Арахиновая | С20:0 | СН3(СН2)18СООН | 77 |
| Бегеновая | С22:0 | СН3(СН2)20СООН | 81,5 |
| Линоцериновая | С24:0 | СН3(СН2)22СООН | 88 |
| Ненасыщенные жирные кислоты | |||
| Пальмитолеиновая | С16:1 | CH3(CH2)5CH=CH(CH2)7COOH | –0,5 |
| Олеиновая | С18:1 | СН3(СН2)7СН=СН(СН2)7СООН | 12 |
| Линолевая | С18:2 | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН | –5 |
| α-Линоленовая | С18:3 | CH3CH2(CH=CHCH2)3(CH2)6COOH | –11 |
| γ-Линоленовая | С18:3 | CH3(CH2)4(CH=CHCH2)3(CH2)3COOH | –11 |
| Арахидоновая | С20:4 | СН3(СН2)4(СН=СНСН2)4(СН2)2СООН | –49,5 |
| Эйкозапентаеновая | С20:5 | H3CH2(CH=CHCH2)5(CH2)2COOH | –54 |
| Докозагексаеновая | С22:6 | CH3CH2(CH=CHCH2)6CH2COOH | –44 |
| Ацетэруковая | С24:1 | CH3(CH2)7CH=CH(CH2)13COOH | 39 |
Таблица 1. Основные биологические жирные кислоты
Гликолипиды — соединения, построенные из липидного и углеводного фрагментов, соединенных ковалентной связью. В гликолипидах функцию полярной головки выполняет либо моносахарид, либо разветвлённый олигосахарид. Гликолипиды составляют 2–10% общего количества липидов в плазматической мембране. Гпиколипиды содержатся во всех тканях, главным образом в наружном липидном слое плазматических мембран. Наибольшее их количество в тканях нервной системы. В гликолипидах отсутствует фосфатная группа.
Холестерол, органическое соединение из класса стероидов. Основой стероидов является углеводородная структура, состоящая из четырёх циклов. Холестерол – главный стероидный компонент животных клеток – имеет гидроксильную группу (OH) на конце одного из циклов. Особенно много холестерола в плазматических мембранах клеток млекопитающих, но он полностью отсутствует в большинстве прокариотических клеток. Холестерол из-за гидрофобности находится в основном в среднем слое липидного бислоя, его гидроксильная группа направлена к гидрофильным головкам фосфолипидов, а углеводородные цепи «хвостов» расположены параллельно углеводным цепям фосфолипидов.
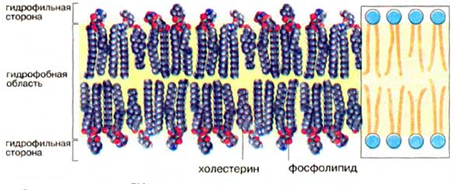
Рис. 2 Мембранные липиды
Для того, чтобы объяснить способность амфифильных мембранных липидов образовывать стабильную структуру, представляющую из себя двойной слой липидов, рассмотрим физические механизмы образования химических связей между молекулами и атомами.
Самыми сильными взаимодействиями в биомолекулах являются ковалентные связи, которые образуются между атомами благодаря квантово-механическому обобществлению электронов. При физиологических температурах ковалентные связи стабильны. Для того, чтобы их сформировать или разорвать, требуется значительная энергия. При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами. Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода (H2, О2, N2, Cl2, P4). При образовании полярной ковалентной связи — электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре. Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом (связи О-Н в структуре молекулы воды, связи С-Н в биологических молекулах).
Нековалентные взаимодействия являются определяющими в формировании функциональной структуры биомолекул и клеточных компонентов. Силы нековалентных межмолекулярных взаимодействий являются короткодействующими – они проявляются на расстояниях менее 10–9 м. Нековалентные взаимодействия подразделяют на:
электростатические (или ионные) взаимодействия;
ван-дер-ваальсовые силы;
водородную связь;
гидрофобные силы.
Электростатические силы обеспечивают взаимодействие между полностью или частично заряженными функциональными группами. Взаимодействие заряженных атомов или функциональных групп характеризуется электростатическим потенциалом. Интенсивность электростатических взаимодействий снижается за счёт диэлектрического эффекта, который зависит от того, какие атомы расположены между заряженными атомами и вокруг них. Вода является сильным диэлектриком, сильно уменьшая электростатическое взаимодействие ионов. Белки, напротив, являются слабыми диэлектриками.
Ван-дер-ваальсовые взаимодействия представляют собой силу притяжения, имеющую квантово- механическое происхождение, действующую между любыми двумя молекулами и обусловленную взаимодействиями между осциллирующими диполями. Это взаимодействие открыл в 1869 году голландский физик Ян Дидерик Ван-дер-Ваа́льс. Существуют различные типы ван-дер-ваальсовых сил:
диполь-дипольное взаимодействие полярных молекул;
индукционное взаимодействие диполя полярной молекулы с индуцированным диполем другой молекулы
дисперсионное взаимодействие индуцированных диполей двух молекул.
Диполь-дипольное взаимодействие дипольного момента полярной молекулы с электрическим полем, создаваемым другой полярной молекулой, может иметь характер притяжения или отталкивания в зависимости от взаимной ориентации диполей. Индукционное взаимодействие возникает тогда, когда молекула, обладающая постоянным дипольным моментом, наводит в другой молекуле, неполярной или полярной, так называемый индуцированный дипольный момент. Дисперсионное взаимодействие индуцированных диполей характерно для атомов и молекул, у которых нет электрических моментов. Дисперсионное взаимодействие (или сила Лондона) является наиболее распространенным, т.к. в нем участвуют и неполярные молекулы. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Водородная связь — притяжение между ковалентно связанным атомом водорода и ковалентно связанным электроотрицательным атомом (O, N, F, Cl). Для водородной связи необходимо наличие двух полярных ковалентных связей, в образовании одной из которых участвует атом водорода, несущий эффективный положительный заряд, а в другой — электроотрицательный атом (кислород, азот, галоген) с эффективным отрицательным зарядом. Водородные связи играют главную роль в обеспечении стабильности биомолекул и в обеспечении взаимодействия биомолекул между собой. Между молекулами воды проявляются сильные водородные связи. Вода заполняет клетки и межклеточные пространства и представляет собой ту среду, в которой осуществляются диффузия веществ, химические реакции и взаимодействия макромолекул (белков и нуклеиновых кислот) друг с другом. Кроме того, вода сама непосредственно участвует во многих химических реакциях клетки. Два свойства воды: способность образовывать водородные связи и обратимая ионизация – оказываются весьма существенными для протекания внутриклеточных процессов. Водородные связи слабее ковалентных (энергия водородных связей в жидкой воде, т.е. энергия, необходимая для разрушения одной связи, составляет примерно 18.8 кДж/моль, тогда как энергия ковалентных связей Н–О в молекулах воды примерно в 25 раз больше) и не так жёстко ориентированы, но их энергия несколько больше, чем характерная термическая энергия при физиологических температурах, поэтому они являются стабильными для биологических объектов. Поскольку они слабее ковалентных связей, их легче разорвать. Любые молекулы, между которыми возможны водородные связи, могут образовывать такие же связи с молекулами воды. Из-за такой конкуренции с молекулами воды водородные связи, образуемые между двумя молекулами в водном растворе, относительно слабы. Полярный характер молекулы воды делает её значительно лучшим растворителем, чем большинство других общеизвестных жидкостей. В воде растворяются очень многие вещества, причём растворимость неко- торых веществ определяется способностью воды образовывать водородные связи с гидроксильными и карбоксильными группами других молекул.
Возникающий в воде гидрофобный эффект определяет свойства биомолекул и взаимодействие между ними. Молекулы воды интенсивно взаимодействуют между собой, образуя водородные связи. Жидкая вода образуется перемещающимися молекулами воды, которые постоянно формируют и переформировывают водородные связи с соседними молекулами. Водородные связи между молекулами воды энергетически выгодны, поскольку при этом образуется много стабилизирующих взаимодействий и каждая молекула воды имеет неограниченное количество возможностей для взаимодействия со всеми остальными молекулами воды. Однако биомакромолекулы собраны, главным образом, из углерода, который очень слабо взаимодействует с окружающей водой. Когда углеводородные молекулы помещаются в воду, молекулы воды, окружающие углеводороды, теряют свою способность свободно формировать и перестраивать водородные связи с соседними молекулами воды. С одной стороны, они, взаимодействуя с углеводородами и образуя с ними слабые ван-дер-ваальсовые связи, проигрывают энергетически, поскольку они теряют возможность образовывать водородные связи с теми молекулами воды, на чьём месте расположилась молекула углеводорода. С другой стороны, молекулы воды, примыкающие к углеводороду, стремятся максимально использовать оставшиеся возможные взаимодействия с соседними молекулами воды, а это ограничивает их способность к свободному перемещению по водному раствору. Энергетически более выгодной является ситуация, когда углеводородные включения группируются, и общая площадь поверхности углеводородной фазы, которая доступна молекулам воды, уменьшается по мере ассоциирования углеводородных молекул. При этом множество молекул воды будут освобождаться в раствор, а углеводороды, в свою очередь, будут увеличивать число дисперсионных связей между собой. Все это снижает общую энергию системы и проявляется как гидрофобный эффект, собирающий углеводороды в единую фазу с возможно бо́льшим числом освобождённых в раствор молекул воды.
В результате описанного выше гидрофобного эффекта амфифильные липиды, нанесенные на поверхность воды, образуют тонкий мономолекулярный слой, в котором головки липидов связаны с водой, а хвосты направлены вверх, подальше от воды (рис. 3)
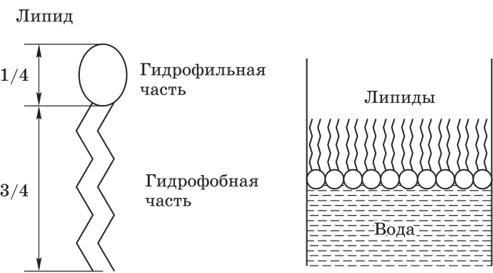
Рис. 3. Схема липидной молекулы и поведение липидов на поверхности воды
Если же эти липиды поместить внутрь воды, например, путем интенсивного встряхивания или воздействия ультразвука, то при малых концентрациях они образуют сферические структуры - мицеллы, в которых головки липидов обращены в сторону воды, а хвосты спрятаны внутрь мицелл. Подобные образования энергетически выгодны, так как при этом достигается минимум площади контакта гидрофобных участков липидов с водой. По мере увеличения концентрации липидов сначала образуются липосомы (везикулы, пузырьки) из двух слоев липидов, в которых головки обращены в сторону наружной и внутренней воды, а хвосты — друг к другу. Такие образования уже можно рассматривать как искусственные липидные мембраны. И, наконец, при слиянии везикул образуется обширный двойной слой липидов, который и является структурной основой биологической мембраны (рис. 4).
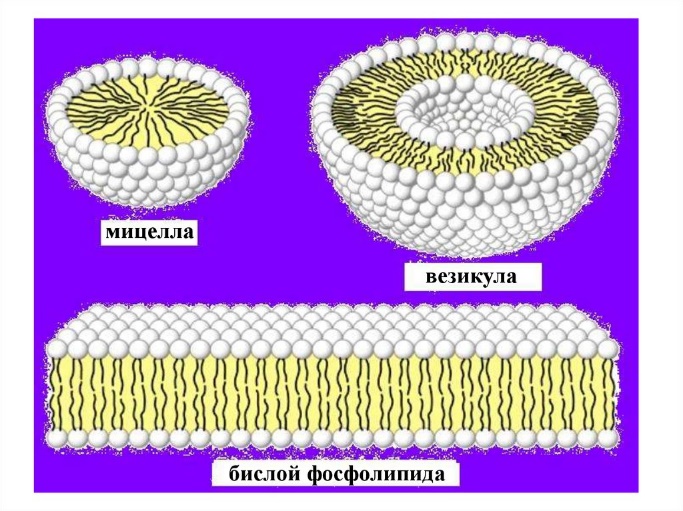
Рис. 4
Именно благодаря своей амфифильности липиды мембран самостоятельно организуются в воде в виде двойного слоя, являющегося структурной основой биомембран. При этом полярные головки липидов всегда направлены в сторону воды, а неполярные хвосты — внутрь липидного бислоя, толщина которого составляет 6-7 нм.
Таким образом, самосборка мембран, т.е. образование липидного бислоя со встроенными в него белками, происходит самопроизвольно, вследствие того что такая организация липидов и белков в воде энергетически выгодна.
Гидрофобные взаимодействия липидов в воде играют существенную роль в формировании мембран, во многом определяя процесс их самосборки и представляя собой один из основных факторов их стабилизации.
Стабильность двойного слоя мембранных липидов определяется слабыми нековалентными взаимодействиями: углеводные группы хвостов фосфолипидов взаимодействуют друг с другом силами ван-дер-ваальса, а головки фосфолипидов между собой – электростатическими силами. Между головками фосфолипидов и молекулами воды действуют водородные связи. Увеличение количества водородных связей способствует стабилизации мембраны. Благодаря гидрофобному эффекту взаимодействие гидрофобных групп молекул липидов с молекулами воды сводится к минимуму, что также способствует стабилизации липидного бислоя.
Следовательно, стабильность липидного бислоя определяется следующими факторами:
гидрофобным эффектом;
взаимодействием углеводных групп «хвостов» фосфолипидов друг с другом силами ван-дер-ваальса;
стабилизацией фосфолипидных «головок» благодаря водородным связям и электростатическим силам.
Физико-химические свойства фосфолипидов
В мембране клеток фосфолипиды имеют двойную функцию: они являются строительными блоками и модуляторами клеточных процессов. Важная роль мембранных фосфолипидов в происходящих в клетках процессах обусловлена их физико-химическими свойствами.
Можно выделить следующие основные свойства мембранных фосфолипидов:
избирательная (селективная) растворимость,
способность образовывать замкнутое пространство,
низкая проницаемость для молекул воды и заряженных ионов,
высокая проницаемость для молекул газов и небольших молекул липидов,
высокая подвижность (текучесть),
асимметрия,
высокое электрическое сопротивление.
Физические свойства фосфолипидов биологических мембран определяются их структурными особенностями (структура полярных «головок», длина жирнокислотных хвостов, количество двойных связей в ненасыщенных жирных кислотах).
В формировании структуры и свойств двойного слоя фосфолипидов главенствующую роль играет амфифильность фосфолипидов. Способность мембранных липидов образовывать замкнутое пространство связана с различной растворимостью в воде разных частей этих молекул.
Рассмотрим физические основы текучести мембранного липидного бислоя (или противоположной величины, вязкости), а также влияние этих свойств на процессы в клетке.
Липидные бислойные мембраны при физиологических условиях – жидкие, время оседлой жизни фосфолипидных молекул в мембране мало: 10-7 -10-8 с. Вместе с тем, молекулы в мембране размещены не беспорядочно, в их расположении наблюдается дальний порядок. Фосфолипидные молекулы находятся в двойном слое, а их гидрофобные хвосты приблизительно параллельны друг другу. Есть порядок и в ориентации полярных гидрофильных головок. Физическое состояние, при котором есть дальний порядок во взаимной ориентации и расположении молекул, но агрегатное состояние жидкое, называется жидкокристаллическим состоянием.
Итак, мембранный фосфолипидный бислой при физиологическихтемпературах имеет жидкокристаллическую структуру. Внутренний гидрофобный слой природных мембран, как правило, имеет низкую вязкость и является жидкостью.
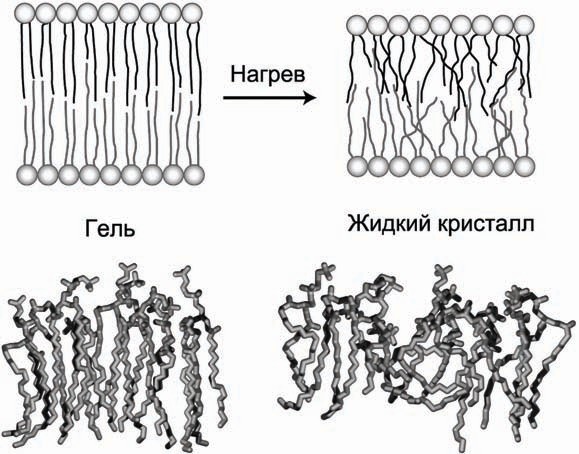 При изменении физических параметров окружающей среды (температура, давление) изменяется агрегатное состояние мембранных фосфолипидов, они переходят в твердое, кристаллическое (гелеобразное) или жидкое (разупорядоченное) состояние (рис. 5).
При изменении физических параметров окружающей среды (температура, давление) изменяется агрегатное состояние мембранных фосфолипидов, они переходят в твердое, кристаллическое (гелеобразное) или жидкое (разупорядоченное) состояние (рис. 5). Рис. 5. Фазовый переход гель–жидкий кристалл при нагреве мембраны
Изменение агрегатного состояния фосфолипидов влияет на физические свойства мембран (текучесть и вязкость) и, следовательно, оказывает влияние на биологические функции мембран.
Следует отметить, что силы Ван-дер-Ваальса, действующие между углеводными группами хвостов фосфолипидов, относительно стабильны при изменении температуры, хотя они могут быть модифицированы различными фармакологическими препаратами.
Помимо температуры на вязкость мембранного липидного бислоя влияет фосфолипидный состав, мембранный потенциал, давление, кислотность окружающей среды, содержание ионов кальция и т. д.
Важная роль входящих в состав мембраны липидов в регулировании текучести и вязкости мембранного липидного бислоя определяется:
- длиной неполярных хвостов фосфолипидов (числу звеньев в углеводородной цепочке CH2) (таблица 1);
- количеством ненасыщенных (двойных) связей в углеводородной цепочке;
- зарядом полярных «головок» фосфолипидов;
- содержанием холестерола;
- соотношением содержания фосфолипидов и холестерола в мембране;
- характером взаимодействия фосфолипидов с белками.
Следовательно, различные типы клеточных мембран характеризуются различной вязкостью.
При физиологической температуре компоненты мембраны находятся в постоянном движении (рис. 6), интенсивность которого определяет текучесть мембраны.
Тепловое движение липидных молекул сочетает в себе практически свободное вращение относительно оси молекулы и латеральную диффузию в плоскости мембраны. Гидрофобные жирнокислотные хвосты липидов при таких двух типах движения остаются погружёнными в гидрофобный внутренний слой мембраны.
И в природных, и в искусственных модельных мембранах частота латеральных перескоков липидов при физиологической температуре 370С порядка 107 с–1 и молекула пробегает за секунду расстояние порядка нескольких микрометров. Такая скорость латеральной диффузии свидетельствует о том, что вязкость биомембраны в 100 раз больше вязкости воды и приблизительно равна вязкости растительного масла.
И, несмотря на то, что молекулы липидов диффундируют в биомембране медленнее, чем компоненты окружающего водного раствора, любая молекула мембранного липида пробегает расстояние, сравнимое с длиной бактериальной клетки (˜1 мкм) за 1 секунду, а расстояние порядка длины животной клетки за 20 секунд.
Скорость вращательного движения относительно оси молекулы сравнительно низкая: один полный оборот совершается за несколько миллисекунд (10-3 секунды). Также «хвосты» молекул фосфоипидов совершают колебательные и вращательные движения. Это движение характеризуется относительно высокой частотой: несколько колебаний в наносекунду (10-9 секунд).
Мембранные фосфолипиды также могут совершать перескоки между монослоями мембранны. Этот процесс известен как "флип-флоп". Такой переход предполагает перемещение полярной головки через гидрофобный слой мембраны, а этот процесс чрезвычайно энергетически не выгоден и, соответственно, происходит очень редко. Вероятность таких переходов в 1010 раз меньше, чем вероятность латеральной диффузии, а их частота столь мала, что любая данная молекула липида перескакивает из одного монослоя в другой не чаще чем раз в месяц, тогда как вследствие латеральной диффузии липиды меняют свое положение до миллиона раз в секунду.
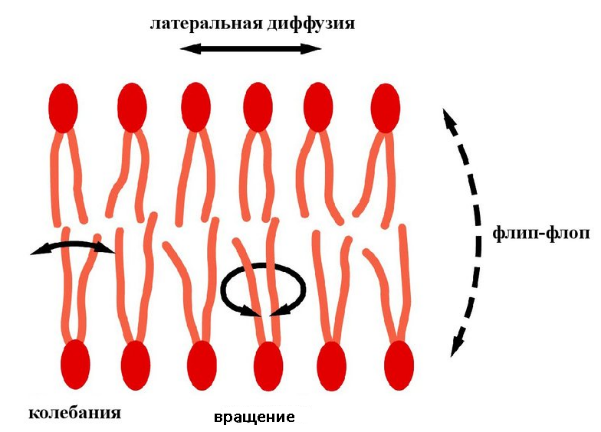
Рис. 6. Типы движений фосфолипидов в мембране
Низкая частота перемещений молекул фосфолипидов между монослоями определяет постоянство фосфолипидного состава мембранных монослоев и различный фосфолипидный состав мембранных монослоев, т. е. асимметрию мембран, что важно для поддержания клеточной структуры и функции. Распределение липидов в мембране является генетически детерминированным процессом, который может быть изменен только под воздействием различных катализаторов.
Всем типам мембран присуща асимметрия в распределении липидов в пределах мембраны. Хотя большинство липидов присутствуют в обоих монослоях бислоя, их концентрация, как правило, в одном из монослоёв намного выше, чем в другом. Например, в плазматических мембранах эритроцитов человека практически все сфингомиелины и фосфатидилхолины (и те, и другие образуют относительно менее жидкие бислои) обнаружены только в пределах монослоя экзоплазматической (внешней) стороны мембраны. И, наоборот, фосфатидилэтаноламин, фосфатидилсерин и фосфатидилинозитол (которые образуют более жидкие бислои) преимущественно локализованы в цитозольном (внутреннем) монослое мембраны. Избирательное расположение липидов на одной из сторон мембраны является физиологически необходимым для многих мембранных процессов. Структурная асимметрия мембраны, т. е. неравномерное распределение мембранных фосфолипидов на внутренней и внешней стороне мембраны, определяет селективную проницаемость мембраны. Асимметрия мембраны также проявляется в пределах отдельных сегментов монослоя, различный липидный состав этих сегментов связан с проявлением этими сегментами различных свойств.
На свойства липидного бислоя мембран влияют двойные ненасыщенные С=С связи в углеводородной цепочке жирнокислотных «хвостов» фосфолипидов. Наличие двойной связи ограничивает вращательное движение атомов углеводов в «хвостах» молекул фосфоипидов и уменьшает степень колебательного движения фосфолипидных «хвостов». В месте двойной связи «хвосты» занимают фиксированное положение и образуют угол (изгиб). Жёсткие изгибы жирнокислотных хвостов вследствие наличия ненасыщенных С=С связей препятствуют тесному сближению хвостов, приводят к ослаблению ван-дер-ваальсовых связей с соседями (по сравнению с насыщенными аналогами) и, следовательно, к "разжижению" бислоя (уменьшению вязкости).
Так, например, добавление ненасыщенной связи в 18-углеродный хвост стеариновой кислоты, температура плавления которой +69,60С (рис. 7(а)), приводит к образованию олеиновой кислоты, температура плавления которой +13,40С (рис.7(б)). 18-Углеродная линолевая кислота, у которой две ненасыщенных связи в хвосте, имеет температуру плавления –50С (рис. 7(в)), а у линоленовой (рис. 7(г)) и её изомера γ-линоленовой (рис. 7(д)) кислоты температура плавления равна –110С.
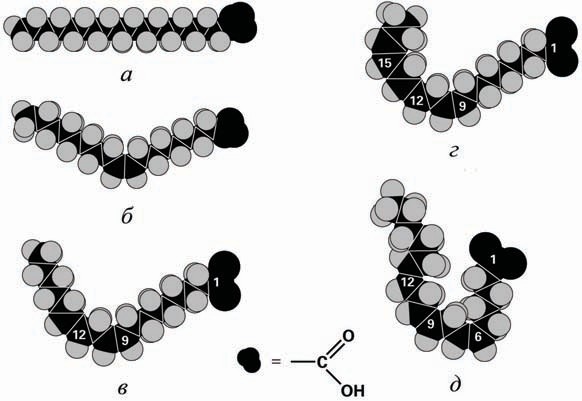
Рис. 7. 18-Углеродные жирные кислоты: а – стеариновая, б – олеиновая,
в – линолевая, г – линоленовая, д – γ-линоленовая
Высокое содержание ненасыщенных жирных кислот (фосфоглицериды и сфинголипиды) в структуре мембранных фосфолипидов способствует увеличению текучести мембран. В случае увеличения содержания ненасыщенных фосфолипидов в мембране наблюдается:
Усиление латеральной диффузии компонентов мембран (из-за ослабления взаимодействия между молекулами липидов);
Повышение проницаемости мембран (за счет снижения плотности расположения «хвостов» липидов);
Увеличение вероятности дестабилизации мембраны.
На вязкость биологических мембран влияет длина неполярных хвостов фосфолипидов. Гидрофобный эффект и ван-дер-ваальсовые взаимодействия вызывают агрегацию неполярных хвостов фосфолипидов. Причём для длинных хвостов с насыщенными С–С связями наблюдается максимальная агрегация, приводящая к образованию гелеобразных мембран. Это объясняется тем, что чем длинее хвосты, тем больше число ван-дер-ваальсовых связей между ними, что в свою очередь снижает степень свободного движения хвостов и увеличивает вязкость мембраны. А фосфолипиды с более короткими жирнокислотными хвостами, у которых гораздо меньшая площадь взаимодействий с соседями, образуют более жидкие менее вязкие бислои.
Таким образом, важными факторами, определяющими вязкость мембран, являются длина неполярных хвостов фосфолипидов и наличие ненасыщенных С=С связей. В частности:
Увеличение количества двойных связей в углеводородной цепочке жирнокислотных «хвостов» фосфолипидов при постоянстве температуры и длины неполярных хвостов снижает вязкость мембраны
Удлинение жирнокислотных «хвостов» фосфолипидов при постоянстве числа двойных связей и температуры увеличивает вязкость мембраны,
При любом сочетании длин неполярных хвостов и количества двойных связей в углеводородной цепочке жирнокислотных «хвостов» фосфолипидов рост температура снижает вязкость мембраны.
Следует отметить, что мембрана более текучая (жидкая) в гидрофобной части, а гидрофильная часть, содержащая полярные головки фосфолипидов, более жесткая (твердая). Это объясняется тем, что полярные головки фосфолипидов взаимодействуют с окружающими молекулами воды с образованием водородных связей, что обеспечивает плотность («цементирование») расположения головок. Таким образом, вода выполняет положительную роль в стабилизации липидного бислоя.
Гидрофильные «головки» фосфолипидов сильно различаются по размеру, заряду и другим параметрам. Свойства полярных головок отражаются на электропроводности мембран и на их способности связываться с различными белками. Например, миелиновая оболочка нервных волокон характеризуется низкой электропроводностью, что обусловлено высоким содержанием в ней липидов (особенно гликолипидов).
Влияние холестерола на свойства и функции мембраны
Различные типы мембран различаются содержанием холестерола. Холестерол, в отличие от фосфолипидов, практически одинаково присутствует в обоих монослоях бислоя мембраны.
Холестерол характеризует гидрофобность. Холестерол не может самостоятельно образовать бислой. При физиологических концентрациях холестерол внедряется между фосфолипидами: гидроксильная группа направлена к гидрофильным головкам фосфолипидов, а углеводородные цепи «хвостов» расположены параллельно углеводным цепям фосфолипидов.
Холестерол выполняет важную роль в регулировании вязкости мембран поскольку влияет на подвижность жирнокислотных хвостов мембранных липидов. Если мембрана слишком ригидна (твёрдость, неподатливость) и существует опасность «застывания» жирнокислотных цепей, холестерол вызывает ее разжижение, поскольку цепи в его присутствии становятся более подвижными. Если же мембрана слишком «жидкая», то холестерол ее уплотняет. Таким образом, холестерол играет роль регулятора, обеспечивающего правильную упаковку липидной части мембраны, необходимую для ее нормальной работы. Холестерол взаимодействует с "хвостами" фосфолипидов силами Ван-дер-Ваальса. Влияние холестерола на вязкость мембраны зависит от его концентрации и температуры.
Холестерол при физиологических температурах ограничивает случайное движение полярных головок фосфолипидов на наружных сторонах мембраны, увеличивает степень упорядоченности, уменьшает интенсивность латеральной диффузии.
При обычных концентрациях холестерола в условии физиологических температур взаимодействие стероидных циклов с длинными гидрофобными хвостами фосфолипидов затрудняет их свободное движение, что увеличивает вязкость мембран. При снижении концентрации холестерола вязкость биомембран снижается. Чем выше содержание холестерола в мембране, тем выше ее вязкость, ниже эластичность, способность к деформации и проницаемость для малых молекул.
При низких температурах холестерол уменьшает плотность плотно упакованных углеводных цепей, увеличивает свободный объем вокруг хвостов фосфолипидов и, следовательно, увеличивает текучесть внутреннего слоя мембраны, снижает температуру кристаллизации.