Занятие 1 биохимия. Биологическая роль пищевых белков
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Прямое окислительное дезаминированиеПрямое дезаминирование катализируется одним ферментом, в результате образуется NH3и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное). 1. Аэробное прямое окислительное дезаминированиекатализируетсяоксидазами D-аминокислот(D-оксидазы) в качестве кофермента использующимиФАД, иоксидазами L-аминокислот(L-оксидазы) с коферментомФМН. В организме человека эти ферменты присутствуют, но практически неактивны. 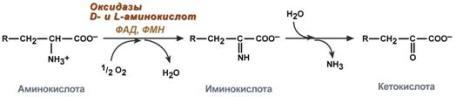 Рис. 5. Реакция, катализируемая оксидазами D- и L-аминокислот 2.Анаэробное прямое окислительное дезаминирование.Cуществует в митохондрии куда поступает глутамат. Катализируетсяглутаматдегидрогеназой, котораяпревращаетглутаматвα-кетоглутарат. Фермент человека состоит из 6 субъединиц (330 kDa), его положительный активатор – АДФ, отрицательный –ГТФ. Генетические мутации в области сайта связывания фермента с ГТФ приводят к заболеванию –гиперинсулинизм – гипераммонемическому синдрому). Далее α-кетоглутарат используется в ЦТК или в реакциях глуконеогенеза. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Это единственный фермент у млекопитающих использующий и НАД, иНАДФ. Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже). 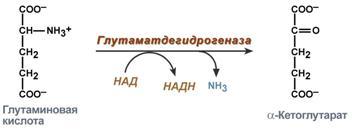 Рис. 6. Реакция прямого окислительного дезаминирования глутаминовой кислоты Непрямое окислительное дезаминирование (трансдезаминирование) Непрямое окислительное дезаминирование включает 2 этапаи активно идет во всех клетках организма. Первый этапзаключается в обратимом переносеNH2-группыс аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называетсятрансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается вглутамат ("аминокислота 2"). 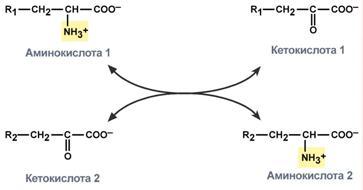 Рис. 7 . Схема реакции трансаминирования В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующиекетокислоты. Далее их улеродный кетоскелет катаболизирует специфическими путями и вовлекается вЦТК. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы вглюконеогенезе. Второй этапсостоит в отщеплении аминогруппы от аминокислоты 2 –дезаминирование. В организме человека как уже говорилось дезаминированию подвергается толькоглутаминовая кислота.Второй этап осуществляется естественно -глутаматдегидрогеназой. Следовательно, в организме млекопитающих коллектором всех аминокислотных аминогрупп является глутаминовая кислота. 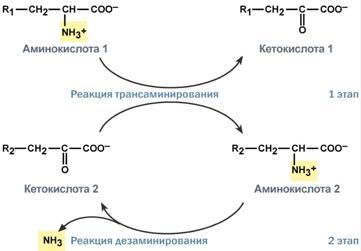 Рис. 8 . Схема обоих этапов трансдезаминирования Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессеаммониегенеза. Так как НАДН используется в дыхательной цепи, а α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергиии ингибируетсяизбытком АТФиНАДН. Роль трансаминирования и трансдезаминирования. Реакции трансаминирования: активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения, обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога), начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии, необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования углеродного скелета аминокислот в печенидлякетогенезаиглюконеогенеза, вдругих органах– для его прямого вовлечения в реакцииЦТК. при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для глюконеогенеза и способствуют патологической гипергликемии. Продукт трансаминирования глутаминовая кислота: является одной из транспортных форм аминного азота в гепатоциты, способна реагировать со свободным аммиаком, обезвреживая его. Процесс трансдезаминирования идет в организме непрерывно, потому что: сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печеньдля удаления азота путём синтеза мочевины и впочкидля синтеза аммонийных солей. 8. Глутаматдегидрогеназа: строение фермента, кофактор, уравнение реакции, регуляция фермента соотношением концентраций НАДН, АТФ+ГТФ/АДФ+ГДФ. Физиологическая роль глутаматдегидрогеназы в обмене азота аминокислот. Глутаматдегидрогена́за — фермент, катализирующий обратимую реакцию превращения L-глутаминовой кислоты в α-кетоглутаровую. Фермент присутствует как в прокариотических организмах, так и в эукариотических митохондриях. На стадии α-кетоглутаровой кислоты в цикле трикарбоновых кислот может иметь место выход этой кетокислоты из круга и превращение её в L-глутаминовую кислоту посредством аминирования за счёт свободного аммиака или обратимой реакции переаминирования. Установлено, что небелковым компонентом является или НАД или же НАДФ. Она является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы – АТФ, ГТФ, НАД(Ф)Н. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетке стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом) и ингибироваться эстрогенами и тироксином[1]. Дегидрогеназе L-глутаминовой кислоты принадлежит большая роль в обмене не только белков, где глутаминовая кислота благодаря реакции переаминирования занимает ключевое значение, но также в обмене углеводов и жиров посредством образования или удаления путём аминирования α-кетоглутаровой кислоты. Она является единственной дегидрогеназой, катализирующей окислительное дезаминирование натуральных аминокислот L-конфигурации, действующей через пиридиновые нуклеотиды и обладающей активностью, достаточной для того, чтобы играть значительную биологическую роль. Перекристализованный фермент наиболее устойчив в области pH 6,0-9,0 и может сохраняться в течение длительного времени в замороженном состоянии или в виде суспензии в растворе сульфата натрия. 9. Трансаминирование аминокислот. Общее уравнение процесса, субстраты, кофактор и механизм протекания процесса через образование шиффовых оснований. Биологическая роль трансаминаз, клиническое значение определения трансаминаз. Трансаминирование – реакции переноса -кетокислоту, в результате чего образуются новая кетокислота и новая аминонокислота. Реакции катализируют ферменты аминотрансферазы. Это сложные ферменты, коферментом которых является производное витамина В-аминогруппы с аминокислоты на Трансаминирование – реакции переноса 6 – пиридоксальфосфат, который обратимо может переходить в пиридоксаминфосфат. Реакции трансаминирования обратимы, и могут проходить как в цитоплазме, так и в митохондриях клеток. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина. Реакции трансаминирования протекают в 2 стадии. На первой стадии к пиридоксальфосфату в активном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент- пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин). На второй стадии пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции. 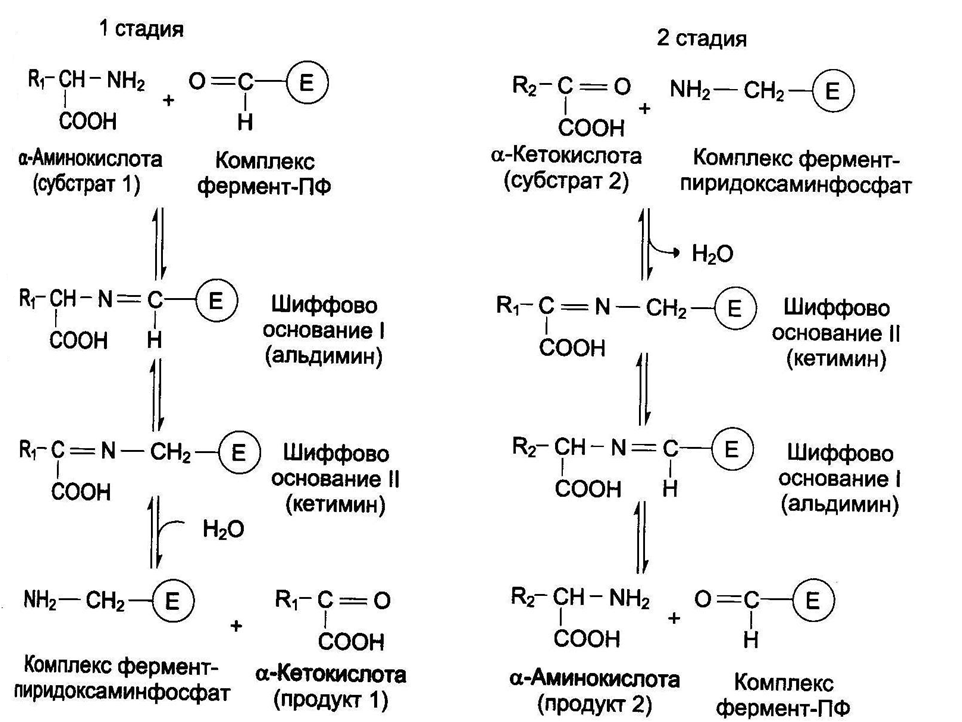 Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных – глутамат, аланин, аспартат. Наиболее распространенными в большинстве тканей являются аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ). Наибольшая активность АсАТ обнаруживается в клетках сердечной мышцы и печени, в то время как в крови обнаруживается только фоновая активность АлАТ и АсАТ. Поэтому можно говорить об органоспецифичности этих ферментов, что позволяет их широко примененятьих с диагностической целью (при инфарктах миокарда и гепатитах). |
