Занятие 1 биохимия. Биологическая роль пищевых белков
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
1. Роль белков в питании человека. Азотистый баланс и его виды. Заменимые и незаменимые аминокислоты. Норма потребления белка, коэффициент изнашивания, физиологический белковый минимум. Биологическая роль пищевых белков заключается в том, что они служат источником незаменимых и заменимых аминокислот. Аминокислоты используются организмом для синтеза собственных белков; в качестве предшественников небелковых азотистых веществ (гормонов, пуринов, порфиринов и др.); как источник энергии (окисление 1 г белков даёт примерно 4 ккал энергии). Пищевые белки делятся на полноценные и неполноценные. Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний. При безбелковой диете азотистый баланс становится отрицательным. Соблюдение подобной диеты в течение недели приводит к тому, что количество выделяемого азота перестаёт увеличиваться и стабилизируется примерно на величине 4 г/сут. Такое количество азота содержится в 25 г белка. Значит, при белковом голодании в сутки в организме расходуется около 25 г собственных белков тканей. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyt, оптимальное же количество при средней физической нагрузке составляет ∼100-120 г/сут. Полноценные пищевые белки - животного происхождения, содержат в своём составе все аминокислоты в необходимых пропорциях и хорошо усваиваются организмом. Неполноценные белки - растительного происхождения, не содержат, или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Так, зерновые культуры, дефицитны по лизину, метионину, треонину; в белке картофеля мало метионина и цистеина. Для получения полноценных по белку пищевых рационов, следует комбинировать растительные белки, дополняющие друг друга по аминокислотному составу, например, кукурузу и бобы. Суточная потребность: не менее 50 г в сутки, в среднем 80-100 г. +Белковая недостаточность в детском возрасте вызывает: 1. снижение сопротивляемости организма инфекциям; 2. остановку роста вследствие нарушения синтеза факторов роста; 3. энергетическую недостаточность организма (истощение углеводных и жировых депо, катаболизм тканевых белков); 4. потерю массы тела - гипотрофию. При белковом голодании наблюдаются отеки, которые возникают вследствие снижения содержания белков в крови (гипоальбуминемии) и нарушения распределения воды между кровью и тканями. 2. Ферменты, переваривающие белки в желудке (оптимум рН-действия, специфичность действия, результат действия). Механизм образования соляной кислоты и ее физиологическая роль. Ферменты-пептидазы тонкого кишечника (оптимум рН-действия, специфичность действия, результат действия). В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей. Переваривание белков в желудке Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию. Образование и роль соляной кислоты Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов -гастринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз в ходе реакций, представленных на рис. 9-2. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбонатдегидра-тазы): Н2О + СО2 → Н2СО3 → НСО3- + H+ Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы С1- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl. Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина. Механизм активации пепсина Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. Возрастные особенности переваривания белков в желудке У детей грудного возраста в желудке находится фермент реннин (химозин) , вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина. В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника. Трипсин – гидролизуетпептидные связи, образованными карбоксильными группами аргинина и лизина. Химотрипсин – гидролизует пептидные связи, образованные карбоксильными группами ароматических АК Карбоксипептидазы А и В – Отщепляют С-концевые остатки АК. Аминопептидазы – отщепляют N-концевые остатки АК пептидной цепи. Дипептидазы – расщепляют дипептиды на АК. Защита клеток от действия пептидаз: -ферменты образуются в виде неактивных предшественников. -слизистая оболочка покрыта слоем слизи. 3. Протеолиз эндогенных белков. Факторы, ускоряющие их деградацию: денатурация, активация лизосом. Протеосомы, убиквитин – зависимая система деградации белков. Каждая соматическая клетка данного организма обладает одинаковым набором генов, кодирующих разнообразные белки. Не все гены активны. Экспрессия многих генов является тканеспецифической – происходит только в клетках, принадлежащих той или иной ткани организма. В случае, если продукты нескольких генов выполняют одну и ту же функцию, клетке вполне достаточно правильной экспрессии одного из них. Экспрессия целого ряда генов запускается в определенных условиях - в нужный момент клеточного цикла или под действием соответствующих факторов среды. Белок выполняет закреплённую за ним функцию, а затем, в определённый момент, клетке необходимо от него избавиться. Последнее обусловлено рядом причин: во-первых, дальнейшая активность белка может навредить клетке, во-вторых, нужно синтезировать новые белки, а перегрузка цитоплазмы полипептидами является источником апоптоза. Переставшие быть необходимыми, белки подвергаются протеолитической деградации. Внутриклеточную деградацию белков долгое время считали неспецифическим случайным процессом. Настоящим прорывом в данной области послужило открытие убиквитинового сигнального пути. В рамках этого пути деградации белка, которая осуществляется крупным белковым комплексом - протеосомой, предшествует присоединение к нему "цепочки" молекул небольшого пептида убиквитина. Полиубиквитиновая цепочка навешивается в строго определённый момент и является сигналом, свидетельствующим о том, что данный белок подлежит деградации. Теперь ясно, что процесс внутриклеточного протеолиза жестко регулируется и чрезвычайно важен для множества базальных клеточных функций. Среди субстратов специфического протеолиза: регуляторы клеточного цикла, компоненты различных сигнальных путей, а также мутантные белки и белки, поврежденные посттрансляционно. Долгое время считали, что вышеупомянутому протеолизу подвергаются лишь белки, локализованные в цитоплазме, допускали возможность протеолиза ядерных белков. Сейчас ясно: система работает также в отношении белков, связанных с мембранами, секретируемых белков (для этого последние должны переместиться из эндоплазматического ретикулума в цитозоль путём обратного транспорта). Система внутриклеточного протеолиза вовлечена в такие процессы как пролиферация клеток, развитие и дифференцировка, реакция на стресс и патогены, репарация ДНК. Нарушения этой сложной системы являются причиной многих заболеваний. Стадии убиквитин-зависимого протеолиза Деградация белка по убиквитиновому пути включает две основные стадии:
Убиквитин и белки E1 - E3 Убиквитин представляет собой полипептид, содержащий 76 аминокислотных остатков. Присоединение убиквитина к белку происходит в три шага с участием трёх групп ферментов - Е1, Е2 и Е3: 1. Фермент Е1 активирует убиквитин: АТФ зависимо формируется макроэргическая связь между С-концевым глицином убиквитина и цистеином белка Е1. В связи с тем, что процесс активации универсален – одинаков для любого убиквитинового пути, организму достаточно одного варианта Е1. 2. Активированный убиквитин переносится на остаток цистеина белка Е2 (UBC – ubiquitin conjugating enzyme или UCP – ubiquitin carrier protein). Формируется новая макроэргическая связь. Клетка содержит несколько вариантов Е2 белков. Например, в геноме дрожжей закодировано тринадцать различных Е2. Один вид Е2 участвует в ограниченном количестве убиквитиновых путей, так как вовлечён в специфическое взаимодействие с определёнными белками класса Е3 (одним или несколькими). Существуют Е2, способные переносить убиквитин на субстрат самостоятельно, без участия Е3. 3. Белки класса Е3 представляют собой убиквитин-лигазы, способные специфически связываться с подлежащими деградации белковыми субстратами, напрямую или посредством вспомагательного белка. Е3 катализируют перенос убиквитина с Е2 на субстрат – образование пептидной связи между С-концом убиквитиновой единицы и аминогруппой лизинового остатка субстрата (в случае если это – первая молекула убиквитина, присоединяемая к данному белку) или с лизином-48 предыдущей молекулы убиквитина. Молекула убиквитина содержит семь остатков лизина. In vivo удалось обнаружить в полиубиквитиновых цепях связывание по 11, 29, 48 и 63 лизинам. Однако из вышеперечисленного протеосома узнает только цепи, связанные по 48 лизину. Е3 узнают определённый мотив в составе субстрата, называемый дегроном – то есть на уровне Е3 обеспечивается специфичность протеолиза. В связи с тем, что специфическому протеолизу подвергается огромное количество белков, вариантов Е3 в клетке особенно много. 4. Механизмы всасывания аминокислот в кишечнике. Транспорт аминокислот через клеточные мембраны: транспортные системы для аминокислот с разными радикалами, гамма-глутамильный цикл. Транспорт аминокислот в клетки Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа+-зависимых механизмов симпорта, подобно переносу глюкозы. Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: -нейтральных, с короткой боковой цепью (аланин, серии, треонин); -нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин); -с катионными радикалами (лизин, аргинин); -с анионными радикалами (глутаминовая и аспарагиновая кислоты); -иминокислот (пролин, оксипролин). 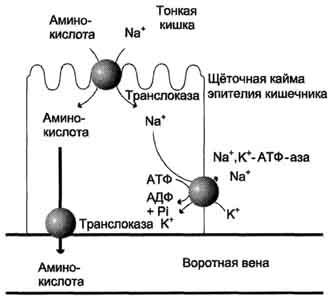 Рис. 9-4. Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа+,К+-АТФ-азы. Причём к числу Nа+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5). В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного остатка под действием фермента γ- глутамилциклотрансферазы. 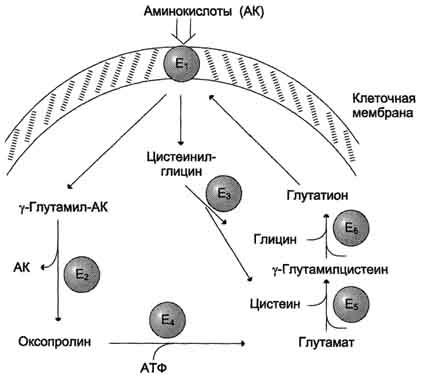 Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ. Нарушение переваривания белков и транспорта аминокислот Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. 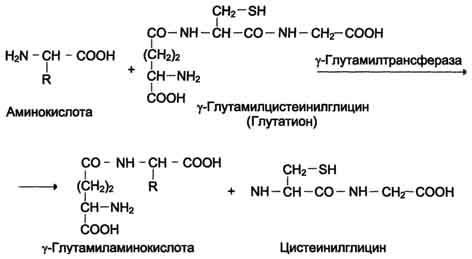 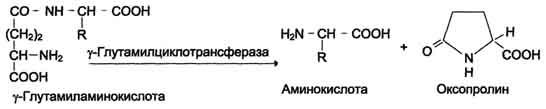 Схема А Схема Б Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии(нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках. 5. Общая схема путей поступления аминокислот в клетку и пути их использования 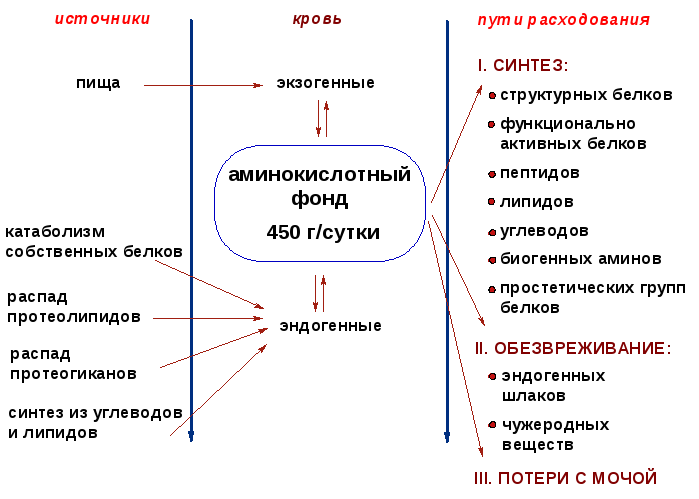 Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов и других соединений. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. В жидкой среде организма постоянно имеется определенное количество свободных аминокислот. Они образуют аминокислотный пул. Для человека массой 70 кг величина этого пула - 30 гр. Этот пул всегда пополняется за счет трех основных процессов. 1 источник - всасывание или поступление аминокислот из кишечника - так называемые пищевые аминокислоты. 2-й источник - это распад тканевых белков 3-й источник это синтез заменимых аминокислот. Аминокислоты постоянно изымаются из пула для использования в самых различных метаболических процессах Несомненно, что большее количество аминокислот из пула изымается на синтез белков. Для ресинтеза тканевых белков ежесуточно из пула изымается около 400 гр ам.к. Второй путь использования ам. к. это окислительный распад до конечных продуктов. Около 100 гр распадается , обеспечивая 10-15 % необходимой энергии для жизнедеятельности человека. Третий путь использование - синтез из ам.к. углеводов и липидов. Глюконеогенез идет достаточно интенсивно. В сутки мы синтезируем 100-120 гр глюкозы. Четвертый путь - синтез других азотосодержащих соединений ( креатин, холин, сфингозин, гем). 5 Синтез азотистых оснований нуклеотидов 6 Синтез биогенных аминов 7 Синтез других аминокислот за счет реакции трансаминирования 8 Синтез гормонов - производных аминокислот В целом за сутки через амино 6. Общие пути катаболизма аминокислот (схема, общий вид реакций). 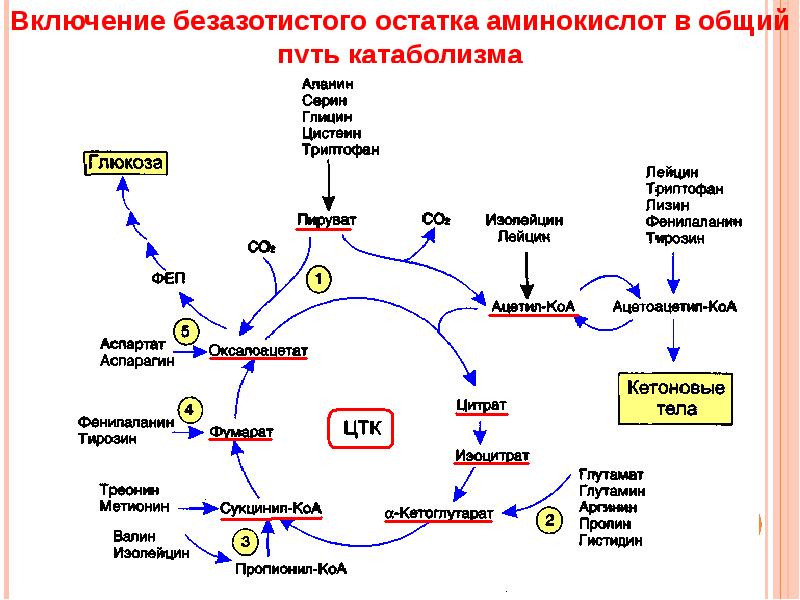 К общим путям катаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования. 2.1.1. Трансаминирование аминокислот – перенос аминогруппы (NН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В6). В реакции принимает участие альдегидная группа кофермента. Реакция легко обратима. Механизм реакции трансаминирования представлен на рисунке Роль реакций трансаминирования в организме:
2.1.2. Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода. Большинство ферментов, участвующих в окислительном дезаминировании аминокислот, при физиологических значениях рН малоактивны. Поэтому основная роль в окислительном дезаминировании принадлежит глутаматдегидрогеназе, которая катализирует прямое окислительное дезаминирование глутамата. В качестве кофермента используются НАД+ или НАДФ+ (производные витамина РР). Реакция обратима. 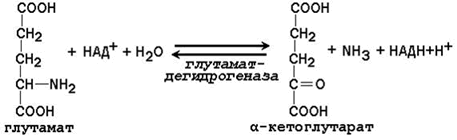 Глутаматдегидрогеназа – аллостерический фермент, его аллостерическими активаторами являются АДФ и ГДФ, аллостерическими ингибиторами – АТФ, ГТФ и НАДН. Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа:
 Участие аминотрансфераз в этом процессе позволяет собрать аминогруппы различных аминокислот в составе одной аминокислоты – глутамата, который затем подвергается окислению с образованием аммиака и α-кетоглутарата. 2.1.3. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являются биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме (см. таблицу 2.1). Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В6). Реакции являются необратимыми. 2.1.3.1. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию:  7. Прямое окислительное дезаминирование аминокислот: условия протекания, субстраты, ферменты, кофактор, общее уравнение реакции, продукты. |
