Занятие 1 биохимия. Биологическая роль пищевых белков
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Биологическое значение трансаминированияТрансаминирование – первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они необходимы в данный момент клеткам. В результате происходит перераспределение аминнного азота в тканях. При трансаминированиии общее количество аминокислот в клетке не меняется. Оксидазы D-аминокислот. При физиологических значениях рН в тканях высоко активны оксидазы D-аминокислот. Они также обнаружены в почках и печени и находятся в микросомах. Роль оксидаз D-аминокислот невелика и до конца не понятна, потому что в белки пищи и тканей человека входят только природные L-аминокислоты. +В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования серина, треонина, цистеина и гистидина неокислительным путем. 10. Непрямое дезаминирование аминокислот: общая схема процесса, ферменты, субстраты, кофакторы, роль глутамата. Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+). +Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.  11. Токсичность аммиака, пути его образования и способы утилизации. Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование. +Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака . 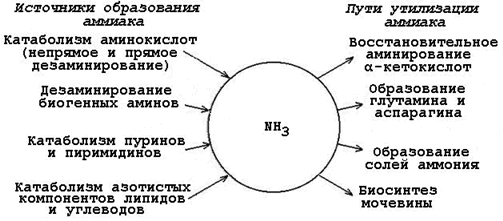 12. Синтез и распад глутамина – основной путь утилизации аммиака. Использование амидной группы глутамина в синтезе мочевины, солей аммония, пуриновых нуклеотидов и т.д. 1. Синтез глутамина.Реакция катализируется глутаминсинтетазой: Распределение и субклеточная локализация. Реакция протекает в цитозоле клеток всех тканей, но особенно выражена в мозге, где аммиак наиболее токсичен, и мышцах, где обмен белков мышц сопровождается образованием значительных количеств аммиака. Функции глутамина: a) во всех тканях глутамин является донором азота для синтеза важных молекул, в частности, для пуринового и пиримидинового синтеза; б) является нетоксичной формой транспорта аммиака из разных тканей к клеткам печени, где он превращается в мочевину; в) в кишечнике служит источником энергии для энтероцитов; г) в почках участвует в поддержании кислотно-щелочного равновесия. Гидролиз амидной группы в боковой цепи глутамина глутаминазой позволяет связывать протоны. Это особенно важно в условиях метаболического ацидоза. 2. Синтез мочевины. Печень — единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом ее синтеза. Участвуют митохондриальные ферменты и ферменты цитозоля. Суммарная реакция синтеза мочевины: Аспартат + NH3 + CO2 + 3АТФ 3 H2O + мочевина + фумарат + 2АДФ + АМФ + 2Фн + пирофосфат. Энергетический баланс. 3 молекулы АТФ расходуется на синтез каждой молекулы мочевины. 1.Синтез карбамоилфосфата (происходит в митохондриях): 2.Орнитиновый цикл мочевинообразования: Реакции декарбоксилирования Синтез серотонина: 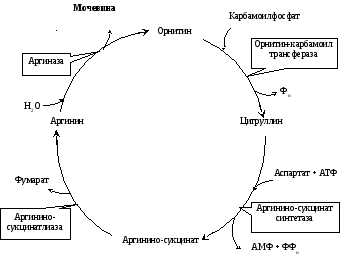 Биологическая роль серотонина: 1. Центральное действие (ЦНС) — повышение аппетита, регуляция памяти, настроения, поведения, функций сердечно-сосудистой и эндокринной систем. 2. Периферическое действие — активирует перистальтику, повышает агрегацию тромбоцитов, проницаемость мелких сосудов, оказывает радиопротекторное действие. Синтез гистамина: 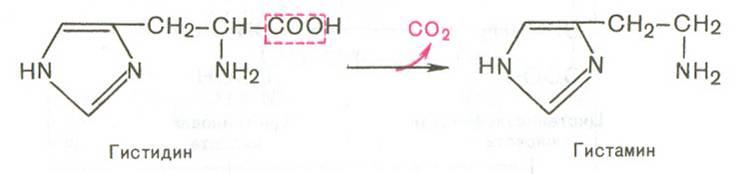 Биологическая роль гистамина: повышает тонус гладкой мускулатуры, расширяет капилляры, снижает АД, повышает секрецию желудка и выделение желчи, участвует в развитии воспаления и развитии боли. Биологическая роль гистамина: повышает тонус гладкой мускулатуры, расширяет капилляры, снижает АД, повышает секрецию желудка и выделение желчи, участвует в развитии воспаления и развитии боли.Синтез γ-аминомасляной кислоты (ГАМК): Биологическая роль ГАМК: медиатор торможения. Синтез дофамина, норадреналина и адреналина: + 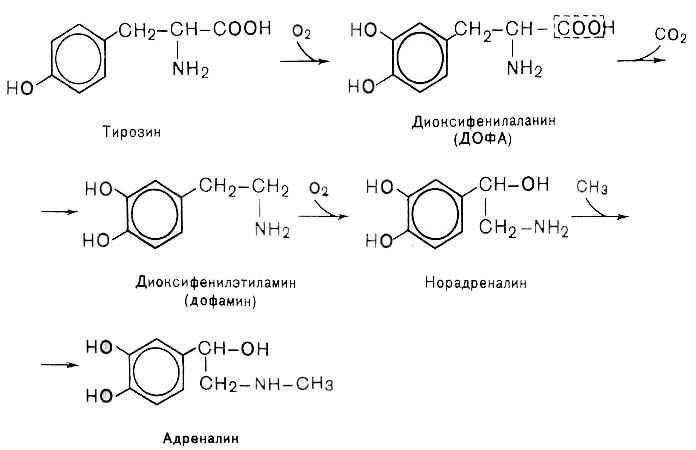 Биологическая роль катехоламинов: увеличивают потребление кислорода клетками, органами и организмом; повышают активность ферментов цикла Кребса, дыхательной цепи; стимулируют синтез АТФ; повышают АД. 13. Утилизация аммиака в орнитиновом цикле мочевинообразования (химизм процесса, локализация различных этапов, регуляция, количество выводимой мочевины в сутки, энергетические затраты). Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота . Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина). В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта" 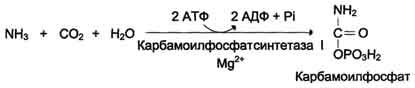 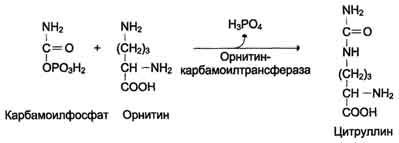 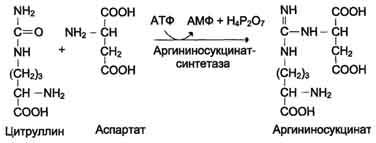 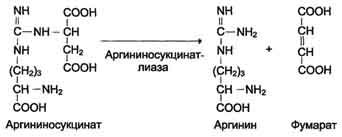 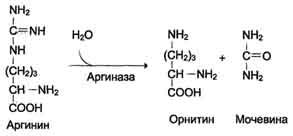 Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения Энергетический баланс процесса В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат: при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18); при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы АТФ. Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины. Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цитозоле. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+,Nа+-АТФ-азой, что тоже сопряжено с энергозатратами. Орнитиновый цикл в печени выполняет 2 функции: превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; синтез аргинина и пополнение его фонда в организме. Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины. Определение концентрации мочевины в крови широко используется в диагностике, применяется для оценки тяжести патологического процесса, для наблюдения за течением заболевания и оценки эффективности проводимого лечения. Однако не следует забывать, что на уровень мочевины в крови могут влиять не только патологические, но и физиологические факторы (характер питания, физическая нагрузка и т. д.), а также прием лекарственных препаратов. Уровень мочевины может изменяться как в сторону повышения, так и снижения. При физиологических процессах степень отклонения уровня мочевины от нормы, как правило, незначительна, в то время как при патологии наблюдаются значительные сдвиги, причем степень изменения уровня мочевины зависит от тяжести патологического процесса. Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5 — 8,3 ммоль/л (660 мг/л). У женщин, по сравнению со взрослыми мужчинами, концентрация мочевины в сыворотке крови обычно ниже. У пожилых людей (старше 60 лет) наблюдается некоторое увеличение концентрации мочевины в сыворотке крови (примерно на 1 ммоль/л по сравнению с нормой здоровых взрослых людей), что обусловлено снижением у пожилых способности почек концентрировать мочу. 14. Наследственные нарушения орнитинового цикла – гипераммониемии, их основные причины и проявления. На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины. Энергозатраты при этом частично компенсируются: · при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ; · в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ; Орнитиновый цикл в печени выполняет 2 функции: 1. превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; 2. синтез аргинина и пополнение его фонда в организме. Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени. Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут. Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут быть: 1. генетические дефекты ферментов орнитинового цикла в печени; 2. вторичное поражение печени в результате цирроза, гепатита или других заболеваний. Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Тяжесть течения заболевания зависит также от степени снижения активности ферментов. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л),глутамина и аланина. Гипераммониемия сопровождается появлением следующих симптомов: · тошнота, повторяющаяся рвота; · головокружение, тремор, судорожные припадки; · нечленораздельная речь; · потеря сознания, отёк мозга (в тяжёлых случаях); · отставание умственного развития (при хронической врождённой форме). · В тяжёлых случаях развивается кома с летальным исходом. Все симптомы гипераммониемии — проявление действия аммиака на ЦНС. Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени. Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов АК в рацион и стимуляцию выведения аммиака в обход нарушенных реакций: путём связывания и выведения NH3 в составе фенилацетилглутамина и гиппуровой кислоты. Пищевой фенилацетат при конъюгации с глутамином образует фенилацетилглутамин, а пищевой бензоат при конъюгации с глицином образует гиппуровую кислоту, которые потом выводится с мочой; повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций. Введение больших доз цитруллина стимулирует синтез мочевины из аспартата. Большие дозы аргинина стимулируют регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
РЕФЕРАТЫ. Гипераммониемии, их причины и клинические проявления. Механизмы всасывания аминокислот в кишечнике. Транспорт аминокислот через клеточные мембраны. |
